Dráha perforin/granzymové apoptózy je primární signální dráha používaná cytotoxickými lymfocyty k eliminaci viry infikovaných a/nebo transformovaných buněk. Studie na myších s narušeným genem naznačují, že perforin v kombinaci s granzymem by mohl indukovat apoptózu. Je nezbytný pro cytotoxickou efektorovou funkci a má nepostradatelnou, ale nedefinovanou roli v apoptóze zprostředkované granzymem.
Perforin a granzym
Perforin je protein tvořící póry a je také známý jako cytoplazmatické granulární toxiny. Granzym je rodina strukturně příbuzných serinových proteáz uložených v cytotoxických granulích cytotoxických lymfocytů (CL). Perforin a granzym kooperativně indukují apoptózu cílových buněk (obrázek 1). Granzym je nezbytný pro spuštění apoptózy cílových buněk, ale závisí na tom, zda je vhodně dodán perforinem. Perforin i granzym se vážou na povrch cílové buňky jako součást jediného makromolekulárního komplexu spojeného se serglycinem, což dále snižuje pravděpodobnost pasivní difúze granzymů.
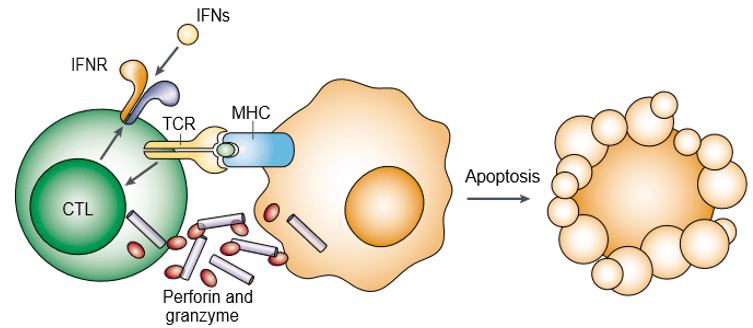
Obrázek 1. Perforin a granzym indukují apoptózu cílových buněk kooperativně.
U lidí se vyskytují granzym A, B, H, K a M, zatímco u myší granzym A, B, C, D, E, F, G, K, L, M a N. Granzym A (GrA) a granzym B (GrB) jsou nejhojněji zastoupené granzymy a byly nejvíce studovány. Funkce granzymů A a B při indukci apoptózy cílových buněk byly důkladně zkoumány in vitro a na molekulární úrovni jsou lépe pochopeny než úloha perforinu.
Proces a regulace dráhy apoptózy perforinu/granzymu
Po vylučování cytotoxickými lymfocyty vstupují granzymy do cílových buněk, což je zásadní krok v buněčné smrti. Hlavními lytickými proteiny zabalenými v granulích jsou různé granzymy a protein perforin tvořící póry, který usnadňuje internalizaci granzymů buňkami.
Granzym B spouští aktivaci kaspáz hlavně nepřímo, nikoli přímým zpracováním kaspáz. Dosahuje toho přímou aktivací proapoptotických „pouze BH3“ členů rodiny BCL-2, jako je agonista smrti interagující s BH3 doménou (Bid). Bid spolu s proapoptotickými proteiny Bax a/nebo Bak rodiny BCL-2 vede k úniku proapoptotických mitochondriálních mediátorů, jako je cytochrom c, do cytosolu. Uvolnění cytochromu c aktivuje prokaspázu-9 a vazbou na faktor 1 (Apaf-1) aktivující apoptotické proteázy se z prokaspázy-9 stává zralá kaspáza-9, která pokračuje v tvorbě apoptosomu a aktivuje následnou kaspázu-3. Aktivovaná kaspáza-3 je schopna štěpit specifické substráty, jako je ICAD (inhibitor kaspázou aktivované DNázy, CAD), což umožňuje CAD přemístit se do jádra a fragmentovat DNA. Kromě Bid může granzym B inaktivovat Mcl-1, který je členem anti-apoptotické rodiny Bcl-2, a uvolnit tak pro-anti-apoptotický protein rodiny Bcl-2 Bim na vnější mitochondriální membráně. A granzym B může také zprostředkovat efektorovou kaspázu-3 a iniciátorovou kaspázu-8 k regulaci dráhy apoptózy.
Na rozdíl od granzymu B není granzym M závislý na mitochondriální regulaci, ale granzym M může aktivovat granzym B štěpením inhibitoru proteinázy 9 (PI-9), který je inhibitorem granzymu B. Granzym M může také přímo štěpit ICAD a uvolnit tak CAD jako granzym B.
Granzym A vyvolává ztrátu potenciálu vnitřní mitochondrie a uvolnění reaktivních forem kyslíku (ROS). Vytváří spíše jednořetězcové zářezy DNA než oligonukleozomální fragmenty DNA. V reakci na ROS se komplex SET asociovaný s ER, zahrnující SET, Ape1, pp32, HMG2, NM23-H1 a TREX1, přemístí do jádra, kde granzym A štěpí tři členy komplexu SET, které se podílejí na opravě DNA:
Perforin/Granzymová cesta apoptózy v nemoci
Studie na myších s narušeným genem jasně ukazují, že perforinová cesta je úzce zapojena do obrany proti virovým patogenům a transformovaným buňkám. In vivo však byla prokázána i netušená role perforinu jako klíčového prostředníka imunitního dohledu nad spontánně transformovanými buňkami a v regulaci homeostázy B-buněk a paměti T-buněk. Paradoxně se perforin podílí na patogenezi některých modelů autoimunitních onemocnění, jako je diabetes závislý na inzulínu u neobézních diabetických myší (NOD), ale může potlačovat jiná autoimunitní onemocnění, včetně experimentální autoimunitní encefalomyelitidy (EAE).
Jsou určeny dráhy apoptózy perforin/granzym, které regulují polarizaci a exocytózu granulí, a tyto dráhy by mohly být narušeny interakcí nádorových buněk s některými cytotoxickými lymfocyty. Nedávná zjištění, že vstup granzymů do cílových buněk zahrnuje vazbu na specifické membránové receptory a že některé nádory syntetizují inhibitory serinových proteáz, které mohou neutralizovat granzymy, naznačily potenciální nové způsoby, jak by nádory mohly uniknout imunitnímu útoku.
.