XeF4 neboli tetrafluorid xenonu je chemická sloučenina složená z atomů xenonu a fluoridu. Jedná se o první objevenou binární sloučeninu na světě. Jedná se o typ vzácného plynu s chemickou rovnicí
Xe +2 F2 -> XeF4
XeF4 má pevný bílý vzhled a v pevném stavu má hustotu 4,040 g cm-3 . Za běžných podmínek se jeví jako bezbarvý krystal. Má sublimní teplotu 115,7 stupně Celsia nebo 240,26 stupně Fahrenheita. Stejně jako ostatní fluoridy xenonu má tetrafluorid xenonu exergonickou tvorbu. Při normální teplotě a tlaku zůstává ve stabilním stavu. Okamžitě reaguje s vodou a uvolňuje molekulární kyslík, fluorovodík a čistý plynný xenon.
| Název molekuly | Tetrafluorid xenonu (XeF4) |
| Číslo valence elektronů v molekule | 36 |
| Hybridizace XeF4 | sp3d2 hybridizace |
| Vazbové úhly | 90 stupňů a 180 stupňů |
| Molekulární geometrie XeF4 | Čtvercová rovina |
Zjistit více o jeho fyzikálních a chemických vlastnostech, je třeba znát jeho Lewisovu strukturu a molekulovou geometrii. Zjistíme Lewisovu strukturu tetrafluoridu xenonu.
Pro vytvoření Lewisovy struktury potřebujeme znát valenční elektrony XeF4, abychom mohli vytvořit jeho strukturu a znát rozmístění atomů v molekule.
Obsah
XeF4 Valenční elektrony
V této molekule máme jeden atom xenonu a čtyři atomy fluoru. Vypočítáme valenční elektrony obou těchto atomů, abychom určili celkový počet valenčních elektronů XeF4.
Valenční elektrony xenonu = 8
Valenční elektrony fluoru = 7*4 ( protože máme čtyři atomy fluoru, vynásobíme je 4)
Celkový počet valenčních elektronů Xef4: 8 + 7*4
: 8 + 28
: 36
Takže v XeF4 je celkem 36 valenčních elektronů.
Lewisova struktura XeF4
Teď, když známe valenční elektrony tetrafluoridu xenonu, bude pro vás snazší nakreslit jeho Lewisovu strukturu. Tato Lewisova bodová struktura je obrázkové znázornění valenčních elektronů kolem jednotlivých atomů v molekule spolu s vazbou, kterou tvoří.
Vazby jsou ve struktuře znázorněny pomocí čar, zatímco elektrony, které se neúčastní tvorby vazeb, jsou znázorněny jako tečky. Elektrony, které netvoří žádnou vazbu, se nazývají nevazebné elektrony nebo osamělé elektronové páry.
Jelikož je xenon nejméně elektronegativní atom, umístíme ho doprostřed a všechny ostatní atomy fluoru kolem něj takto:

Teď, když jsme umístili všechny atomy, zobrazíme vazby mezi jednotlivými atomy fluoru a xenonu. Každá vazba v molekule zabírá dva elektrony, a protože v této molekule jsou čtyři jednoduché vazby, je využito 8 elektronů z 36.
Začněte rozmísťovat zbytek valenčních elektronů kolem atomů. Každý atom fluoru bude mít kolem sebe šest valenčních elektronů, protože jeden elektron byl použit na vytvoření vazby.
Můžete si všimnout, že kolem atomů fluoru jsme již umístili 24 z 28 elektronů. Zbývající nevazebné elektrony nebo osamělé páry elektronů umístíme na xenon, protože je výjimkou z pravidla oktetu.
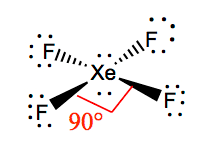
Umístěte tyto dva nevazebné páry elektronů na Xenon a nyní máte Lewisovu strukturu, kde jsou dva osamělé páry elektronů na Xenonu a šest nevazebných elektronů na každém atomu fluoru.
Hybridizace XeF4
Hybridizace orbitalů centrálního atomu Xenonu vede k vytvoření nových hybridizovaných orbitalů. Xenon má šest elektronů v orbitalech 5p a dva elektrony v orbitalech 5s. V základním stavu xenonu nejsou žádné elektrony v d-orbitalech a f-orbitalech. Když je však tento atom v excitovaném stavu, dva elektrony v p-orbitalech se přesunou do d-orbitálů; v důsledku toho jsou zde celkem čtyři nespárované elektrony. Z toho dva jsou na p-orbitálech a zbylé dva nespárované elektrony jsou na d-orbitálech. Tyto hybridizované orbitaly vedou k hybridizaci sp3d2 v XeF4.
Molekulární geometrie XeF4
Je snazší pochopit molekulární geometrii dané molekuly, jakmile známe její Lewisovu strukturu. Protože xenon má dva osamělé páry elektronů, zaujme strukturu, která těmto osamělým párům pomůže vyhnout se odpudivým silám. Aby tyto odpudivé síly byly co nejmenší, budou osamělé páry v kolmé rovině. A protože atomy fluoru jsou čtyři, bude mít molekula takové uspořádání, že její molekulová geometrie bude čtvercová. XeF4 má elektronickou geometrii oktaedrickou, takže molekulární geometrie tetrafluoridu xenonu je čtvercová.

XeF4 Vazebné úhly
Vazbové úhly F-Xe-F jsou 90 stupňů a osamělé páry mají úhly 180 stupňů. Atomy fluoru jsou vůči sobě umístěny pod úhlem 90 stupňů, což vede k symetrickému rozložení elektronů v rovině molekuly. Tyto vazebné úhly přispívají k vytvoření čtvercové rovinné geometrie molekuly.
Polarita XeF4 – je XeF4 polární nebo nepolární?
Ačkoli jsou vazby mezi atomy xenonu a fluoru polární, XeF4 je nepolární molekula. Zajímá vás jak? Všechny vazby Xe-F jsou vzájemně v opozici, takže součet dipólových momentů je nulový. Protože na atomu xenonu jsou čtyři elektrony, které jsou lokalizovány jako nevazebné páry elektronů. Protože celkové uspořádání atomů a elektronů v molekule je takové, že vektorový součet dipólů je nulový, je XeF4 nepolární molekula.
Závěrečné poznámky
Tetrafluorid xenonu je jednou z těch molekul, které jsou poměrně snadno pochopitelné. Jeho Lewisova struktura je jednou z nejméně komplikovaných struktur, protože všechny atomy fluoru jsou uspořádány symetricky. Osamělé páry v molekule jsou umístěny v kolmé rovině v oktaedrickém tvaru, aby jejich odpudivé síly byly minimální.
Shrneme-li tento příspěvek, můžeme říci, že XeF4 má 36 valenčních elektronů. Na centrálním atomu xenonu má dva osamělé páry nevazebných elektronů. Molekula má oktaedrickou elektronovou geometrii a čtvercovou planární molekulovou geometrii. XeF4 je nepolární molekula a má hybridizaci sp3d2
.