- Úvod
- Epidemiologie
- Organismus a patofyziologie průjmu způsobeného C. difficile
- Klinické projevy
- Diagnóza
- Praktické pokyny pro diagnostiku průjmových syndromů způsobených C. difficile
- Endoskopická diagnostika průjmu a kolitidy způsobených C. difficile
- Léčba
- Management recidivujícího průjmu způsobeného C. difficile
- Těžká kolitida způsobená C. difficile
- Závěr
Úvod
Průjem spojený s bakterií Clostridium difficile (CDAD) je stále častěji považován za příčinu nozokomiálních nákaz. Četnost a incidence CDAD se značně liší a je ovlivněna mnoha faktory, včetně nozokomiálních ohnisek, vzorců používání antimikrobiálních látek a individuální citlivosti. Neexistují žádné zprávy o prospektivních studiích nemocnic sledujících pozitivní toxin A nebo A/B a výsledky CDAD a jejích komplikací.
Centrum pro kontrolu a prevenci nemocí (CDC) analyzovalo sekulární trendy ve výskytu CDAD a zaznamenalo trvalý nárůst od roku 1987 do roku 2001 (1). V této zprávě 30 % ze 440 lékařů zabývajících se infekčními chorobami, kteří se zúčastnili internetového průzkumu, uvedlo, že se setkávají s vyšším výskytem CDAD, závažnějším průběhem CDAD a častějšími recidivami CDAD než v minulosti. Panuje celkový dojem, že došlo k nárůstu podílu případů se závažnými a smrtelnými komplikacemi a k nárůstu počtu relapsů u postižených pacientů.
Kromě morbidity a mortality je ekonomická zátěž infekce C. difficile v podobě opožděného propuštění a dalších nákladů na hospitalizaci značná.
Epidemiologie
Frekvence a výskyt CDAD se liší mezi nemocnicemi i v rámci daného zařízení v čase. Riziko onemocnění se zvyšuje u pacientů s expozicí antibiotikům, gastrointestinálními operacemi, prodlužující se délkou pobytu ve zdravotnickém zařízení, závažným základním onemocněním, stavy s oslabenou imunitou a vyšším věkem.
C. difficile se vylučuje ve stolici. Jakýkoli povrch, zařízení nebo materiál (např. komoda, koupací vana a elektronický rektální teploměr), který se kontaminuje výkaly, může sloužit jako rezervoár spor C. difficile. Spory se na pacienty přenášejí především rukama zdravotnického personálu, který se dotkl kontaminovaného povrchu nebo předmětu (2-6).
 klikněte pro větší verzi
klikněte pro větší verzi
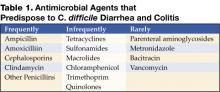
Obrázek 1 . Digitální rentgenový snímek z CT ukazuje nodulární haustální ztluštění v příčném tračníku.
Organismus a patofyziologie průjmu způsobeného C. difficile
C. difficile je grampozitivní, anaerobní, sporulující bacil, který je zodpovědný za vznik průjmu a kolitidy spojených s antibiotiky. C. difficile byl poprvé popsán v roce 1935 jako součást fekální flóry zdravých novorozenců a zpočátku nebyl považován za patogenní (7). Bacil byl pojmenován difficile, protože roste pomalu a obtížně se kultivuje. C. difficile je v současnosti zodpovědný za téměř všechny příčiny pseudomembranózní kolitidy a až za 20 % případů průjmů spojených s antibiotiky bez kolitidy. Ačkoli se vyskytuje ve stolici pouze 5 % běžné populace, až 21 % dospělých je tímto organismem kolonizováno během hospitalizace (2,6).
Změna normální mikroflóry tlustého střeva, obvykle způsobená antibiotickou terapií, je hlavním faktorem, který predisponuje k infekci C. difficile. Téměř všechna antibiotika jsou spojována s průjmem a kolitidou způsobenou C. difficile. Mezi nejčastěji spojovaná antibiotika patří klindamycin, cefalosporiny, ampicilin a amoxicilin (tabulka 1) (8).
Kromě antibiotické terapie jsou důležitými rizikovými faktory pro infekci C. difficile vyšší věk a závažnost základního onemocnění. Mezi další rizikové faktory patří přítomnost nazogastrické sondy, gastrointestinální zákroky, kyselé antisekreční léky, pobyt na jednotce intenzivní péče a délka hospitalizace (9).
Průjem způsobený C. difficile je způsoben především vývinem toxinů A a B, které vznikají množením bakterií ve střevním lumen. Tyto toxiny se vážou na sliznici tlustého střeva a působí na ni škodlivě. Organismus zřídka poškozuje tlusté střevo přímou invazí a průjem je způsoben účinky toxinů produkovaných ve střevním lumen, které ulpívají na povrchu sliznice. Většina toxigenních izolátů produkuje oba toxiny a přibližně 5-25 % izolátů neprodukuje ani toxin A, ani B a nezpůsobuje kolitidu ani průjem (3-5).
Klinické projevy
Infekce C. difficile může vyvolat širokou škálu klinických projevů, včetně asymptomatického přenášení, mírného až středně těžkého průjmu a fulminantního onemocnění s pseudomembranózní kolitidou (10). U pacientů, u nichž se vyvine CDAD, začínají příznaky obvykle brzy po kolonizaci. Ke kolonizaci může dojít během antibiotické léčby nebo až několik týdnů po podání antibiotik. CDAD je obvykle spojena s pasáží časté, volné stolice odpovídající proktokolitidě. Může být přítomen hlen nebo okultní krev, ale viditelná krev je vzácná.
Diagnóza
Diagnóza CDAD je založena na anamnéze nedávné nebo současné antibiotické léčby, rozvoji průjmu nebo jiných známek akutní kolitidy a průkazu infekce toxigenním C. difficile, obvykle detekcí toxinu A nebo toxinu B ve vzorku stolice.
 klikněte pro větší verzi
klikněte pro větší verzi
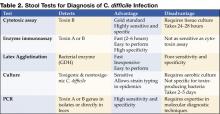
Obrázek 1 . Digitální rentgenový snímek z CT vyšetření ukazuje nodulární haustální ztluštění v příčném tračníku.
Praktické pokyny pro diagnostiku průjmových syndromů způsobených C. difficile
- Diagnóza by měla být podezřelá u každého, kdo má průjem a během předchozích 2 měsíců dostával antibiotika a/nebo u koho průjem začíná 72 hodin nebo déle po hospitalizaci.
- Při podezření na diagnózu by měl být do laboratoře odeslán jeden vzorek stolice k vyšetření na přítomnost C. difficile a/nebo jeho toxinů.
- Pokud průjem přetrvává i přes negativní výsledek na toxiny ve stolici, může být odeslán jeden nebo dva další vzorky k vyšetření stejnými nebo jinými testy (4). Endoskopie je vyhrazena pro zvláštní situace, např. když je nutná rychlá diagnóza a výsledky testu jsou opožděné nebo test není vysoce citlivý, když má pacient ileus a není k dispozici stolice nebo když přicházejí v úvahu i jiná onemocnění tlustého střeva.
Dosud neexistuje jednoduchý, levný, rychlý, citlivý a specifický test pro diagnostiku C. difficile a kolitidy, ani nejsou všechny dostupné testy vhodné pro přijetí každou laboratoří (tabulka 2) (11).
Endoskopická diagnostika průjmu a kolitidy způsobených C. difficile
Sigmoidoskopie a kolonoskopie nejsou u většiny pacientů s CDAD indikovány (10,12). Endoskopie je však užitečná ve zvláštních situacích, například když jsou pochybnosti o diagnóze nebo když klinická situace vyžaduje rychlou diagnózu. Výsledky endoskopického vyšetření mohou být u pacientů s mírným průjmem normální nebo mohou prokázat nespecifickou kolitidu u středně závažných případů. Nález pseudomembrán tlustého střeva u pacienta s průjmem spojeným s antibiotiky je prakticky patognomonický pro kolitidu způsobenou C. difficile. Několik pacientů bez jakýchkoli diagnostických znaků v rektosigmatu má pseudomembrány v proximálnějších oblastech tlustého střeva (13). Mezi další endoskopické nálezy patří erytém, edém, drobivost a nespecifická kolitida s drobnými ulceracemi nebo erozemi.
Léčba
Prvním krokem v léčbě průjmu a kolitidy způsobené C. difficile je pokud možno vysazení precipitujících antibiotik (10,12). Průjem ustoupí přibližně u 15-25 % pacientů bez specifické anti-C. difficile terapie (14,15). Samotná konzervativní léčba však nemusí být indikována u pacientů, kteří jsou systémově nemocní nebo mají více zdravotních problémů, protože je obtížné předpovědět, u kterých pacientů dojde ke spontánnímu zlepšení. Pokud není možné vysadit precipitující antibiotikum kvůli jiným aktivním infekcím, měl by se pacientův antibiotický režim pokud možno změnit tak, aby se používaly látky, u nichž je méně pravděpodobné, že způsobí CDAD (např, Aminoglykosidy, trimetoprim, rifampicin nebo chinolon).
Je třeba se vyhnout antiperistaltikům, jako je difenoxylát plus atropin (Lomotil) nebo loperamid (Imodium), a narkotickým analgetikům, protože mohou zpomalit vylučování toxinů z tlustého střeva a tím zhoršit toxinem vyvolané poškození tlustého střeva nebo precipitovat ileus a toxickou dilataci (12,16). Specifická terapie k eradikaci C. difficile by měla být použita u pacientů s původně závažnými příznaky a u pacientů, jejichž příznaky přetrvávají i přes přerušení antibiotické léčby. Ačkoli diagnóza kolitidy způsobené C. difficile by měla být v ideálním případě stanovena před nasazením antimikrobiální léčby, současná doporučení ACG doporučují, aby byla empirická léčba zahájena ve velmi sugestivních případech těžce nemocných pacientů (tabulka 3 na straně 54) (12).
V současné době jsou perorální vankomycin nebo metronidazol, používané po dobu 7 až 10 dnů, považovány většinou autorů a současnými doporučeními za léčbu první volby. Metronidazol v dávce 250 mg 4krát denně doporučuje většina autorů a ACG guidelines jako lék volby pro počáteční léčbu kolitidy způsobené C. difficile (12). Tato doporučení jsou z velké části založena na účinnosti, nižších nákladech a obavách ze vzniku kmenů rezistentních vůči vankomycinu. Mezi hlavní nevýhody metronidazolu patří méně žádoucí lékový profil a kontraindikace u dětí a těhotných žen.
Vankomycin je naproti tomu v dávce 125 mg 4krát denně bezpečný a dobře snášený a dosahuje hladin ve stolici 20krát vyšších, než je požadovaná minimální inhibiční koncentrace pro léčbu C. difficile. Nevýhodou používání vankomycinu jsou náklady a možný rozvoj kmenů rezistentních na vankomycin. Současná doporučení ACG považují vankomycin za lék volby u těžce nemocných pacientů a v případech, kdy je vyloučeno použití metronidazolu.
U pacientů s fulminantní kolitidou, kteří nemusí tolerovat perorální léčbu, chybí kontrolované klinické studie. V malých sériích případů bylo popsáno podávání metronidazolu intravenózně nebo podávání vankomycinu nazogastrickou sondou nebo rektálním klyzmatem (17-20). Intravenózní podání vankomycinu se nedoporučuje, protože lék se v tlustém střevě nevylučuje (17).
Management recidivujícího průjmu způsobeného C. difficile
I přes úspěšnou počáteční léčbu CDAD se u 15-20 % pacientů objeví recidiva průjmu v souvislosti s pozitivním testem stolice na toxin C. difficile. Symptomatická rekurence je zřídka způsobena selháním léčby nebo antimikrobiální rezistencí na metronidazol nebo vankomycin. Přístupy k léčbě zahrnují konzervativní terapii (mnoho pacientů je však starších a nemohoucích a není schopno průjem tolerovat), terapii specifickými antibiotiky proti C. difficile, použití pryskyřic vážících anionty, terapii mikroorganismy (probiotiky) a imunoglobulinovou terapii.
Nejčastější terapií recidivujícího průjmu způsobeného C. difficile je druhá kúra stejného antibiotika použitého k léčbě první epizody (12). V rozsáhlé observační studii ve Spojených státech 92 % pacientů s recidivující CDAD úspěšně reagovalo na jeden opakovaný cyklus léčby, obvykle metronidazolem nebo vankomycinem (14). Existují důkazy, které naznačují, že pacienti s anamnézou recidivy mají vysoké riziko dalších epizod CDAD po ukončení antibiotické léčby. Neexistují žádné údaje, které by naznačovaly, že se následné epizody stávají postupně závažnějšími nebo komplikovanějšími (21). U pacientů s opakovanými recidivami průjmu způsobeného C. difficile byla navržena řada léčebných schémat. Jedním z přístupů je podávání prodlouženého cyklu vankomycinu (nebo metronidazolu) za použití klesajícího dávkovacího schématu s následnou pulzní terapií (tabulka 4).
Cholestyramin, aniontová výměnná pryskyřice podávaná v dávce 4 g 3krát až 4krát denně po dobu 1 až 2 týdnů, váže toxiny C. difficile a může být použit ve spojení s antibiotiky k léčbě opakovaných recidiv. Protože cholestyramin může vázat vankomycin i toxiny, měl by se užívat s odstupem nejméně 2 až 3 hodin od vankomycinu.
Těžká kolitida způsobená C. difficile
Podle údajů je výskyt fulminantní kolitidy způsobené C. difficile 1,6-3,2 % (22). Ačkoli chybí recentní přesné údaje z jiných center, je uznávána jako stále častější příčina komplikací a úmrtí. Klinický syndrom fulminantní kolitidy způsobené C. difficile lze rozpoznat při správné znalosti spektra projevů onemocnění.
A. Průjem: Ačkoli je průjem charakteristickým znakem kolitidy vyvolané C. difficile, není vždy přítomen a jeho nepřítomnost může vést k diagnostickým nejasnostem. Pokud průjem chybí, jedná se zřejmě o sekundární příčinu závažné dysmotility tlustého střeva. I když je průjem přítomen, může být vnímán jako méně významná součást nespecifického septického obrazu.
 Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
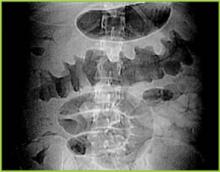
Obrázek 1 . Digitální rentgenový snímek z CT vyšetření ukazuje nodulární haustální ztluštění v příčném tračníku.
 Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
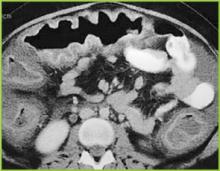
Obrázek 2 . CT snímek horní části břicha potvrzuje výrazné haustrální ztluštění v příčném tračníku.
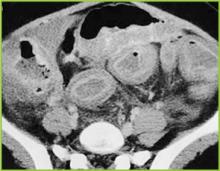 Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
Přetištěno se svolením z BUMC Proceedings 1999; 12:249-250
Obrázek 3 . CT snímek středu břicha prokazuje výrazné ztluštění celého tlustého střeva. V perikolonickém tuku jsou přítomny mírné zánětlivé změny.
B. Těžké onemocnění: Fulminantní kolitida je neobvyklá forma infekce C. difficile, která se vyskytuje pouze u 3 % pacientů, ale představuje prakticky všechny závažné komplikace. Pacienti s těžšími formami onemocnění se mohou projevovat průjmem nebo bez průjmu. Pokud se u pacientů vyvine kolitida lokalizovaná na céku a pravé straně tlustého střeva, průjem může být minimální nebo může chybět. Při absenci průjmu mohou být jediným vodítkem k diagnóze systémové příznaky toxicity (horečka, tachykardie, leukocytóza a/nebo deplece objemu).
Zvýšený počet bílých krvinek může být důležitým vodítkem pro hrozící fulminantní kolitidu způsobenou C. difficile. Rychlé zvýšení počtu periferních bílých krvinek (běžně až 30 000 až 50 000) s výrazným nadbytkem pásem a někdy i nezralejších forem často předchází hemodynamické nestabilitě a rozvoji orgánové dysfunkce. I u pacientů, kteří jsou po delší dobu mírně symptomatičtí, může dojít k náhlé a neočekávané progresi do šoku. Je obtížné předvídat ty pacienty, kteří nemusí reagovat na medikamentózní léčbu. Proto mohou být neocenitelné včasné varovné příznaky, jako je leukemoidní reakce.
Hypotenze je pozdní nález a může být rezistentní na vazopresorickou podporu. Břišní příznaky se pohybují od distenze po generalizovanou citlivost se strážením. Perforace tlustého střeva je obvykle doprovázena rigiditou břicha, mimovolním strážením, odrazovou citlivostí a absencí střevních zvuků. Na rentgenovém snímku břicha se může objevit volný vzduch. Jakékoli podezření na perforaci v této situaci by mělo vyvolat okamžitou konzultaci s chirurgem. Smrt obvykle nastane dříve, než dojde k uvolnění vzduchu a perforaci. V jedné studii bylo na rozdíl od většiny ostatní literatury zjištěno, že perforace je vzácná (22).
Rentgenogram břicha může odhalit dilatované tlusté střevo (>7 cm v největším průměru), což odpovídá toxickému megakolon. Pacienti s megakolonem mohou mít přidružený ileus tenkého střeva s dilatovaným tenkým střevem na prostém rentgenovém snímku břicha s hladinou vzdušné tekutiny imitující obstrukci nebo ischemii tenkého střeva. CT bez kontrastu a endoskopie mohou rychle diagnostikovat nebo alespoň silně naznačit fulminantní kolitidu způsobenou C.difficile. CT nálezy zahrnují známky ascitu, zesílení a/nebo dilataci stěny tlustého střeva. Tyto nálezy se mohou ukázat jako užitečné při kategorizaci závažnosti kolitidy.
Agresivnější zásah u pacientů nereagujících na medikamentózní léčbu, včetně rychlé identifikace pacientů nereagujících na medikamentózní léčbu, má zásadní význam pro pozitivní výsledek a u této skupiny pacientů by měl být proveden časný chirurgický zákrok (obr. 1-3).
Je důležité, aby všichni, kdo se podílejí na péči o pacienty v nemocnicích, pečovatelských domech a zařízeních s odbornou péčí, byli poučeni o organismu a jeho epidemiologii, racionálním přístupu k léčbě a péči o pacienty s C. difficile. difficile, významu mytí rukou mezi kontakty s pacienty, používání rukavic při péči o pacienta s průjmem způsobeným C. difficile a vyvarování se zbytečného používání antimikrobiálních látek.
Závěr
V posledních letech se objevily obavy z rostoucího výskytu a závažných komplikací CDAD v severoamerických nemocnicích (22,23). Časopis Canadian Medical Association publikoval v roce 2004 zprávu s podrobnými informacemi o epidemii CDAD, která se týkala několika nemocnic v Montrealu. Jako možná příčina epidemie bylo postulováno zavedení nových hypervirulentních a vysoce přenosných kmenů C. difficile (24). Zhoršující se infrastruktura, nedostatečné postupy kontroly infekcí, rostoucí počet oslabených pacientů, stárnoucí populace a hypervirulentní kmeny byly považovány za pravděpodobné faktory, které přispěly k nedávnému vypuknutí epidemie v Kanadě (25).
Dvě epidemiologická šetření ve Spojených státech a v Kanadě (24,26) nezávisle na sobě zkoumala vzorky C. difficile a zjistila, že za vypuknutí epidemie v Quebecu a zvýšený výskyt CDAD v nemocnicích ve Spojených státech v poslední době je zodpovědná mutovaná verze „divokého“ kmene (22,23). Kliničtí epidemiologové z CDC zkoumali izoláty C. difficile z nemocnic ve Spojených státech, kde nedávno (tj. v letech 2001-2004) propukla CDAD (22,23). Zpráva naznačuje výskyt nového epidemického kmene „BI“ (odlišného od kmene „J“ z let 1989-1992), který může být zodpovědný za nedávný nárůst četnosti a zjevné závažnosti CDAD (26).
CDAD a kolitidu lze ve většině případů léčit podáváním metronidazolu nebo vankomycinu. U některých pacientů se i přes vhodnou a včasnou medikamentózní léčbu vyvine závažná život ohrožující toxicita a je nutný chirurgický zákrok. Uvádí se, že systémové příznaky infekce C. difficile nepocházejí z bakteriemie, perforace tlustého střeva nebo ischemie, ale z toxinem indukovaných zánětlivých mediátorů uvolňovaných z tlustého střeva (27-29). V refrakterních případech závažného onemocnění by měla být použita časná chirurgická intervence. Chirurgická intervence však zdaleka není ideální a nese s sebou velmi vysoké procento komplikací a významné riziko úmrtí (22). Budoucí klinický přístup k léčbě nozokomiální kolitidy způsobené C. difficile může nakonec zahrnovat specifické antitoxinové hyperimunoglobuliny a inhibitory zánětlivé kaskády (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Sekulární trend v nemocničním onemocnění Clostridium difficile ve Spojených státech; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. In: Kardiovaskulární onemocnění: Kardiologická diagnostika a léčba: Klíšťová encefalitida: Antibiotická antibiotika: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. Vyd. 4. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Pathogenesis, epidemiology, and treatment. Gastroenterolog. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historie jeho role jako střevního patogenu a současný stav znalostí o tomto organismu. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosokomiální akvizice Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: S popisem nového patogenního anaeroba Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Léčba průjmu a kolitidy způsobených Clostridium difficile. In: Wolfe MM, ed. Gastrointestinální farmakoterapie. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Rizikové faktory infekce Clostridium difficile. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastrointestinální infekce: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rektální šetrnost u pseudomembranózní kolitidy spojené s antibiotiky: Prospektivní studie. Gastroenterologie. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Deset let prospektivního sledování a léčby onemocnění spojených s Clostridium difficile v Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamid-related toxic megacolon in Clostridium difficile colitis. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Přídavná intrakolonická léčba vankomycinem u těžké kolitidy způsobené Clostridium difficile: série případů a přehled literatury. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenózní metronidazol k léčbě kolitidy způsobené Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Opakované průjmy způsobené Clostridium difficile: charakteristika a rizikové faktory u pacientů zařazených do prospektivní, randomizované, dvojitě zaslepené studie. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile kolitida: stále agresivnější iatrogenní onemocnění? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4. (Vznik epidemického kmene Clostridium difficile ve Spojených státech, 2001-4): Potenciální role faktorů virulence a znaků antimikrobiální rezistence. Infectious Diseases Society of America 42th Annual Meeting. Boston, MA, 30. září – 3. října 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northhoff H. Cytokine response by human monocytes to Clostridium difficile toxin A and toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Increased substance P responses in dorsal root ganglia, intestinal macrophages during Clostridium difficile toxin A enteritis in rats. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimuluje produkci makrofágového zánětlivého proteinu-2 ve střevních epiteliálních buňkách potkanů. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Survival of anti-Clostridium difficile bovine immunoglobulin concentrate in the human gastrointestinal tract. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenous immunoglobulin therapy for severe Clostridium difficile colitis. Gut. 1997;41:366-70.