Abstrakt
Nízkohodnotný ilmenit lze loužit koncentrovanou HCl za atmosférického tlaku a při 80oC. Po filtraci k oddělení nerozpustných látek se roztok obsahující TiO2+ a Fe2+ zahřeje za účelem vysrážení hydroxidu titaničitého a získání HCl. Hydroxid titaničitý se poté kalcinuje na syntetický rutil obsahující 95+ % TiO2, zatímco FeCl2 se podrobí oxihydrolýze nebo fluidizaci za účelem získání HCl a Fe2O3. Tento proces lze přirozeně použít na vysoce kvalitní ilmenit. Obchází proces elektrické pece, který se používá pouze pro vysoce kvalitní ilmenit, a je lepší než proces kyseliny sírové, který je vysoce znečišťující. Produkt tohoto procesu lze použít k přípravě bílého pigmentu i kovového titanu.
Klíčová slova
Loužení HCl, Magpeiův proces, Syntetický rutil, Oxyhydrolýza, Elektrická pec, Chlorace, Proces s kyselinou sírovou
Úvod
Hlavními minerály titanu jsou rutil, TiO2 a ilmenit, FeTiO3 (obr. 1 a 2). Rutil se snadno zpracovává na kovový titan nebo pigment TiO2 metodou chlorace, zatímco zpracování ilmenitu je složitější kvůli vysokému obsahu železa. Vzhledem k tomu, že světové zásoby titanu jsou z 90 % ve formě ilmenitu a pouze z 10 % ve formě rutilu, je zpracování ilmenitu zřejmě důležitou otázkou v metalurgii .

Obr. 1: Muzejní vzorek rutilu, ~ 90 % TiO2

Obr. 2: Muzejní vzorek ilmenitu, FeTiO3 (59).4 % TiO2)
Ložiska ilmenitu mohou být masivní jako v provincii Quebec (obrázek 3) nebo jako černé písky (obrázek 4) spojené s magnetitem, monazitem a dalšími cennými minerály, které se oddělují fyzikálními metodami (obrázek 5). Při první magnetické separaci se k oddělení magnetitu používá slabý magnet, zatímco při druhé magnetické separaci se k oddělení ilmenitu používá magnet o vysoké intenzitě.

Obr. 3: Vzorek masivního ilmenitu z Quebecu

Obr. 4: Černé plážové písky jako v Indii
Rané metody výroby pigmentu
Metoda kyseliny sírové
V roce 1916 zahájily společnost Titanium Pigment Corporation z Niagara Falls ve státě New York a norská společnost Titan Company současně komerční výrobu tohoto nového bílého pigmentu. Poté byly hlavními bílými pigmenty používanými v barvách olovnatá běloba, zinková běloba a litopon. Při této metodě se ilmenit zpracovával s koncentrovanou H2SO4 při 110-120 °C za vzniku síranů železa a titanylu:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Reakce probíhá ve velkých betonových nádržích vyložených kyselinovzdornými cihlami (obrázek 6), zahřívaných přímým vstřikováním vysokotlaké páry nebo v pug mlýně (obrázek 7) . Ztuhlá hmota, která vznikla v reaktoru na konci reakce, byla poté z reaktoru vypuštěna rozpuštěním ve vodě nebo zředěné kyselině. Po odstranění nerozpustného zbytku filtrací byl roztok obsahující 120-130 g/l TiO2 a 250-300 g/l FeSO4 zahuštěn ve vakuu při 10 °C za účelem krystalizace FeSO4-7H2O, který byl poté odstředěn. Oxid titaničitý se pak z roztoku vysráží zředěním a vysrážením, čímž vznikne zředěný H2SO4 určený k likvidaci (obrázky 8 a 9). Největší výrobce pigmentu v brazilském Salvadoru však tuto technologii stále používá, protože odpadní produkty, které jsou odstraňovány přílivem, ukládá do oceánu.

Obrázek 5: Zušlechťování černých písků za účelem získání jejich cenných složek

Obrázek 6: Velké betonové nádrže vyložené kyselinovzdornými cihlami
Obrázek 7: Zušlechťování černých písků za účelem získání jejich cenných složek

: Vyhřívaný pug mlýn

Obrázek 8: Výroba pigmentu TiO2 procesem kyseliny sírové

Obrázek 9: Titanová běloba, ~ 100 % TiO2
Chlorizační metoda
DuPont v USA vyrábí pigment od roku 1950 přímou chlorací ilmenitové rudy, separací produktů frakční destilací a následnou oxidací TiCl4 (obrázek 10):

Obrázek 10: Zjednodušený Du Pontův proces výroby pigmentu z ilmenitu
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Problémem tohoto procesu je získávání chloru z chloridu železitého nebo uvádění na trh velkého množství tohoto vedlejšího produktu.
Separace železa
Vzhledem k problémům se znečištěním spojeným s likvidací zředěné kyseliny sírové a FeSO4 se železo v rudě separuje v rané fázi. Toho se dosahuje dvěma způsoby: elektrickou pecí a hydrometalurgickou cestou.
Postup elektrickou pecí
Metoda elektrické pece byla vyvinuta v 50. letech 20. století . Ruda se smíchala s určitým množstvím antracitu, které stačilo k redukci složky oxidu železitého v rudě, a poté se vložila do elektrické pece o teplotě 1 650 °C, kde se oxid železitý redukoval na kov, zatímco titan se oddělil jako struska (obr. 11). Reakce probíhající během redukce jsou následující:

Obrázek 11: Proces separace železa v elektrické peci
FeTiO3 + C → Fe + CO + TiO2(struska)
Fe2O3 + 3C → 2Fe + 3CO
Tuto metodu používá společnost Rio Tinto QIT ve svém závodě v Sorelu u Montrealu a v Richards Bay v Jižní Africe. Používá se také v Sovětském svazu v Záporoží (Ukrajina) a v Japonsku.
Titanovou strusku tvoří hlavně titaničitan železnato-hořečnatý, (Fe,Mg)Ti4O10, a malé množství křemičitanů; typické rozbory jsou 72-85 % celkového TiO2. Malé množství TiO2 se redukuje na Ti2O3. Redukce oxidů železa není dokončena, takže ve strusce zůstává část oxidu železa, který snižuje její teplotu tání. Teplota tání TiO2 1840 °C a ilmenitu 1435 °C.
Struska má vysoký obsah titanu a nízký obsah železa (obrázek 12), a proto je při výrobě pigmentu TiO2 nebo kovového titanu vhodnější než ilmenit. Struska vyráběná v Quebecu však není vhodná pro chlorování kvůli vysokému obsahu nečistot – přibližně 16,6 % ve srovnání s přibližně 6 % u jiných strusek . Tyto nečistoty nejenže spotřebovávají zbytečné množství chlóru, ale také způsobují problém s likvidací. Kromě toho některé z těchto nečistot, např, vápník a hořčík, budou interferovat se samotným procesem chlorace, který probíhá při 800 °C tím, že vytvoří roztavenou fázi (CaCl2 m.p. 770 °C, MgCl2 m.p. 708 °C).

Obrázek 12: Mletá titanová struska, FeTi4O10 (70-80 % TiO2)
Z těchto důvodů se titanová struska používala pouze pro výrobu pigmentu procesem kyseliny sírové . Struska byla zpracována stejným způsobem jako ilmenit s tou výjimkou, že nebylo nutné oddělit síran železnatý, protože většina železa byla již oddělena redukcí v předchozím kroku (obrázek 13). Proces úpravy strusky kyselinou sírovou však stále trpěl problémem s likvidací odpadní kyseliny, a proto byl v 80. letech 20. století opuštěn a nahrazen novou technologií založenou na zušlechtění strusky na 94,5 % TiO2 vyluhováním většiny nečistot pomocí HCl pod tlakem, aby byla vhodná pro chlorování.

Obrázek 13: Loužení titanové strusky pro výrobu pigmentu TiO2, nyní zastaralé
Hydrometalurgická cesta
Hydrometalurgická cesta byla vyvinuta v 60. letech 20. století a zahrnovala loužení železa z ilmenitu a získávání zbytku bohatého na titan (90-95 % TiO2) známého jako „syntetický rutil“ . V jednom případě, při procesu Altair, byl získán TiO2 ve formě pigmentu. Všechny tyto procesy využívají proces oxyhydrolýzy pro zpracování chloridu železitého za účelem získání HCl pro recyklaci a Fe2O3 jako vedlejšího produktu.
Vysokotlaká metoda
Při této metodě se vysoce kvalitní ilmenit rozkládá v autoklávech pomocí 20% HCl při 120 °C a 200 kPa; železo se rozpustí jako chlorid železitý a zůstane pevná látka obsahující asi 95 % TiO2, která má chemickou analýzu jako rutil, proto se nazývá syntetický rutil (obr. 14):

Obrázek 14: Syntetický rutil
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Touto metodou nelze zpracovávat ilmenit nízké kvality, protože všechny křemičitany a nerozpustné látky by produkt kontaminovaly. Syntetický rutil se pak upravuje chlorem za účelem přípravy TiCl4, z něhož se bez problémů se znečištěním získává TiO2 nebo kovový titan. Tento postup se používá v USA, Anglii, Japonsku, na Tchaj-wanu a v Austrálii. Oxihydrolýzu lze provádět různými způsoby, jak je popsáno níže.
Atmosférický proces
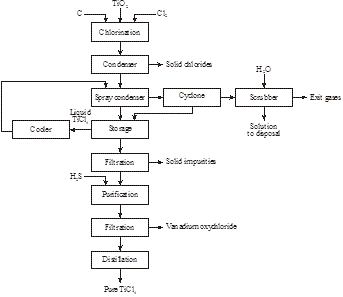
V roce 2014 zjistila společnost Magpie Incorporation v Kanadě, že ilmenit nízké kvality lze rozpustit při 80 °C koncentrovanou HCl za atmosférického tlaku. Po filtraci k odstranění nerozpustných látek se roztok destiluje, aby se získala HCl a hydrolyzoval titanylový ion na TiO2. Po filtraci se zbytek kalcinuje za účelem výroby syntetického rutilu (obrázek 16):

Obr. 15: Výroba syntetického rutilu z ilmenitu

Obr. 16: Výroba syntetického rutilu z ilmenitu

: Výroba 98+ % TiO2 z nekvalitního ilmenitu
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Je zřejmé, že nová technologie loužení za okolního tlaku je lepší než stará technologie tavení v elektrické peci-autoklávu.
Oxyhydrolýza
Roztok chloridu železitého se regeneruje na HCl a Fe2O3 pomocí oxyhydrolýzy:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Jedná se o stejnou technologii, která se používá pro úpravu roztoku okurek. Používají se dvě metody
Oxyhydrolýza ve fluidním loži
V reaktoru s fluidním ložem se roztok chloridu železitého zavádí na velké lože horkého oxidu železitého, kde ohřev zajišťují horké fluidní spaliny (obrázek 17). Jak spalovací plyn proudí přes dobře promíchané lože oxidu, rychle dosáhne tepelné rovnováhy s ložem. Roztok se přivádí na vrstvu oxidů. Kapalný přívod smáčí vnější vrstvu horkých částic oxidu a rychle se odpařuje a vytváří cibulovitou vrstvu nového pevného oxidu na povrchu stávajícího oxidu, čímž vznikají husté homogenní částice.

Obrázek 17: Fluidní reaktor pro oxyhydrolýzu chloridu železitého
Oxyhydrolýza ve sprejovém pražiči
V tomto typu oxyhydrolýzního pražiče je roztok chloridu železitého rozprašován do prázdné válcové nádoby, zatímco potřebnou energii dodává vzestupný proud horkých plynů generovaných ve spodních hořácích (obrázek 18). Rozprašovací pražiče mají velký průměr, aby se udržela nízká rychlost plynu. Pokud je rychlost plynu vysoká, dochází k eluci příliš velkého množství částic s odpadním plynem a kvalita produktu a účinnost pražiče klesá. Odpadní plyn a oxidy opouštějí pražič protiproudně při teplotě přibližně 400 °C až 500 °C. Doba setrvání rozprašovaných částic ve vysokoteplotní reakční zóně je velmi krátká, proto by se rozprašováním měly vytvářet velmi malé kapičky kapaliny, které lze rychle zahřát. Rychlé zahřátí vede k vytvoření pevné oxidové krusty na povrchu každé kapky. Jak se většina kapky zahřívá, obsah vody se odpařuje a prolamuje oxidovou slupku. Proto se rozprašovaný pražený oxid skládá z velmi jemných „nadýchaných“ dutých kuliček.

Obrázek 18: Regenerace HCl z roztoku chloridu železitého oxihydrolyzou ve sprejovém pražiči
Výroba titanu
Metalický titan se vyrábí chlorací rutilu, syntetického rutilu nebo titanové strusky a poté redukcí v metalotermickém reaktoru TiCl4 hořčíkem na titan (obrázky 19 a 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
Obrázek 19: Výroba TiCl4 z rutilu, syntetického rutilu nebo titanové strusky

Obrázek 20: Výroba TiCl4 z rutilu, syntetického rutilu nebo titanové strusky

: Výroba titanu z TiCl4
TiCl4 + Mg → Ti + MgCl2
Chlorid hořečnatý se poté elektrolyzuje, aby se získal zpět hořčík a chlor pro recyklaci. Obrázek 21 ukazuje metalotermický reaktor vyjmutý z pece po redukci, ze kterého se získá titanová houba (obrázek 22).

Obrázek 21: Metallothermic reactor being removed from furnace

Obrázek 22: Titanium sponge (top) and MgCl2 (bottom) removed from the reactor
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) „Titanium“, pp. 1129-1179 in Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Kanada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Kanada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reprinted in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. Zpracování titanových rud pro výrobu pigmentů a kovů. Arab Min J 11: 74-84
.