Úvod
Zjistilo se, že odhadovaná glomerulární filtrace (eGFR) nižší než 60 ml/min/1,73 m2 je spojena se zvýšeným rizikem úmrtí ze všech příčin a kardiovaskulárních příhod u obecné i vysoce rizikové populace.1,2 U osob se sníženou eGFR je vyšší pravděpodobnost úmrtí z kardiovaskulárních příčin než na selhání ledvin.1,3 Prevalence eGFR
mL/min/1,73 m2 se postupně zvyšuje s věkem a u osob starších 80 let dosahuje až 50 %.4,5 Vzhledem ke stárnutí populace na celém světě se očekává, že funkce ledvin bude mít v příštích letech stále větší vliv na kardiovaskulární onemocnění.
Některé studie uvádějí, že souvislost mezi eGFR a úmrtností se s věkem oslabuje.1,6 Navíc se stále diskutuje o klinickém významu středně snížené funkce ledvin (eGFR 45-59 ml/min/1,73 m2) u osob starších 65 let.7,8 Bylo zjištěno, že úmrtnost je významně vyšší při eGFR 6,9 ale pouze při eGFR 4,10-12. Výsledky pro kardiovaskulární příhody (CVE) jsou ještě rozporuplnější.12,13 Tento scénář vedl některé autory k návrhu věkově kalibrované prahové hodnoty, tj. eGFR 8, což je zajímavé vzhledem k vysoké prevalenci mírnějšího snížení u starších osob.
Některé rozpory ve výsledcích mohou být způsobeny rozdíly v metodách používaných k měření kreatininu, rovnicích pro odhad eGFR nebo charakteristikami studovaných populací. Studie v oblastech s nízkým výskytem ischemické choroby srdeční (ICHS) navíc nezahrnovaly osoby starší 74 let14,15 nebo neposkytovaly podrobné informace napříč věkovými skupinami.16,17
Cílem této studie bylo zhodnotit věkově specifický vztah mezi eGFR a úmrtností ze všech příčin (ACM) a výskytem kardiovaskulárních onemocnění u osob starších 60 let v populaci jižní Evropy s nízkým výskytem ICHS.18
MetodyDesign a studovaná populace
Provedli jsme retrospektivní kohortovou studii zahrnující všechny osoby narozené v roce 1950 nebo dříve, které byly registrovány v jednom ze 40 center primární zdravotní péče s centralizovanou laboratoří tvořících součást služby primární péče Costa de Ponent v severovýchodním Španělsku (sloužící populaci 873 549 osob) a jejichž kreatinin byl měřen v období od 1. ledna 2010 do 31. prosince 2011. Vyloučili jsme pacienty s onemocněním ledvin ve stadiu 5 (eGFR
Zdroje dat
Výchozí klinické údaje byly získány z elektronických zdravotních záznamů primární péče; u výchozího kardiovaskulárního onemocnění jsme zohlednili také předchozí hospitalizaci z důvodu kardiovaskulárního onemocnění nebo revaskularizační zákroky od roku 2005. Indexové datum jsme definovali jako datum, kdy bylo provedeno první měření kreatininu během období zařazení; výchozí stav byl definován podle charakteristik zaznamenaných mezi 1 rokem před a 1 měsícem po indexovém datu.
Hodnocení renálních funkcí
Hladiny kreatininu v séru byly měřeny jedinou laboratoří pomocí standardizované Jaffeho kompenzované kinetické metody sledovatelné na referenční metodu izotopového ředění hmotnostní spektrofotometrie. Hodnota eGFR byla odhadnuta pomocí kreatininové rovnice CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration)19 bez korekce na rasu, která nebyla k dispozici.
Klasifikovali jsme eGFR do klinických kategorií podle KDIGO 2012 Clinical Practice Guideline: 15 až 29, 30 až 44, 45 až 59, 60 až 89 a 90 až 119.20
Kovariáty
Sbírali jsme údaje o věku, pohlaví, kuřáckém statusu (nikdy nekuřák, aktivní kuřák a bývalý kuřák), hypercholesterolemii (sérový cholesterol >6.4 mmol/l nebo léčba statiny), kardiovaskulárních rizikových faktorech (hypertenze, diabetes mellitus) a předchozí diagnóze kardiovaskulárního onemocnění (KVO, cerebrovaskulární onemocnění, onemocnění periferních tepen a srdeční selhání).
Údaje o datu úmrtí byly získány z nemocničních nebo administrativních registrů bez specifikace příčiny; všechny koncové body pro KVO byly získány ze záznamů o hospitalizaci, které zahrnují údaje ze všech nemocnic v Katalánsku, severovýchodním regionu Španělska. Primárním koncovým ukazatelem byl ACM a sekundárním koncovým ukazatelem byl jakýkoli CVE, včetně KVO (akutní infarkt myokardu , nestabilní angina pectoris nebo angina pectoris ) a cévní mozkové příhody (nehemoragická cévní mozková příhoda nebo tranzitorní ischemická ataka ). Odděleně jsme analyzovali tvrdé CVE (akutní infarkt myokardu a nehemoragickou cévní mozkovou příhodu), CHD a cévní mozkovou příhodu.
Účastníci byli sledováni od 1 měsíce po indexovém datu do doby, než zemřeli, přešli do jiného zdravotnického systému nebo do ukončení studie (31. prosince 2013).
Protokol studie byl schválen místní etickou komisí pro klinický výzkum (IDIAP Jordi Gol P11/43). Od účastníků jsme nepožadovali informovaný souhlas, protože to etická komise výzkumu nepovažovala za nutné.
Statistická analýza
Všechny proměnné byly analyzovány podle věkových skupin (60 až 74 let a ≥ 75 let). Tyto věkové skupiny jsme použili, protože se shodují s většinou současných systémů pro odhad rizika kardiovaskulárních onemocnění.18 Spojité proměnné jsou popsány jako průměr ± směrodatná odchylka nebo medián (nenormální rozdělení) a kategoriální proměnné jsou popsány jako absolutní a relativní četnosti. K vyhodnocení rozdílů mezi skupinami normálně, resp. nenormálně rozdělených spojitých proměnných jsme použili Studentův t test a Kruskallův-Wallisův test. Pro kategoriální proměnné jsme použili chí-kvadrát test a testovali jsme také lineární trend mezi kategoriemi eGFR. Incidentní příhody byly vypočteny pomocí Kaplanových-Meierových křivek po 3 letech.
V každé skupině jsme použili Coxovy modely proporcionálních rizik k odhadu poměrů rizik (HR) pro vztah mezi eGFR jako spojitou proměnnou a rizikem ACM. Linearitu účinku eGFR jsme ověřili pomocí lineárních splajnů se 4 stupni volnosti v Coxových modelech. Vzhledem k malému počtu jedinců s eGFR ≥ 120 (n = 14) a snížené přesnosti odhadů nad tímto bodem byli tito jedinci z dalších analýz vyloučeni. Coxovy modely proporcionálních rizik jsme použili také k testování souvislosti mezi kategorickou eGFR, definovanou podle klinických hraničních bodů KDIGO 2012, a ACM. U všech CVE byla analýza provedena pomocí techniky přežití s konkurenčními riziky (Fine-Grayova regrese proporcionálních subdistribučních rizik), aby se zohlednil možný vliv incidentální mortality na odhady.
Předpoklad proporcionality rizika v čase byl posouzen graficky (Schoenfeldova rezidua) pro expoziční proměnnou (eGFR).
Coxovy modely proporcionálních rizik pro spojitou i kategoriální eGFR byly upraveny pro věk, pohlaví, kuřácký status, hypercholesterolemii, diabetes mellitus, hypertenzi a předchozí kardiovaskulární onemocnění (ischemická choroba srdeční, cerebrovaskulární, periferní onemocnění tepen nebo srdeční selhání). Modely byly dále upraveny podle léčby s dostupnými údaji (statiny a léky systému renin-angiotenzin).
Přestože byl CKD-EPI vytvořen na vzorku s širokým věkovým rozpětím (18-97 let), bylo přítomno jen málo jedinců ve věku 80 let a více. Proto jsme provedli analýzu citlivosti s použitím rovnice Berlin Initiative Study-1,21 která byla speciálně vyvinuta na komunitním vzorku jedinců ve věku ≥ 70 let.
Finální modely byly validovány pomocí Hosmer-Lemeshowova testu a plochy pod křivkou operačních charakteristik přijímače. U obou metod bylo zohledněno cenzorování a konkurenční události.
Všechny statistické analýzy byly provedeny pomocí R verze 3.2.3 (R: jazyk a prostředí pro statistické výpočty R Foundation for Statistical Computing, Vídeň, Rakousko), s 2strannými testy a P
VÝSLEDKY
Z 138 040 způsobilých osob (73.1 % celé populace ve věku ≥ 60 let v této oblasti) bylo 6797 vyloučeno, protože byli v domácí péči, 509 mělo onemocnění ledvin ve stadiu 5 a 501 bylo sledováno pro Obrázek 1 doplňkového materiálu). Mezi zařazenými a vyloučenými osobami nebyly žádné klinicky významné rozdíly z hlediska věku (P = .374) nebo pohlaví (56,1 % a 55,1 % žen; P
Medián věku celého vzorku byl 70 let , 56,1 % účastníků byly ženy. Medián eGFR byl 82,42 ; 13,5 % účastníků mělo eGFR Tabulka 1), prevalence kategorie eGFR P
P ml/min/1,73 m2.
Základní charakteristiky studované populace, Stratifikované podle věku a kategorie odhadované glomerulární filtrace
| VŠECHNY | 90-119 ml | 60-89 ml | 45-59 ml | 30-44 ml | 15-29 mL | P celkově | P trend | |
|---|---|---|---|---|---|---|---|---|
| 60- až 74let.staří | ||||||||
| Pacienti | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||
| Věk, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | ||
| Pohlaví, ženy | 47 549 (53,8) | 19 927 (57,7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | ||
| Kouření | ||||||||
| Nikdy nekouřil | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | ||
| Aktivní kuřák | 10 458 (11,8) | 4714 (13,6) | 5189 (10,7) | 422 (9,91) | 107 (10,9) | 26 (12.2) | ||
| Bývalý kuřák | 23 446 (26,5) | 8307 (24,0) | 13 452 (27,8) | 1263 (29,7) | 347 (35,2) | 77 (36.2) | ||
| Hypercholesterolemie | 44 990 (50,9) | 16 710 (48,4) | 24 994 (51,7) | 2529 (59,4) | 613 (62,2) | 144 (67.6) | ||
| Diabetes mellitus | 19 998 (22,6) | 7950 (23,0) | 10 226 (21,1) | 1296 (30,4) | 431 (43.7) | 95 (44,6) | ||
| Hypertenze | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86,9) | ||
| Koronární onemocnění srdce | 6200 (7,02) | 1825 (5,28) | 3629 (7,51) | 527 (12.4) | 173 (17,5) | 46 (21,6) | ||
| Cerebrovaskulární onemocnění | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12.2) | 36 (16.9) | ||
| PODLOŽKA | 1686 (1.91) | 510 (1.48) | 906 (1.87) | 171 (4.02) | 76 (7.71) | 23 (10.8) | ||
| Srdeční selhání | 1891 (2.14) | 453 (1.31) | 1011 (2.09) | 259 (6.08) | 132 (13,4) | 36 (16,9) | ||
| Předchozí CVD* | 12 012 (13,6) | 3628 (10.5) | 6854 (14,2) | 1080 (25,4) | 361 (36,6) | 89 (41,8) | ||
| Statiny | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | ||
| RASD | 40 619 (46,0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | ||
| ≥ 75letý-staří | ||||||||
| Pacienti | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||
| Věk, y | 79.0 | 77,0 | 79,0 | 81,0 | 82,0 | 83,0 | ||
| Pohlaví, ženy | 25 482 (60.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | ||
| Kouření | ||||||||
| Nikdy nekouří | 30 251 (72.2) | 1202 (68,0) | 20 086 (71,8) | 5836 (72,9) | 2616 (75,8) | 511 (74,7) | ||
| Aktivní kuřák | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3,51) | ||
| Bývalý kuřák | 9760 (23,3) | 440 (24.9) | 6607 (23,6) | 1844 (23,0) | 720 (20,9) | 149 (21,8) | ||
| Hypercholesterolemie | 20 705 (49,4) | 798 (45.1) | 13 621 (48,7) | 4115 (51,4) | 1823 (52,9) | 348 (50,9) | ||
| Diabetes mellitus | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36,0) | ||
| Hypertenze | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | ||
| Koronární onemocnění srdce | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | ||
| Cerebrovaskulární onemocnění | 4567 (10,9) | 171 (9,67) | 2781 (9,94) | 1034 (12,9) | 486 (14.1) | 95 (13.9) | ||
| PODLOŽKA | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | ||
| Srdeční selhání | 3275 (7,82) | 90 (5,09) | 1648 (5,89) | 822 (10,3) | 551 (16,0) | 164 (24.0) | ||
| Předchozí CVD* | 11 691 (27,9) | 389 (22,0) | 6900 (24,7) | 2657 (33,2) | 1419 (41.1) | 326 (47,7) | ||
| Statiny | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | ||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72,8) | ||
CVD, kardiovaskulární onemocnění; PAD, onemocnění periferních tepen; RASD, léky systému renin-angiotenzin.
Pokud není uvedeno jinak, jsou údaje vyjádřeny jako počet (%) nebo medián .
Včetně cerebrovaskulárních onemocnění, PAD a srdečního selhání.
Pro testování asociací s eGFR v Coxových modelech jsme v obou skupinách definovali eGFR = 80 jako referenční hodnotu (použitou také v metaanalýze CKD-Prognostic Consortium)6 , protože to byl medián eGFR v populaci, a 60 až 90 jako klinickou kategorii, protože ta zahrnovala nejvyšší počet osob a byla klinicky významná.
Medián sledování byl 38,2 měsíce . Celkem bylo zaznamenáno 6474 úmrtí, 1573 CHD příhod a 2236 cerebrovaskulárních příhod. Všechny příhody byly významně častější ve starší věkové skupině (P Tabulka 2), s výjimkou cévních mozkových příhod, které byly o něco méně časté u jedinců s eGFR 15 až 29.
Příhody ve studované populaci, stratifikované podle věku a odhadované glomerulární filtrace podle Kaplan-Meierových odhadů po 3 letech. Log Rank test (P celkově), Lineární trend Waldův test (P Trend)
| Všechny | 90-119 ml | 60-89 ml | 45-59 ml | 30-44 ml | 15-29 ml | P celkově | P trend | |
|---|---|---|---|---|---|---|---|---|
| 60- až 74letých | ||||||||
| Pacienti | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||
| Všechny-úmrtnost z příčin, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | ||
| Jakákoli CVE, % | 2,09 | 1,51 | 2,26 | 3,78 | 5,60 | 7.94 | ||
| Tvrdé CVE, % | 1,46 | 1,06 | 1,56 | 2,76 | 4,05 | 4.78 | ||
| CHD, % | 0,96 | 0,74 | 1,02 | 1,38 | 2,83 | 4.80 | ||
| Zdvih, % | 1,16 | 0,79 | 1,27 | 2,44 | 2,88 | 3.17 | ||
| ≥ 75letý-staří | ||||||||
| Pacienti | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||
| Úmrtnost ze všech příčin, % | 9.88 | 10.5 | 7.89 | 11.7 | 17,8 | 28,5 | ||
| Jakákoli CVE, % | 4,34 | 3,31 | 3,90 | 4,80 | 6.77 | 8,35 | ||
| Tvrdé CVE, % | 3,24 | 2,22 | 2,90 | 3,75 | 4,90 | 5.93 | ||
| CHD, % | 1,69 | 1,30 | 1,48 | 1.77 | 2,86 | 5,41 | ||
| Zdvih, % | 2.74 | 2,13 | 2,49 | 3,17 | 4,00 | 3,34 | ||
CHD, ischemická choroba srdeční; CVE, kardiovaskulární příhoda.
Oba modely, pro ACM a jakoukoli CVE, vykazovaly proporcionalitu rizika v čase pro expoziční proměnnou (eGFR; údaje nejsou uvedeny).
Spojitost mezi eGFR a rizikem ACM měla v obou věkových skupinách tvar písmene U, ale ve starší skupině byla více oslabena (obrázek 1). Naproti tomu HR pro jakoukoli CVE vykazovaly lineární rozložení s postupným nárůstem rizika od vyšší eGFR k nižší; tento vzorec byl podobný v obou věkových skupinách a také pro ostatní kardiovaskulární endpointy (obrázek 2 v doplňkovém materiálu). U všech výsledků se HR u ≥ 75letých staly signifikantními pod eGFR = 60 (obrázek 1), mezi eGFR = 55 a eGFR = 60 pro ACM a při eGFR ∼ 50 pro jakoukoli CVE.
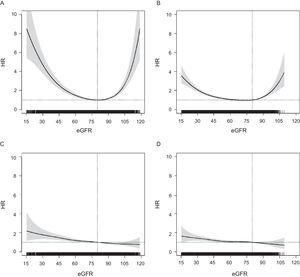
Souvislost mezi eGFR (spojitá proměnná) a rizikem ACM u osob ve věku P hodnota
Z hlediska klinických kategorií eGFR se riziko ACM a jakékoli CVE postupně zvyšovalo v kategoriích eGFR pod 60 až 89 v obou věkových skupinách (obr. 2). Nárůst rizika ACM byl mnohem vyšší a strmější u osob ve věku 60 až 74 let než u osob ve věku ≥ 75 let, zatímco riziko jakékoli CVE bylo v obou věkových skupinách podobnější a v kategorii eGFR = 45 až 59 u osob ve věku ≥ 75 let bylo hraničně významné. Další korekce na léčbu statiny a léky systému renin-angiotenzin hodnoty HR nezměnila (údaje nejsou uvedeny). Zjistili jsme také, že jedinci s eGFR 90 až 119 měli vyšší riziko úmrtí v nejstarší skupině a významně nižší riziko jakékoli KVO pouze v nejmladší skupině. Výsledky modelů pro CHD, cévní mozkovou příhodu a těžkou CVE byly podobné jako pro jakoukoli CVE (obrázek 3 v doplňkovém materiálu). Analýza citlivosti s použitím rovnice Berlin Initiative Study-1 pro výpočet eGFR neprokázala žádné rozdíly (obrázek 4 v doplňkovém materiálu).

Souvislost mezi kategoriemi eGFR a rizikem úmrtí ze všech příčin a jakékoliv kardiovaskulární příhody, hodnoceno pomocí upravených Coxových modelů proporcionálních rizik s uvažováním úmrtí jako konkurenční události pro kardiovaskulární příhody (celková hodnota P
Konečné modely vykazovaly dobrou kalibraci a diskriminaci (obrázek 5 doplňkového materiálu a tabulka doplňkového materiálu).
DISKUSE
V populaci osob ve věku ≥ 60 let v zemi s nízkým kardiovaskulárním rizikem se riziko ACM a jakékoli CVE postupně zvyšovalo s klesající eGFR, a to jak u osob ve věku 60 až 74 let, tak u osob ve věku ≥ 75 let, nezávisle na ostatních rizikových faktorech a kardiovaskulárním onemocnění. HR ve starší věkové skupině však začaly být významné při nižší eGFR (pod eGFR = 60) a v kategorii eGFR = 45 až 59 byly hraničně významné pro jakoukoli CVE. Zvýšení rizika úmrtí související s eGFR bylo vyšší u osob ve věku 60 až 74 let než u osob ve věku ≥ 75 let, ale pro riziko CVE bylo podobné. Navíc souvislost mezi eGFR a úmrtností měla tvar písmene U se zvýšenou úmrtností v kategorii 90 až 119 a byla vyšší u ≥ 75letých.
V této studované populaci věkové kategorie definovaly 2 dobře diferencované skupiny, v nichž počet jedinců s eGFR
Podle očekávání byl výskyt kardiovaskulárních následků nižší, než se uvádí u starších jedinců v nemediteránních zemích,22 ale byl vyšší než u mladších jedinců v naší oblasti.23 Incidentální cerebrovaskulární příhody byly častější než koronární příhody, což bylo rovněž popsáno ve studiích starších osob.22
V souladu s předchozími zprávami,1,6,14,22,24 jsme pozorovali vztah ve tvaru U mezi eGFR jako spojitou proměnnou a ACM v obou věkových skupinách. Pozoruhodné je, že nadměrné riziko ACM pozorované v kategorii eGFR = 90 až 119 bylo vyšší u starších pacientů. Toto zvýšení rizika by mohlo odrážet zmatení způsobené úbytkem svalové hmoty sekundárně v důsledku jiných onemocnění vedoucích k úmrtí; to je známé omezení odhadových vzorců založených na kreatininu.19 Naproti tomu jsme zjistili, že riziko nové KVO se zvyšuje od vyšší eGFR k nižší. To je v souladu s některými předchozími zprávami,13,23,25 ačkoli jiné zprávy uvádějí méně výrazný vztah ve tvaru písmene U pro kardiovaskulární úmrtnost6,12 a kardiovaskulární onemocnění.15 Spolehlivějším ukazatelem prognostického vlivu eGFR na kardiovaskulární riziko by tedy mohly být incidenty CVE, které se zdají být méně ovlivněny omezeními odhadových vzorců založených na kreatininu.
O klinickém významu mírně snížené eGFR u starších osob existují rozporuplné důkazy. Jen málo studií použilo v současnosti doporučovanou rovnici pro hodnocení rizika spojeného s eGFR a pro porovnání výsledků v různých věkových kategoriích. Pokud je nám známo, naše studie je první, která tak učinila u starší populace žijící v regionu s nízkým výskytem KVO.
Pro ACM metaanalýza CKD-PC6 uvádí významný upravený HR při eGFR 9 učinila podobný závěr u osob ve věku 60 až 69, 70 až 79 a ≥ 80 let. Naproti tomu u osmdesátníků zjistila studie Cardiovascular Health Study12 signifikantní HR pouze při eGFR ≤ 43. V jižní Evropě bylo zjištěno, že úmrtnost se zvyšuje u osob starších 65 let s eGFR 16 a u osob ve věku 60 až 74 let s eGFR 15. U osob ve věku 35 až 74 let bez kardiovaskulárního onemocnění bylo zjištěno, že eGFR je hraničně významným prediktorem ACM14 , a to s významně vyšším rizikem při eGFR = 45-59. U osob starších 65 let s eGFR 16 bylo zjištěno, že eGFR je hraničně významným prediktorem ACM.
Pro kardiovaskulární mortalitu byly HR ve skupinách ve věku 65 až 74 let a ≥ 75 let signifikantní pro eGFR 6, zatímco studie Cardiovascular Health Study, která používala rovnice založené na kreatininu, podobnou souvislost u osmdesátníků nezjistila.12 Pokud jde o riziko incidence CVE, studie PREVEND zjistila souvislost s eGFR u osob mladších 60 let, ale ne u osob ve věku ≥ 60 let.13 V jižní Evropě bylo zaznamenáno zvýšené riziko kardiovaskulární mortality při eGFR 16 a incidence kardiovaskulárních onemocnění (marginálně významné) při eGFR 15 a eGFR 23
V naší studii se HR pro ACM a jakékoli CVE trvale zvyšovaly s klesající eGFR pod kategorii 60 až 89, a to v obou skupinách ve věku 60 až 74 a ≥ 75 let. Stejně jako v předchozích zprávách byly hodnoty HR a gradient rizika nižší v nejstarší skupině,6,9 a při analýze kontinuální eGFR se HR staly signifikantními při eGFR 6
Většina současných mezinárodních doporučení považuje všechny osoby s eGFR 18,20,26. V této studii mělo 20 % účastníků ve věku ≥ 75 let eGFR = 45 až 59, z nichž 74 % mělo eGFR ≥ 50. V této studii se HR pohybovaly v rozmezí 1,5 až 2,5 %. Považování všech starších osob v kategorii 45 až 59 za osoby s vyšším rizikem by tedy vystavilo mnoho osob s „žádným významným přidaným rizikem“ agresivnějším cílům a léčbě kardiovaskulárních rizikových faktorů. Navíc 11% zvýšení relativního rizika příhod KVO u osob ve věku 60 až 74 let nemusí být dostatečné k tomu, aby se kategorie eGFR = 45 až 59 považovala za ekvivalent rizika KVO v zemích s nízkým výskytem KVO.
Silné stránky a omezení
Významnou silnou stránkou naší studie je velmi velký počet zařazených osob a skutečnost, že byly vybrány z reprezentativního populačního vzorku, který odráží skutečnou situaci pacientů vedených v primární péči. Téměř všichni jedinci ve věku >60 let (93 %) byli navštěvováni katalánským systémem primární zdravotní péče a u vysokého procenta z nich bylo provedeno měření kreatininu, pravděpodobně proto, že je součástí základní preventivní zdravotní prohlídky a rutinního sledování dalších převažujících chronických onemocnění v této populaci. Kromě toho byly testy měření kreatininu kalibrovány na referenční metodu pomocí izotopové diluční hmotnostní spektrofotometrie, jak je doporučeno, a byly prováděny v centralizované laboratoři, což dále snižuje variabilitu.
Výsledky této studie je třeba interpretovat také s ohledem na různá omezení. Za prvé, hodnoty a kategorie eGFR byly přiřazeny na základě jediného měření, což je v epidemiologických studiích prognózy obvyklé. Vzhledem k regresnímu zkreslení (regression dilution bias) může dojít k podhodnocení skutečné asociace mezi eGFR a sledovanými výsledky. Bylo však prokázáno, že nízké hodnoty eGFR z ambulantních laboratorních databází jsou u starších osob relativně stabilní.27 Za druhé jsme nezohlednili vliv některých faktorů, které mohou modifikovat funkci ledvin, jako jsou novotvary, nefrotoxické léky, infekce nebo klinicky interkurentní příhody. Domníváme se, že tyto vlivy jsou minimalizovány velkým počtem zařazených pacientů. Zatřetí, eGFR jsme odhadovali na základě měření sérového kreatininu podle vzorce CKD-EPI, přičemž jsme akceptovali omezení odhadových vzorců založených na kreatininu, které mají větší vliv při vyšší eGFR.19 Nekorektovali jsme na rasu, ačkoli v naší populaci převažuje kavkazské etnikum, zejména v tomto věkovém rozmezí. Navíc, i když je diagnostické a prognostické využití CKD-EPI u starších osob předmětem diskusí a byly vyvinuty nové vzorce, CKD-EPI je v současné době doporučeným přístupem20 a je široce používán v primární péči. Analýza citlivosti s eGFR vypočtenou podle rovnice Berlin Initiative Study-1 navíc přinesla podobné výsledky. Začtvrté jsme nemohli vyhodnotit vliv albuminu v moči, protože tyto údaje nebyly k dispozici; ačkoli jsou eGFR i albumin doporučovány pro hodnocení CKD, ukázaly se jejich nezávislé prognostické důsledky1 a zde prezentované výsledky přidávají cenné informace o vlivu eGFR na kardiovaskulární riziko a mezní hodnoty u starších osob. Za páté, údaje byly získány z elektronických zdravotních záznamů a nelze vyloučit chybné zjištění. Ukázalo se, že údaje o kardiovaskulárních onemocněních v primární zdravotní péči jsou kvalitnější než u jiných onemocnění a jsou vhodné pro epidemiologické studie v naší populaci.28,29 Smrtelné KVO mimo nemocnici nebyly zahrnuty. Konkrétně jsme mohli nedostatečně zachytit cévní mozkové příhody u pacientů s pokročilým onemocněním ledvin, kteří nebyli hospitalizováni, a ty byly pravděpodobně závažnější a s větší komorbiditou vedoucí k úmrtí. Vzorec příhod cévní mozkové příhody u osob s eGFR mezi 45 a 80 byl podobný jako u ostatních CVE; nedomníváme se, že to znehodnocuje naše výsledky, protože jsme se zaměřili na mírné CKD. Za šesté, modely byly upraveny pro kardiovaskulární rizikové faktory a onemocnění, stejně jako pro léčbu statiny a léky renin-angiotenzinového systému, nikoli však pro další komorbidity, léky nebo socioekonomické faktory, které mohou mít vliv na výskyt CVE. V neposlední řadě jsme neměli přístup k údajům o příčině úmrtí. Úmrtnost ze všech příčin zahrnuje několik etiologií, které nesouvisejí s funkcí ledvin, ale s jinými onemocněními souvisejícími s věkem, diabetem mellitem nebo srdečním selháním, jako jsou infekce nebo pády. I když jsme některé z těchto komorbidit upravili, nemůžeme vyloučit přítomnost dalších zdrojů zmatení, jako je například křehkost.30
ZÁVĚRY
Závěrem lze říci, že u osob ve věku ≥ 60 let žijících v zemi s nízkým výskytem KVO jsme pozorovali nárůst rizika ACM a jakékoli KVO s klesající eGFR v obou skupinách ve věku 60 až 74 let a ≥ 75 let. HR se však staly signifikantními při eGFR
FINANCOVÁNÍ
Tento projekt byl podpořen výzkumným grantem Institutu zdraví Carlose III, Ministerstva hospodářství a konkurenceschopnosti (Španělsko), uděleným v rámci výzvy Akční strategie zdraví v roce 2011, v rámci Národního výzkumného programu orientovaného na společenské výzvy. Tento program je součástí Národního plánu technického, vědeckého a inovačního výzkumu 2008-2011, spolufinancovaného z prostředků Evropské unie ERDF (Evropský fond pro regionální rozvoj) (PI11/02220). Ministerstvo hospodářství a konkurenceschopnosti prostřednictvím Institutu zdraví Carlose III (Red RedIAPP RD12/0007) a prostředky ERDF Generalitat de Catalunya prostřednictvím AGAUR (A for Management of Universities and Research Grants) (2014 SGR 1225) (2014 SGR 902). M. Grau byl financován grantem Miguela Serveta (Carlos III Institute of Health, Ministerstvo hospodářství a konkurenceschopnosti, Španělsko) (PI12/03287).
KONFLIKTY ZÁJMŮ
L. Pascual-Benito obdržel honorář za přednášku od společnosti Alter. A. Martínez-Castelao obdržel honoráře za konzultace/placené poradní rady od společnosti Boëhringer-Ingelheim a honoráře za přednášky od a Boëhringer-Ingelheim.
- –
U jedinců s eGFR
mL/min/1,73 m2 existuje zvýšené kardiovaskulární riziko. Prevalence snížené eGFR se postupně zvyšuje s věkem a u osob starších 80 let dosahuje až 50 %. Stále se diskutuje o klinickém významu častějších mírnějších snížení (eGFR 45 až 59 ml/min/1,73 m2) u starších osob. Studie v oblastech s nízkým výskytem KVO navíc nezahrnovaly osoby starší 74 let nebo neposkytovaly podrobné informace napříč věkovými skupinami. co přináší tato studie?
- –
V populaci jedinců ve věku ≥ 60 let žijících v zemi s nízkým kardiovaskulárním rizikem se riziko ACM a jakéhokoli KVO postupně zvyšovalo s klesající eGFR, a to jak u osob ve věku 60 až 74 let, tak u osob ve věku ≥ 75 let, nezávisle na ostatních rizikových faktorech a kardiovaskulárních onemocněních. HR ve starší věkové skupině však začaly být významné až při eGFR nižší než 60 let. Zvýšení rizika úmrtí související s eGFR bylo vyšší ve skupině ve věku 60 až 74 let než ve skupině ve věku ≥ 75 let, ale bylo podobné pro riziko KVO.
.