Glykogen a škrob, megadaltonové polymery glukózy, jsou hlavní zásobárnou snadno dostupné energie a sloučenin uhlíku ve většině živých organismů. U savců je příjem a využití glukózy pod přísnou kontrolou. Defekty v normální manipulaci s glukózou jsou spojeny s řadou lidských patologických stavů, jako jsou nemoci z ukládání glykogenu a diabetes, u nichž přetrvávající hyperglykémie souvisí s časným nástupem a zvýšenou závažností onemocnění. Metabolické cesty katalytické přeměny glykogenu zahrnují několik enzymů, z nichž glykogen syntáza katalyzuje prodlužování a glykogen fosforyláza rozklad a(1,4)-vázaných glukanů. V posledních 30 letech bylo biochemickými a strukturními studiemi glykogenfosforylas a maltodextrinfosforylas získáno velké množství informací o odbourávání glykogenu . Tyto studie ukázaly, že regulace glykogenfosforyláz je fascinujícím příkladem kovalentního a nekovalentního alosterismu, skvěle koordinovaného hormonální kontrolou. Informace popisující terciární a kvartérní strukturu jsou nyní k dispozici prakticky pro všechny enzymy přímo zapojené do zpracování glykogenu. Překvapivě velmi málo strukturních informací bylo podáno o glykogen syntáze, která katalyzuje prodlužování glykogenu postupným přidáváním ![]() -(1,4)-vázaných glukózových zbytků na neredukující konec polymeru za použití ADP/UDP-glukózy jako donoru glukózy.
-(1,4)-vázaných glukózových zbytků na neredukující konec polymeru za použití ADP/UDP-glukózy jako donoru glukózy.
Nyní jsme určili krystalovou strukturu glykogen syntázy z Agrobacterium tumefaciens (AtGS) s rozlišením 2,3 Å, a to jak v její apo-formě, tak v přítomnosti ADP. Data byla získána na ID29 a struktura byla vyřešena pomocí techniky SAD (anomální difrakce s jednou vlnovou délkou) s následnými postupy modifikace hustoty. Protein se nachází jako dimer v asymetrické jednotce, přičemž každý monomer se skládá ze dvou „Rossmann-fold“ domén (obr. 81), které jsou uspořádány stejně jako ve strukturách glykogenfosforylázy a dalších glykosyltransferáz nadrodiny GT-B . Hluboká štěrbina mezi oběma doménami obsahuje katalytické centrum. Hlavní rozdíl mezi savčími (rodina GT3) a bakteriálními (GT5) glykogen syntázami spočívá v tom, že pouze enzymy GT3 jsou přísně regulovány fosforylací a nekovalentní alosterickou modulací. Podle zarovnání vícenásobných sekvencí založených na struktuře mezi sekvencemi GT3, GT5 a glykogenfosforyláz se regulační fosforylační místa v lidské glykogen syntáze pravděpodobně nacházejí v 25-residovém N-konci a 120-residovém C-konci insertu, mimo neregulované jádro GT-B bakteriálních glykogen syntáz. Mutagenetické studie již dříve identifikovaly dva konzervované shluky Arg v enzymech GT3 jako součást alosterického místa (míst) pro fosfo-Ser/Thr zbytky i nekovalentní aktivátor Glc-6P. Ekvivalentní zbytky v AtGS se nacházejí na jednom konci C-koncové domény, daleko od reakčního centra, což naznačuje regulační účinek na velkou vzdálenost.
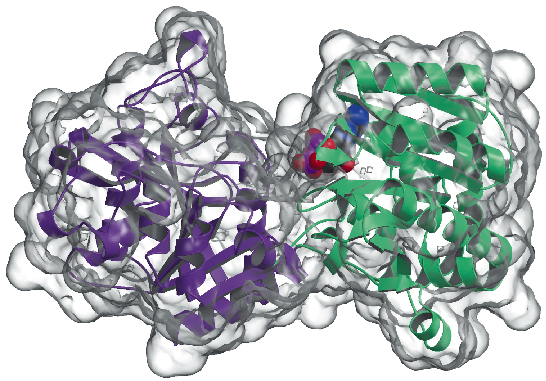
Obr. 81: Struktura glykogen syntázy: povrch přístupný rozpouštědlu je znázorněn průhledně. Všimněte si vázané molekuly ADP (nakreslené jako kuličky VDW).
Struktura AtGS vykazuje nápadnou topologickou podobnost se strukturami jádra glykogen/maltodextrin fosforylas (rodina GT35) (obr. 82a), i když sekvenční identity jsou nízké (~14 %). Struktura každé Rossmannovy skládané domény AtGS je výrazně bližší struktuře fosforyláz z rodiny GT35 než kterékoli jiné glykosyltransferázy závislé na nukleotidech. Glykogen syntázy a fosforylázy také vykazují silnou podobnost ve svých katalytických místech (obr. 82b). Ribóza ADP a pyridoxalová skupina leží v ekvivalentních polohách, stejně jako distální fosfát ADP u AtGS a anorganický fosfát substrátu u fosforyláz. Kromě toho jsou zachovány i kritické aminokyseliny, které interagují s glukózovými částmi substrátů. Katalytický mechanismus používaný glykogen syntázami a fosforylázami je tedy pravděpodobně podobný, přičemž jemné změny ve struktuře vysvětlují jejich celkově odlišné funkční vlastnosti.
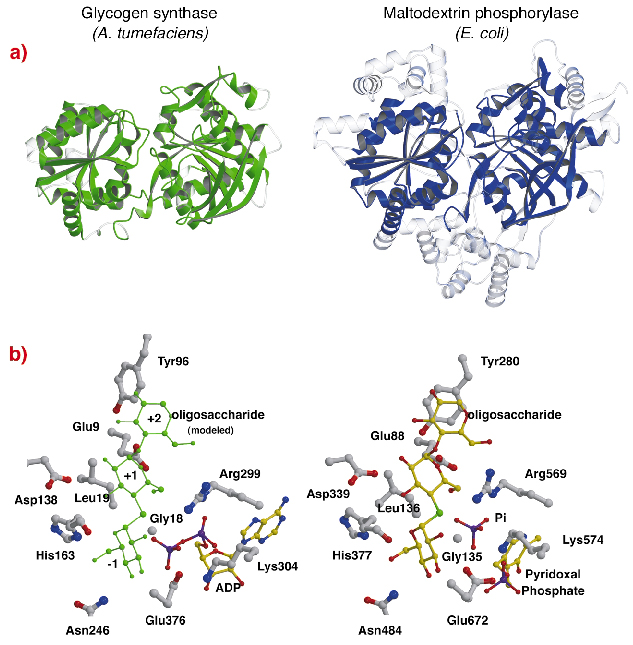
Obr. 82: Homologie s glykogen fosforylázou: (a) po strukturním zarovnání, superponované ekvivalentní zbytky mezi AtGS a maltodextrinfosforylázou E. coli MalP, jsou znázorněny v pevném materiálu (nezarovnané oblasti, průhledně); (b) katalytická místa AtGS a MalP.
Původní domněnka, že syntéza glykogenu představuje pouze zvrat jeho degradační fosforylázy, se ukázala jako chybná, když Leloir ukázal, že za prodlužování polysacharidů jsou odpovědné UDP-Glc a glykogen syntáza, nikoli Glc-1-P a glykogen fosforyláza . Naše práce však nyní ukazuje, že opačné nezávislé reakce při interkonverzi glukózy a glykogenu jsou katalyzovány blízce příbuznými homologickými enzymy.
.