Izocitrátdehydrogenáza katalyzuje chemické reakce:
Izocitrát + NAD+ ⇌ {\displaystyle \rightleftharpoons }

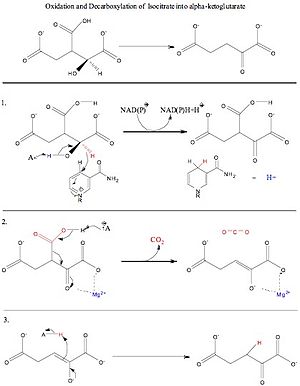
2-oxoglutarát + CO2 + NADH + H+ Isocitrát + NADP+ ⇌ {\displaystyle \rightleftharpoons }

2-oxoglutarát + CO2 + NADPH + H+
Celková volná energie pro tuto reakci je -8,4 kJ/mol.
KrokyEdit
V cyklu kyseliny citronové podléhá isocitrát, který vzniká isomerací citrátu, oxidaci i dekarboxylaci. Pomocí enzymu isocitrát dehydrogenázy (IDH) je isocitrát udržován v jeho aktivním místě okolními aminokyselinami argininem, tyrosinem, asparaginem, serinem, treoninem a kyselinou asparagovou. První rámeček ukazuje celkovou reakci isocitrát dehydrogenázy. Reaktanty nezbytné pro fungování tohoto enzymového mechanismu jsou isocitrát, NAD+/NADP+ a Mn2+ nebo Mg2+. Produkty reakce jsou alfa-ketoglutarát, oxid uhličitý a NADH + H+/NADPH + H+. Molekuly vody pomáhají deprotonovat oxygeny (O3) isocitrátu.
Druhým políčkem je krok 1, což je oxidace alfa-C (C#2). Oxidace je prvním krokem, kterým isocitrát prochází. Při tomto procesu se deprotonuje alkoholová skupina z alfa-uhlíku (C#2) a elektrony proudí na alfa-C za vzniku ketonové skupiny a odstranění hydridu z C#2 za použití NAD+/NADP+ jako kofaktoru přijímajícího elektrony. Oxidace alfa-C umožňuje pozici, ve které budou elektrony (v dalším kroku) přicházet dolů z karboxylové skupiny a vytlačovat elektrony (tvořící dvojnou vazbu kyslíku) zpět nahoru na kyslík nebo uchopit blízký proton z blízké aminokyseliny lysinu.
Třetím políčkem je krok 2, což je dekarboxylace oxalosukcinátu. V tomto kroku je kyslík karboxylové skupiny deprotonován blízkou aminokyselinou tyrosinem a tyto elektrony proudí dolů na uhlík 2. V tomto kroku je kyslík karboxylové skupiny deprotonován blízkou aminokyselinou tyrosinem. Oxid uhličitý opouští beta uhlík isocitrátu jako odcházející skupina, přičemž elektrony proudí na ketonový kyslík z alfa-C, čímž se na kyslík alfa-C umístí záporný náboj a mezi uhlíky 2 a 3 vznikne nenasycená dvojná vazba alfa-beta. Osamělý pár na kyslíku alfa-C vyzvedne proton z blízké aminokyseliny lysinu.
Čtvrtým políčkem je krok 3, což je nasycení nenasycené dvojné vazby alfa-beta mezi uhlíky 2 a 3. V tomto kroku se vytvoří dvojná vazba alfa-beta. V tomto kroku reakce Lysin deprotonuje kyslík z alfa uhlíku a osamělý pár elektronů na kyslíku alfa uhlíku sestupuje dolů, čímž reformuje ketonovou dvojnou vazbu a vytlačuje osamělý pár (tvořící dvojnou vazbu mezi alfa a beta uhlíkem), přičemž vyzvedne proton z blízké aminokyseliny Tyrosin. Výsledkem této reakce je tvorba alfa-ketoglutarátu, NADH + H+/NADPH + H+ a CO2.
Podrobný mechanismusEdit
Dva aspartátové zbytky aminokyseliny (vlevo dole) interagují se dvěma sousedními molekulami vody (w6 a w8) v Mn2+ isocitrátovém komplexu prasečí IDH a deprotonují alkohol z atomu alfa uhlíku. Na tomto obrázku také dochází k oxidaci alfa-C, kdy NAD+ přijímá hydrid, jehož výsledkem je oxalosukcinát. Spolu se stereochemickou změnou sp3 na sp2 kolem alfa-C vzniká z alkoholové skupiny ketonová skupina. Vznik této ketonové dvojné vazby umožňuje rezonanci, protože elektrony přicházející dolů z odcházející karboxylátové skupiny se pohybují směrem ke ketonu.
Dekarboxylace oxalosukcinátu (dole uprostřed) je klíčovým krokem při vzniku alfa-ketoglutarátu. Při této reakci osamělý pár na sousedním hydroxylu tyrosinu abstrahuje proton z karboxylové skupiny. Tato karboxylová skupina se v molekule isocitrátu označuje také jako beta podjednotka. Deprotonizace karboxylové skupiny způsobí, že se osamělý pár elektronů přesune dolů, čímž vznikne oxid uhličitý a oddělí se od oxalosukcinátu. Elektrony se dále pohybují směrem k alfa uhlíku a tlačí elektrony dvojné vazby (tvořící keton) nahoru, aby abstrahovaly proton ze sousedního lysinového zbytku. Mezi uhlíkem 2 a 3 vzniká nenasycená dvojná vazba alfa-beta. Jak vidíte na obrázku, zelený iont představuje buď Mg2+, nebo Mn2+, což je kofaktor nezbytný pro průběh této reakce. Kovový iont vytváří malý komplex prostřednictvím iontových interakcí s atomy kyslíku na čtvrtém a pátém uhlíku (známý také jako podjednotka gama isocitrátu).
Po odštěpení oxidu uhličitého z oxalosukcinátu v dekarboxylačním kroku (vpravo dole) se enol tautomerizuje na keto z . Tvorba ketonové dvojné vazby je zahájena deprotonací tohoto kyslíku z alfa uhlíku (C#2) stejným lysinem, který kyslík protonoval na prvním místě. Osamělý pár elektronů se přesune dolů a odkopne osamělé páry, které tvořily dvojnou vazbu. Tento osamělý pár elektronů odebere proton z tyrosinu, který v dekarboxylačním kroku deprotonoval karboxylovou skupinu. Důvod, proč můžeme říci, že zbytky Lys a Tyr budou stejné jako v předchozím kroku, je ten, že pomáhají držet molekulu isocitrátu v aktivním místě enzymu. Tyto dva zbytky budou schopny vytvářet vodíkové vazby tam a zpět, pokud budou dostatečně blízko substrátu.
 Oxidoreduktázový krok, ve kterém se NAD+ používá k přijetí hydridu.
|
 Dekarboxylace oxalosukcinátu.
|
 Nasycení alfa-beta nenasycené dvojné vazby.
|
Enzym isocitrátdehydrogenáza, jak je uvedeno výše, produkuje alfa-ketoglutarát, oxid uhličitý a NADH + H+/NADPH + H+. V průběhu reakce dochází ke třem změnám. Oxidace uhlíku 2, dekarboxylace (ztráta oxidu uhličitého) uhlíku 3 a vznik ketonové skupiny se stereochemickou změnou ze sp3 na sp2.
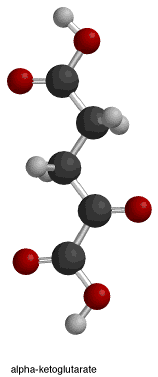 |
 Mitochondriální NADP+-dependentní izocitrát dehydrogenáza prasat komplexovaná s Mn2+ a izocitrátem. Pohled na povrch kapsy aktivního místa, kde je isocitrát vázán polárními aminokyselinami.
|
 Mitochondriální NADP+-dependentní izocitrátdehydrogenáza prasat komplexovaná s Mn2+ a izocitrátem.
|
 Enzymový komplex prasat; aktivní místo isocitrát a přilehlé A.A.
|
Aktivní místoEdit
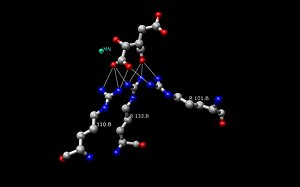
Struktura enzymu isocitrátdehydrogenázy (IDH) v Escherichia coli byla první objasněnou a pochopenou strukturou. Od té doby většina výzkumníků používá strukturu IDH Escherichia coli k porovnávání s jinými enzymy isocitrát dehydrogenázy. O tomto bakteriálním enzymu existuje mnoho podrobných poznatků a bylo zjištěno, že většina isocitrát dehydrogenáz má podobnou strukturu, a tedy i funkci. Tato podobnost struktury a funkce dává důvod domnívat se, že struktury jsou konzervovány stejně jako aminokyseliny. Proto by měla být konzervována i aktivní místa u většiny prokaryotických enzymů isocitrát dehydrogenázy, což je pozorováno v mnoha studiích provedených na prokaryotických enzymech. Naproti tomu u eukaryotických enzymů isocitrát dehydrogenázy nebyla dosud plně objevena.Každý dimer IDH má dvě aktivní místa. Každé aktivní místo váže molekulu NAD+/NADP+ a dvojmocný kovový ion (Mg2+,Mn2+). Obecně má každé aktivní místo konzervovanou sekvenci aminokyselin pro každé konkrétní vazebné místo. U Desulfotalea psychrophila (DpIDH) a prasete (PcIDH) jsou v aktivním místě vázány tři substráty.
- Izocitrát se váže v aktivním místě na konzervovanou sekvenci přibližně osmi aminokyselin prostřednictvím vodíkových vazeb. Mezi tyto kyseliny patří (mohou se lišit v počtu zbytků, ale mají podobné vlastnosti) tyrosin, serin, asparagin, arginin, arginin, arginin, tyrosin a lysin. Jejich pozice na páteři se liší, ale všechny jsou v blízkém rozmezí (tj. Arg131 DpIDH a Arg133 PcIDH, Tyr138 DpIDH a Tyr140 PcIDH).
- Kovový ion (Mg2+, Mn2+) se váže na tři konzervované aminokyseliny prostřednictvím vodíkových vazeb. Tyto aminokyseliny zahrnují tři aspartátové zbytky.
- NAD+ a NADP+ se vážou v aktivním místě ve čtyřech oblastech s podobnými vlastnostmi mezi enzymy IDH. Tyto oblasti se liší, ale jsou přibližně , , , a . Oblasti se opět liší, ale blízkost oblastí je konzervativní.