Pro pochopení fyzikálních vlastností, hybridizace a tvaru molekuly je důležité znát její Lewisovu strukturu. Dnes si projdeme Lewisovu strukturu I3- nebo také známého jako triodidový ion, protože má záporný náboj. V této molekule jsou tři molekuly jódu, a proto je název sloučeniny triodid. Pro pochopení Lewisovy struktury molekuly bychom měli znát valenční elektrony molekuly jódu.
Lewisova struktura
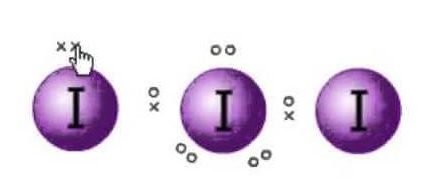
Lewisova struktura je znázornění elektronů molekul. Existují osamělé páry a valenční elektrony, které pomáhají určit hybridizaci a tvar molekuly. Protože se jedná o molekuly jódu, bude jedna molekula jódu uprostřed. Také jód je v sedmé skupině periodické tabulky a má sedm valenčních elektronů na vnějším orbitu.

Máme zde tři molekuly jódu, které spolu s jedním elektronem navíc dávají záporný náboj. Celkový počet valenčních elektronů je tedy : 7×3 + 1= 22.
V této molekule je celkem 22 valenčních elektronů. Nyní existuje osmičkové pravidlo, kterým se řídí každý atom. Podle tohoto pravidla by měl mít každý atom na svém vnějším orbitu osm elektronů. Pokud je ve vnějším obalu centrálního atomu 8 elektronů, je třeba, aby oktet doplnily další dva atomy. Protože všechny atomy budou potřebovat osm elektronů ve své vnější slupce, aby doplnily oktet, jeden elektron centrálního atomu jódu si vezmou oba sousední atomy jódu. To znamená, že 8-1-1=6.
Jako elektrony budou obsazeny oběma atomy.
Takže nyní bude valenčních elektronů na centrálním atomu jódu šest. Těchto šest elektronů bude tvořit osamělé páry elektronů, které se nevážou. Protože nyní tvoří dvojice elektronů, budou na centrálním atomu tři osamělé páry a dva vazebné páry elektronů, protože každý atom jódu má vazbu s centrálním atomem, kde sdílí po jednom elektronu, celkem jsou na centrálním atomu 3 osamělé páry a 2 vazebné páry.
Hybridizace
Pro poznání hybridizace jakékoliv molekuly existuje jednoduchý vzorec, který lze použít. Tento vzorec se používá pro zjištění hybridizačního čísla, které pomáhá poznat hybridizaci molekuly.
Hybridní číslo a hybridizace, kterou určuje, se uvádí takto:
- 2: sp hybridizace
- 3: sp2 hybridizace
- 4: sp3 hybridizace
- 5: hybridizace
Vzorec pro zjištění čísla je,
Hybridizační číslo: Počet valenčních elektronů + monovalentní + (záporný náboj) – (kladný náboj)/2
Valenčních elektronů atomů jódu je 7, protože ve vnějším obalu je sedm elektronů. Počet monovalentních atomů je dva, protože dva ze tří jodů jsou monovalentní. Když se nyní dostaneme k náboji iontu I3-, má záporný náboj, takže hodnota tohoto záporného náboje bude 1.
Nyní dosaďte všechny hodnoty podle vzorce,
7+1+2/2
=10/2
=5
Hybridizační číslo je tedy 5, což znamená, že jeho hybridizace je sp3d.
Další způsob, jak zjistit hybridizaci dané molekuly, je pomocí osamělých párů a valenčních elektronů. Počet osamělých párů v této molekule je 3 a počet atomů sdílejících valenční elektrony je 2.
Tedy 3+2=5, což také určuje hybridizaci sp3d.
Tvar iontu I3-

Tvar molekuly I3- je lineární. Jsou v ní tři atomy jódu, z nichž jeden má navíc záporný náboj. Díky tomuto jednomu elektronu navíc existují 3 osamělé elektronové páry a 2 vazebné páry, což činí jeho sterické číslo 5. Protože na centrálním atomu jodidu jsou tři osamělé páry, snaží se tyto páry navzájem co nejvíce odpuzovat. Aby tedy byly ve větší vzdálenosti, zaujímají tyto páry rovníkové polohy a zbylé dva atomy jódu jsou od sebe vzdáleny 180 stupňů. Celkový tvar iontu I3- je tedy lineární.
Polarita
Takže tady je ta záludná část ohledně tohoto iontu, zaprvé jako to, že ho jako náboj na něm můžeme nazývat jako polyatomický ion, místo abychom ho nazývali molekulou. Ionty jsou náboje, které vidíme na molekulách. Protože I3- má jeden elektron, má tento iont celkově záporný náboj. Molekuly mají polaritu, protože mají oba náboje, tedy částečně kladně nabitý konec a částečně záporně nabitý konec. Na molekulách existuje dipólový moment v závislosti na oddělení nábojů na molekule. Pokud je vzdálenost mezi oběma náboji větší, dipólový moment bude také větší.
Ale když mluvíme o iontu I3-, je to záporně nabitý ion. I když nakreslíme jeho Lewisovu strukturu, nevidíme v ní žádný dipólový moment ani polární vazby, protože samotný celkový náboj iontu je záporný. Není tedy ani polární, ani nepolární. Pokud však máte iont popsat, můžete použít frázi “ jako polární molekula“, protože I3- je rozpustný ve vodě.
Na závěr, abychom shrnuli celý tento článek, I3- je polyatomický iont, který má 22 valenčních elektronů, 3 osamělé páry, 2 vazebné páry a sp3d hybridizaci. Má lineární tvar a nemá polaritu
.