Chloridy jsou nejhojnějším aniontem v extracelulární tekutině (ECF). Hyperchlorémie je definována jako zvýšení koncentrace chloridů v plazmatické vodě. Hyperchlorémie a relativní nadbytek chloridů v těle jsou spojovány s rozvojem sníženého průtoku krve ledvinami,1,2 zvýšeným intersticiálním edémem včetně ledvin a gastrointestinálního systému,3 nadměrnou morbiditou a mortalitou u kriticky nemocných pacientů4,5 a sníženým přežitím a zotavením u pacientů s akutním poškozením ledvin.6 Stejně jako koncentrace sodíku a dalších chemických látek v kompartmentu ECF je i koncentrace chloridů regulována. Orgánem, který je zodpovědný za udržování rovnováhy chloridů v těle, jsou ledviny. Tento článek podává přehled o manipulaci s chloridy ledvinami a o klinických situacích, při kterých může dojít k hyperchlorémii.
Renální manipulace s chloridy
Hladinu chloridů v plazmě regulují ledviny. Ledviny volně filtrují chloridy přes bazální membrány glomerulů. Množství chloridu, které se vyloučí do moči, je určeno množstvím chloridu filtrovaného glomeruly a řadou transportních procesů, které probíhají podél nefronu. Za normálních okolností se více než 60 % filtrovaného chloridu vstřebá podél proximálního tubulu. V časném proximálním tubulu se sodík vstřebává s úměrným množstvím vody, takže koncentrace sodíku se nemění. Naproti tomu hydrogenuhličitany a další nechloridové anionty se rychle vstřebávají se sodíkem a odstraňují se z filtrátu7 (obr. 1A). Jak se sodík a nechloridové anionty vstřebávají v časných segmentech proximálního tubulu (S1 a S2), zvyšuje se koncentrace chloridů v lumen proximálního tubulu. V době, kdy tubulární tekutina dosáhne posledního segmentu proximálního tubulu (S3), je koncentrace chloridu vysoká vzhledem k jeho plazmatické koncentraci, což umožňuje pasivní absorpci chloridu po jeho koncentračním gradientu (obr. 1B). Transepiteliální permeabilita pro chlorid je vyšší než permeabilita pro bikarbonát, takže navzdory peritubulárnímu gradientu bikarbonátu do lumen je transport chloridu opouštějícího lumen vyšší než bikarbonátu vstupujícího do tubulární tekutiny.

(A) V časném proximálním tubulu dochází k izotonické absorpci sodíku s organickými rozpuštěnými látkami, bikarbonátem, fosfátem spolu s vodou, což má za následek stoupající koncentraci chloridů. (B) Vysoká koncentrace chloridů v lumen rovněž podporuje transcelulární a paracelulární transport. Mezibuněčné spoje v pozdějším proximálním tubulu se stávají propustnějšími pro chloridy, což usnadňuje paracelulární transport. I když koncentrace bikarbonátu v lumen klesá, výměna Na+-H+ nadále hraje roli v reabsorpci NaCl. K transcelulární absorpci chloridu sodného může docházet prostřednictvím spojení Na+-H+ výměny s chlorido-organickou výměnou aniontů (mravenčan, šťavelan). Organická kyselina (kyselina mravenčí nebo šťavelová) je recyklována do buněk.
V časné části proximálního tubulu dochází k absorpci chloridů také prostřednictvím apikálních chlorid-aniontových (mravenčanových, šťavelanových, bazických) výměníků a k jejich výstupu z buňky prostřednictvím transportérů bazolaterální membrány8 (obr. 1B). Při hyperchloremické metabolické acidóze způsobené zatížením HCl- nebo chloridem amonným je reabsorpce chloridů v proximálním tubulu snížena, částečně kvůli snížení počtu organických aniontových přenašečů, které usnadňují transport chloridu sodného9 , a také kvůli snížení lumen-peritubulárního gradientu pro chloridy.
Důležitým místem pro reabsorpci chloridů je silné vzestupné raménko Henleovy kličky (TALH).10 V tomto místě dochází k současnému transportu sodíku, draslíku a chloridů prostřednictvím ko-transportéru sodíku, draslíku a chloridů (NKCC2) (obr. 2). Chloridy vstupují do buňky TALH a opouštějí její bazolaterální stranu elektrogenním chloridovým kanálem nebo prostřednictvím elektroneutrálního draselného chloridového ko-transportéru. Pohyb chloridu bazolaterálním chloridovým kanálem (CLC-NKB) přispívá ke vzniku transepiteliálního kladného (lumen) k zápornému (bazolaterálnímu) potenciálovému gradientu. Intracelulární kladný potenciál, který by vznikl pohybem chloridu ven z buňky, je vyrovnáván bazolaterální elektrogenní Na+-K+ ATPázou, která transportuje sodík ven z buňky výměnou za draslík do buňky v poměru 3-2. Draslíkové kanály ROMK na apikální buněčné membráně TALH přispívají k lumen pozitivnímu (intracelulárnímu negativnímu) potenciálu prostřednictvím vodivého pohybu draslíkových iontů z buňky do lumen. Celkový efekt je takový, že chloridy, sodík a draslík vstupují do buňky prostřednictvím NKCC2 a z větší části chloridy opouštějí buňku prostřednictvím bazolaterálního chloridového kanálu ClC-NKB, sodík opouští buňku prostřednictvím Na+-K+ ATPázy a draslík se recykluje zpět do lumen prostřednictvím kanálu ROMK nebo opouští buňku bazolaterálně prostřednictvím ko-transportéru KCl. Těsné propojení mezi transportem sodíku a chloridů v TALH podtrhuje jedna z odrůd Bartterova syndromu, u níž defekty bazolaterálních chloridových kanálů narušují reabsorpci chloridu sodného a napodobují renální defekt pozorovaný u abnormálních proteinů NKCC2. Ačkoli jiné transportéry na peritubulární straně buňky TAL, jako je ko-transportér KCl, transportují chloridy způsobem nezávislým na sodíku, většina chloridů, které se vstřebávají v TALH, je spojena s reabsorpcí sodíku. Proto faktory, které zvyšují reabsorpci sodíku v tomto segmentu, zvýší také reabsorpci chloridů.
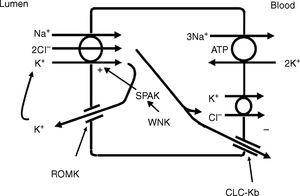
Tlusté vzestupné raménko Henleovy kličky absorbuje chloridy prostřednictvím apikálního Na+-K+-2Cl- kotransportéru (NKCC2) a chloridy opouštějí buňku prostřednictvím bazolaterálního chloridového kanálu a K+-Cl- kotransportu. Recyklace K+ do lumen a bazolaterální vodivý odchod Cl- přes CLC-Kb přispívají k pozitivně-negativnímu lumen-bazolaterálnímu transepiteliálnímu gradientu. Intracelulární chloridy mohou regulovat transport NKCC2 prostřednictvím kinázy WNK vnímající chloridy (WNK), která může aktivovat kinázu bohatou na prolin/alanin STE20/SPS1 (SPAK) a NKCC2, když je intracelulární Cl- nízký. Na druhou stranu, když se v buňce hromadí chloridy v důsledku defektů v bazolaterální výstupní cestě chloridového kanálu, je transport NKCC2 blokován. Když je NKCC2 stimulován, například antidiuretickým hormonem, vstup chloridů se zvýší, ale zároveň se zvýší bazolaterální Cl-vodivost.
V distálním stočeném tubulu jsou sodík a chloridy transportovány z lumen do buňky pomocí sodíko-chloridového ko-transportéru (NCC)11 (obr. 3). Hnací síla pro pohyb chloridu z lumen do buňky pochází z gradientu sodíku mezi lumen a buňkou, který je vytvářen bazolaterální Na+-K+ ATPázou, která pumpuje sodík z buňky, čímž udržuje nízké intracelulární koncentrace sodíku. K další regulaci NCC a NKCC může docházet prostřednictvím WNK kináz, které mohou sloužit jako chloridové senzory12 a mohou regulovat tyto transportéry změnou transportu nebo jejich fosforylačního stavu.13 V pozdějších částech distálního stočeného tubulu může jako hnací síla pasivní reabsorpce chloridů sloužit také negativní lumenový potenciál generovaný pohybem sodíku přes apikální epiteliální sodíkový kanál (ENaC). Segmenty distálního stočeného tubulu tedy vykazují přímé spojení transportu sodíku a chloridů prostřednictvím NCC a nepřímé spojení transportu prostřednictvím pasivního pohybu po elektrochemickém gradientu.
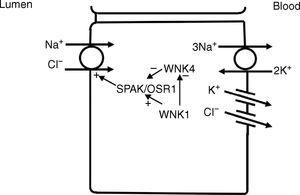
V distálním stočeném tubulu se sodík a chloridy v lumen dostávají do buňky prostřednictvím kotransportéru Na+-Cl- (NCC). Transport prostřednictvím NCC je poháněn nízkým intracelulárním obsahem sodíku, který většinou vytváří bazolaterální Na+-K+ ATPáza. Kináza WNK1 může sloužit jako chloridový senzor, který blokuje inhibici NCC kinázou WNK4.
Sběrný kanálek hraje důležitou roli při určování obsahu chloridů v konečné moči. Reabsorpce chloridů v této části nefronu pomáhá uchovávat chloridy v reakci na nízký příjem chloridů a může přispívat k hypertenzním účinkům diety s vysokým obsahem chloridů sodíku. Většina sodíku, který se reabsorbuje ve sběrném kanálku, probíhá v hlavních buňkách prostřednictvím aldosteronem regulovaných apikálních epiteliálních sodíkových kanálů. K reabsorpci chloridů ve sběrném kanálku může docházet prostřednictvím paracelulární absorpce chloridů, která je poháněna lumenálním negativním transepiteliálním potenciálem generovaným tokem sodíku z lumen do buněk prostřednictvím ENaC (obr. 4A). V interkalárních buňkách typu B a non-A může být navíc chlorid transportován prostřednictvím pendrinu, chlorid-bikarbonátového výměníku, přičemž chlorid se pohybuje z lumen do buňky, zatímco bikarbonát se vylučuje do lumen (obr. 4B). Vztah mezi různými procesy transportu sodíku a chloridů v této části nefronu byl ilustrován v nedávné práci Valleta a kolegů.14 Autoři provedli řadu fyziologických manévrů, aby zjistili jejich vliv na hladinu ENaC a pendrinu v ledvině. Dlouhodobá zátěž NaCl významně snížila hladinu proteinu pendrinu, zatímco došlo k poklesu „aktivní“ podjednotky ENaC-γ a ke zvýšení hladiny podjednotky β. Byla pozorována disociace mezi transportem sodíku a chloridů, avšak při inhibici ko-transportéru sodíku a chloridů hydrochlorothiazidem hladiny pendrinu klesly, ale hladiny ENaC se zvýšily. Restrikce NaCl zvýšila expresi pendrinu.15 Zvýšená luminální koncentrace bikarbonátu, která by vznikla pendrinem zprostředkovanou sekrecí bikarbonátu, ovlivňuje reabsorpci sodíku zvýšením aktivity downstream ENaC.16 Transport chloridu sodného interkalárními buňkami může být také zvýšen přítomností apikálního chlorid-bikarbonátového výměníku (NDCBE, Slc4A8) citlivého na thiazid, který transportuje 1 sodný a 2 bikarbonátové ionty z lumen do buňky výměnou za 1 chloridový ion, který buňku opouští. Pokud je transport NDCBE spojen s chlorid-bikarbonátovou výměnou zprostředkovanou pendrinem, mohly by tyto dva transportéry působící společně vést k čisté reabsorpci chloridu sodného z lumen, protože hydrogenuhličitan se recykluje do buňky a z buňky, zatímco sodík a chlorid do buňky vstupují17 (obr. 4B). Faktory, které mění poměr množství nebo aktivity těchto dvou aniontových výměníků, mohou určovat čistý dopad na sekreci hydrogenuhličitanu a reabsorpci chloridů. Dalším transportérem, který se může podílet na vylučování nadměrného množství chloridů v organismu, je transportér Slc26A9, který může působit jako chloridový kanál v dřeňových částech sběrného kanálku.18 Může modifikovat dopad chloridové zátěže zvýšením sekrece chloridů za podmínek jejich nadbytku. Knokaut tohoto genu vede k predispozici k hypertenzi. U myší s nedostatkem tohoto proteinu se při vystavení vysoké zátěži chloridy sodnými vyvine hypertenze.18 Ačkoli se zdá, že transportér Slc26a9 hraje důležitou roli při zvládání velké zátěže chloridy sodnými, regulace aktivity nativního transportéru v reakci na různou zátěž chloridy sodnými zůstává neznámá.

(A) Chloridy mohou být ve sběrném kanálku vylučovány nebo reabsorbovány. Část absorpce chloridů je poháněna negativním potenciálem lumen a paracelulárním pohybem. (B) K transcelulární reabsorpci chloridu může docházet také prostřednictvím spojení apikálního chlorid-bikarbonátového výměníku Pendrin s chlorid-2-bikarbonátovým výměníkem SLCA48 závislým na sodíku (NDCBE). Dva cykly Pendrinu by vedly ke vstupu 2 chloridů do buňky výměnou za 2 bikarbonáty, zatímco NDCBE by transportoval 1 sodík a 2 bikarbonáty výměnou za 1 chlorid ven. Čistým výsledkem by byl transport 1 sodíku a 1 chloridu do buňky. Rozdíly v aktivitách apikálního pendrinu a NDCBE by mohly určit, zda převažuje sekrece nebo absorpce Cl-.
Koncentrace chloridů a hyperchlorémie
Hladina chloridů v séru se obecně měří jako koncentrace chloridů v objemu séra. Biologicky aktivní koncentrace chloridu je koncentrace volného chloridu v plazmatické vodě. Chloridy se nejčastěji měří pomocí chloridostříbrné elektrody buď v přímém, nebo zředěném vzorku séra.19 Automatizované metody, které se vyskytují v mnoha laboratořích, zahrnují zředění vzorku séra činidlem tak, že se předpokládá, že objem vzorku má normální obsah vody, a odhady se provádějí na základě předpokladu normálního ředicího faktoru. Pokud je obsah pevných složek v séru velmi vysoký, což se může vyskytnout u hypertriglyceridémie a mnohočetného myelomu, může dojít k pseudohypochloremii. Pseudohyperchlorémie se může vyskytnout také při intoxikaci bromidy nebo jodidy. Interakce bromidu nebo jodidu s chloridostříbrnou elektrodou vytváří větší změnu napětí než chlorid, což vyvolává dojem nadměrného množství chloridů v krvi.20,21
Příčiny skutečné hyperchlorémieHyperchlorémie ze ztráty vody
Hyperchlorémie může být důsledkem řady mechanismů (tabulka 1). Ztráta vody převyšující ztrátu chloridů může zvýšit koncentraci chloridů.22 Při dehydrataci je reakcí ledvin šetření vodou a snížení výdeje moči. Vzhledem k tomu, že při těžším stupni dehydratace může být přítomna i složka deplece objemu, dochází ke konzervaci chloridů i sodíku prostřednictvím zvýšené reabsorpce chloridů a dalších solutů v proximálních tubulech a sníženého přísunu chloridů a sodíku do distálnějších segmentů nefronu. Zvýšená proximální tubulární reabsorpce tubulární tekutiny a jejího obsahu nemusí nutně změnit koncentraci chloridů, protože absorpce tekutiny probíhá izotonicky. Léčba deprivace vody spočívá v rozumném podávání vody bez elektrolytů, která sníží koncentraci sodíku i chloridů.
Příčiny hyperchlorémie.
Pseudohyperchlorémie
Vysoké množství pevných látek v séru (lipidů nebo proteinů) při testech zahrnujících ředění vzorku.
Intoxikace bromidy nebo jodidy
Podávání nadměrného množství chloridů
Podávání velkého objemu 0.9% (normální) roztok chloridu sodného
Podání hypertonického fyziologického roztoku
Topení ve slané vodě
Čisté ztráty vody
Horečka
Pocení
Nedostatečné množství vody. příjmu (špatná žízeň nebo přístup k vodě)
Diabetes insipidus
Ztráta vody při nadměrném množství elektrolytů
Některé formy průjmu
Osmotická diuréza
Některé případy post-obstrukční diurézy
Spojené s metabolickou acidózou
Některé formy průjmu
Renální tubulární acidóza
Inhibitory karboanhydrázy
Ureterální diverze (např.g., ileální měchýř)
Podávání chloridu amonného
Podávání argininu nebo hydrochloridu lysinu
Některé případy chronického onemocnění ledvin
Organická acidóza, při které se rychle vylučuje kyselý aniont (např, předávkování toluenem)
Respirační alkalóza
Hyperchlorémie v důsledku nadměrné expozice chloridům
Hyperchlorémie se může objevit, když je tělo vystaveno tekutinám s vysokým obsahem chloridů. Extrémním příkladem je utopení/požití slané vody. Náhlý velký přísun mořské vody (průměrná salinita je 3,5 %) přetíží schopnost ledvin vylučovat nálož chloridu sodného a hypernatrémie a hyperchlorémie jsou běžné.23 Nicméně složka hypernatrémie a hyperchlorémie spojené s nadměrným požitím slané vody pochází ze ztrát tekutin spojených s průjmem a ztrátami močí.23 Léčba pacientů s hyperchlorémií způsobenou utonutím ve slané vodě bude záviset na objemovém stavu pacienta a také na odhadu probíhajících ztrát tekutin a elektrolytů a na uvážlivém nahrazování vody a elektrolytů podle potřeby.
Méně extrémním příkladem hyperchlorémie s nadměrnou náloží chloridu sodného je podávání velkých objemů izotonického (0,9%) roztoku chloridu sodného (fyziologického roztoku), který se často používá k objemové resuscitaci pacientů. Je pozoruhodné, že když je normálnímu jedinci podán velký bolus izotonického fyziologického roztoku, může trvat až 2 dny, než se vrátí do stavu rovnováhy sodíku a chloridů před léčbou.24 K této retenci chloridů dochází při vystavení suprafyziologickému množství chloridů v normálním fyziologickém roztoku. Normální koncentrace chloridů v plazmě se pohybuje v rozmezí 95-110meq/l, zatímco normální fyziologický roztok má koncentraci chloridů 154meq/l. Relativně pomalá vylučovací reakce na izotonický fyziologický roztok může souviset s účinky zátěže chloridy na průtok krve ledvinami a na glomerulární filtraci (tubuloglomerulární zpětná vazba). Ačkoli při zátěži chloridem sodným dochází k down-regulaci aktivity chloridových reabsorpčních transportérů,14,25,26 rychlost snížení těchto transportérů není dobře definována.
Při podávání izotonického fyziologického roztoku může se stoupající koncentrací chloridů klesat i koncentrace bikarbonátu. Kromě ředění hydrogenuhličitanu v plazmě při podávání suprafyziologických roztoků obsahujících chloridy a neobsahujících báze, jako je fyziologický roztok, mohou při poklesu hydrogenuhličitanu a vzestupu hladiny chloridů hrát roli i další faktory. K poklesu hladiny hydrogenuhličitanu v séru mohou přispívat ztráty hydrogenuhličitanu močí, protože při objemové expanzi může dojít ke snížení reabsorpčního prahu pro hydrogenuhličitan.27 K těmto ztrátám hydrogenuhličitanu může docházet i při nízké koncentraci hydrogenuhličitanu v séru.27 Ve studiích u lidí během prvních 24 hodin po podání infuze izotonického fyziologického roztoku ztráty sodíku a draslíku převyšují ztráty chloridu. Snížené vylučování chloridů ve srovnání se sodíkem a draslíkem naznačuje ztráty dalších aniontů močí, jako je hydrogenuhličitan a další organické anionty, které mohou rovněž přispívat k poklesu koncentrace hydrogenuhličitanu v séru.24 Použití vyvážených roztoků elektrolytů, které obsahují báze nebo ekvivalenty bází a koncentrace chloridů, které jsou fyziologičtější, může nejen zabránit rozvoji hyperchloremické acidózy, ale může zabránit některým možným škodlivým účinkům spojeným s hyperchloremickými roztoky, jako je fyziologický roztok.28,29 Ve srovnání s vyváženými roztoky solí obsahujícími báze vedlo podávání normálního fyziologického roztoku zdravým lidem k poklesu průtoku krve ledvinami a korové perfuze30 , což vyvolává obavy z nadměrného podávání normálního fyziologického roztoku při objemové resuscitaci pacientů. Nicméně v určitých klinických situacích může být použití normálního fyziologického roztoku příznivé, včetně pacientů s hypochloremickou metabolickou alkalózou nebo pacientů s edémem mozku.
Hyperchlorémie při metabolické acidóze
Hyperchlorémie vzniká také při přidání kyseliny chlorovodíkové (HCl) do krve. HCl se zřídkakdy podává jako přímé okyselující činidlo, ale může vznikat z metabolismu chloridu amonného nebo kationtových aminokyselin, jako je lysin a arginin.31 Tvorba HCl vede k reakci H+ s HCO3-, která má za následek tvorbu CO2 a čistou ztrátu HCO3- a zvýšení koncentrace chloridů.
Dýcháním se titrovaný bikarbonát ztrácí z těla jako CO2.
Proto se na každý přidaný miliekvivalent HCl spotřebuje miliekvivalent bikarbonátu, který se přemění na CO2, takže hladina chloridů stoupá ve stejném rozsahu, v jakém klesá hladina bikarbonátu.
Renální tubulární acidózy (proximální RTA typu 2 a distální RTA typu 1 nebo 4) vedou k hyperchloremické metabolické acidóze. U proximální RTA (typ 2) je narušena reabsorpce bikarbonátu v proximálním tubulu, což vede ke zvýšeným ztrátám bikarbonátu z tohoto segmentu. Dochází také k určitému narušení reabsorpce chloridů, protože nedostatečná extrakce bikarbonátu brání normálnímu vzestupu luminální koncentrace chloridů. Nicméně u proximální RTA je snížení transportu bikarbonátu větší než snížení transportu chloridu, takže se reabsorbuje relativně více chloridu než bikarbonátu. Pokud se jako model pro proximální RTA použije inhibice karboanhydrázy, zdá se, že reabsorpce chloridů je méně narušena než reabsorpce bikarbonátů, což se projevuje relativně mírným zvýšením rychlosti vylučování chloridů močí, zatímco rychlost vylučování sodíku, draslíku a pravděpodobně i bikarbonátů je výrazně zvýšena.32
Při klasické distální RTA (typ 1) nebo RTA typu 4 snížení čisté sekrece kyseliny brání renální tvorbě nového bikarbonátu tím, že zhoršuje vylučování amoniaku a/nebo titrovatelné kyseliny. Výsledkem je, že HCl vznikající při metabolismu vede k poklesu bikarbonátu, který není kompenzován tvorbou a uchováváním bikarbonátu a vylučováním chloridů. Dokud je zachována funkce ledvin, nekumulují se v systémové cirkulaci kyselé anionty, které nejsou chloridy, a udržuje se tak relativně normální aniontová mezera. Ve skutečnosti je renální vylučování fosfátových a sulfátových aniontů vznikajících při metabolismu aminokyselin obsahujících fosfor a síru31 ve skutečnosti stimulováno acidózou.33
Další příčinou hyperchloremické metabolické acidózy je průjem. V mnoha segmentech gastrointestinálního traktu a přidružených exokrinních orgánů, jako je pankreas, je bikarbonát vylučován do střeva výměnou za chloridy, takže ztráty bikarbonátu, zejména při sekrečních formách průjmu, mohou být spojeny se ztrátami bikarbonátu, které jsou spojeny s retencí chloridů34.
Napravení hyperchloremických forem metabolické acidózy zahrnuje zastavení probíhající příčiny ztráty bikarbonátu nebo tvorby HCl a zároveň podávání bikarbonátu nebo bazických ekvivalentů (např. citrátu) nebo umožnění regenerace bikarbonátu ledvinami pacienta, pokud je funkce ledvin relativně normální. Během vzniku metabolické acidózy dochází zpočátku k čistým ztrátám sodíku a objemové kontrakci. Při déle trvající acidóze může dojít k retenci sodíku v důsledku vysoké hladiny aldosteronu a upregulace ENaC ve sběrném kanálku.35 Při poskytnutí bikarbonátu ke korekci acidózy se bikarbonát zadržuje v proximálním tubulu a obnoví se také normální reabsorpce chloridů. S bikarbonátem spojená reexpanze objemu může přispět k poklesu chloridů. Když ledviny napraví metabolickou acidózu, chlorid amonný se vylučuje močí, zatímco hydrogenuhličitan, který vzniká v proximálním tubulu jako vedlejší produkt metabolismu glutaminu, se vrací do krve.
Seznam klíčových bodů
-
Ledviny hrají klíčovou roli při udržování rovnováhy chloridů v organismu. Přestože je transport chloridů ledvinami spojen s transportem sodíku, může se někdy transport chloridů od transportu sodíku odchylovat.
-
Hyperchlorémie může být důsledkem různých stavů včetně deplece vody, nadměrné expozice chloridům a metabolické acidózy.
-
Patogenní příčina hyperchloremie poskytne vodítko, jak by měla být porucha léčena: deplece vody se léčí uvážlivým doplňováním vody, nadměrné podávání chloridů pozastavením dalšího podávání chloridů a hyperchloremická metabolická acidóza podáváním bikarbonátu.
Konflikt zájmů
Autor prohlašuje, že není ve střetu zájmů.