- Úvod
- Materiál a metody
- Indukce ICH
- Western Blotting
- Immunohistochemie
- Enzyme Linked Immunosorbent Assay
- Genetické vyřazení galektinu-3
- Statistická analýza
- Výsledky
- Temporální vzorec exprese galektinu-1 a galektinu-3 po ICH
- Buněčná lokalizace galektinu-1 a galektinu-3 po ICH
- Regulace zánětlivé odpovědi zprostředkovaná galektinem-1 a galektinem-3
- Diskuse
- Závěr
- Etické prohlášení
- Příspěvky autorů
- Financování
- Prohlášení o střetu zájmů
- Přídavné materiály
- Zkratky
Úvod
Intracerebrální krvácení je fatální podtyp cévní mozkové příhody (Qureshi et al., 2001a), která představuje 40 % nemocniční úmrtnosti a 80 % invalidity (van Asch et al., 2010). ICH je zodpovědná za 10-15 % všech cévních mozkových příhod a celosvětový výskyt ICH činí 2 miliony případů ročně (van Asch et al., 2010), přičemž ve Spojených státech je to přibližně 120 000 případů ročně (Ribo a Grotta, 2006; Broderick et al., 2007; Aguilar a Freeman, 2010). Očekává se však, že do roku 2050 se výskyt zdvojnásobí (Qureshi et al., 2001b) v důsledku stárnutí populace a rozšiřujícího se užívání antikoagulancií (Wang, 2010). Je pozoruhodné, že neexistuje žádná účinná léčba ICH a patofyziologie tohoto onemocnění je nedostatečně definována.
Neurozánět charakterizovaný aktivací mikroglie, neuroimunitních buněk CNS, je klíčovým faktorem sekundárního poškození mozku vyvolaného ICH a ztráty neurologických funkcí (Wang a Dore, 2007; Carmichael et al., 2008; Wang, 2010). Zavedení krevních složek, včetně trombinu, Hb a metabolitů Hb, jako je hemin, do mozku vytváří základ pro neurozánětlivé reakce po ICH (Wang a Dore, 2007; Carmichael a kol., 2008; Robinson a kol., 2009; Wang, 2010; Cai a kol., 2011; Dang a kol., 2011; Babu a kol., 2012; Lin a kol., 2012; Weng a kol., 2015; Min a kol., 2017). Pozoruhodné je, že prozánětlivá aktivace mikroglie po ICH koreluje s poškozením hematoencefalické bariéry, otokem/edémem mozku, expanzí hematomu, neurologickým zhoršením a špatným funkčním zotavením (Platt et al., 1998; Hickenbottom et al., 1999; Leira et al., 2004; Zhao et al., 2007). Kromě toho zánětlivá reakce po ICH také reguluje nábor monocytů/makrofágů z krve do mozku, o kterých je známo, že regulují poškození mozku vyvolané ICH, a tím i funkční zotavení (Tessier et al., 1997; Shiratori et al., 2010; Starossom et al., 2012).
Galectyny jsou rodina evolučně konzervovaných proteinů vázajících sacharidy (Barondes et al., 1994a,b; Kasai a Hirabayashi, 1996), které se podílejí na aktivaci, diferenciaci, proliferaci, migraci a apoptóze buněk (Perillo et al., 1995; Yang et al., 1996; Perillo et al., 1998; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002). Z různých členů rodiny galektinů se objevují důkazy o klíčové roli galektinu-1 a galektinu-3 v neuroimunitních reakcích u několika neuropatologických stavů (Jeon et al., 2010; Starossom et al., 2012; Parikh et al., 2015). V poznání jejich buněčné exprese a funkce po ICH však existuje kritická mezera. Cílem tohoto rukopisu je objasnit modulaci a buněčnou expresi galectinu-1 a galectinu-3 vyvolanou hemoragickým poraněním v mozku na preklinickém modelu ICH.
Materiál a metody
Indukce ICH
Intracerebrální krvácení bylo vyvoláno u dospělých myších samců CD-1 (8-12 týdnů; n = 43), jak bylo uvedeno dříve (Sukumari-Ramesh et al., 2012a,b, 2016; Bonsack et al., 2016; Sukumari-Ramesh a Alleyne, 2016; Ahmad et al., 2017; Chen-Roetling et al., 2017). Krátce, myš byla anestetizována (ketamin a xylazin) a byl proveden malý řez k odhalení lebky. Pomocí vysokorychlostního vrtáku byl na lebce vytvořen otvor (0,5 mm) přibližně 2,2 mm laterálně od bregma. Poté byla myš umístěna na stereotaxický rám hlavy a Hamiltonovou stříkačkou 26 G bylo pod stereotaxickým vedením injikováno 0,04U bakteriální kolagenázy typu IV (Sigma, St. Louis, MO, USA) v 0,5 μl fosfátového pufru (pH 7,4; PBS) do levého striata (3,0 mm). Po vyjmutí jehly byl otvor po vpichu utěsněn kostním voskem. Myši byly po celou dobu procedury udržovány při teplotě 37 ± 0,5 °C pomocí regulátoru teploty pro malá zvířata. Časový průběh hematomu po ICH je uveden (doplňkový obrázek S1).
Western Blotting
Myši byly anestetizovány a transkardiálně perfundovány PBS. Ipsilaterální mozková tkáň (hematomální i peri-hematomální oblasti mozku) byla odebrána do pufru RIPA obsahujícího inhibitory proteáz a fosfatáz a podrobena sonikaci. Vzorky byly poté centrifugovány při 14 000 otáčkách za minutu po dobu 5 minut při 4 °C, aby byl odebrán supernatant. Pomocí soupravy BCA protein assay kit (Pierce, Rockford, IL, Spojené státy) byly odhadnuty koncentrace proteinů a 30-50 mikrogramů vzorků bylo naneseno na 4-20% dodecylsulfát sodný-polyakrylamidový gel a přeneseno na polyvinyliden difluoridovou (PVDF) membránu. Bloty byly inkubovány s příslušnou primární protilátkou přes noc při 4 °C. Následovala 2hodinová inkubace s odpovídající sekundární protilátkou značenou Alexa Fluor. Bloty byly odečteny pomocí zobrazovacího systému Li-Cor Odyssey v blízké infračervené oblasti a kvantifikace byla provedena pomocí softwaru Quantity One (Bio-Rad, Foster City, CA, Spojené státy).
Immunohistochemie
Myši byly anestetizovány a transkardiálně perfundovány PBS. Mozky byly odebrány a umístěny do 4% paraformaldehydu přes noc při 4 °C a poté rychle zmraženy. Mozek byl poté pomocí kryostatu rozřezán na 25mm koronální řezy a upevněn na skleněná sklíčka. Řezy byly inkubovány 2 hodiny v 10% normálním oslím séru při pokojové teplotě. Následovala noční inkubace s příslušnou primární protilátkou při 4 °C. Po promytí byly řezy inkubovány s příslušnou sekundární protilátkou označenou Alexa Fluor po dobu 1 h při pokojové teplotě. Imunofluorescence byla stanovena pomocí konfokálního laserového mikroskopu Zeiss LSM510 Meta a byla stanovena buněčná kolokace, jak bylo popsáno dříve (Laird et al., 2010). Analyzovali jsme tři nepo sobě jdoucí řezy na zvíře a minimálně 3 náhodná pole kolem hematomu.
Enzyme Linked Immunosorbent Assay
RAW 264.7, buněčná linie myších makrofágů, byly naneseny na 24jamkovou destičku a ponechány 48 h inkubovat v DMEM (Dulbecco’s Modified Eagle Medium) obsahujícím 5 % fetálního hovězího séra, 5 % hovězího růstového séra a 1 % penicilinu/streptomycinu. Poté byly buňky inkubovány s myším rekombinantním galektinem-1 (6,25 nebo 12,5 μg/ml; R&D Systems, Minneapolis, MN, Spojené státy) po dobu 1 h a následovalo 18hodinové působení LPS (100 ng/ml) nebo heminu (30 μg/ml). Supernatant byl odebrán a použit pro detekci IL-6 metodou ELISA podle pokynů výrobce (Biolegend, San Diego, CA, Spojené státy). Stručně řečeno, 96jamková destička byla potažena přes noc při 4 °C specifickou záchytnou protilátkou. Po jednohodinovém blokování byl do jamek přidán supernatant buněčné kultury a inkubován 2 h při pokojové teplotě. Veškeré nenavázané materiály byly odstraněny promytím a do jamek byl přidán roztok detekční protilátky, který se nechal inkubovat 1 h při pokojové teplotě. Po dalším promytí bylo do každé jamky přidáno 100 μl roztoku avidinu a koňské ředkvičkové peroxidázy (HRP), který se působil 30 min při pokojové teplotě. Po promytí byl do jamek přidán roztok substrátu pro vyvolání barvy. Byl použit stop roztok a destička byla odečtena při vlnové délce 450 nm pomocí čtečky mikrotitračních destiček (Bio-Tek, Epoch).
Genetické vyřazení galektinu-3
RAW 264.7 buňky byly transfekovány buď kontrolní siRNA (ON-TARGET plus Non-targeting Pool; GE Dharmacon), nebo siRNA Galectin-3 (ON-TARGET plus Mouse Lgals3 siRNA; GE Dharmacon) pomocí HiPerFect Transfection Reagent (QIAGEN) podle pokynů výrobce. Vyřazení galektinu-3 bylo ověřeno 48 h po transfekci pomocí western blotu, jak bylo popsáno dříve.
Statistická analýza
Údaje byly analyzovány pomocí t-testu nebo jednocestné analýzy rozptylu s následným Student-Newman-Keulsovým post hoc testem a byly vyjádřeny jako průměr ± standardní chyba (SE). Za signifikantní byla považována p-hodnota < 0,05.
Výsledky
Temporální vzorec exprese galektinu-1 a galektinu-3 po ICH
Pro vyhodnocení, zda hemoragické poranění vede k modulaci exprese galektinu-1 a galektinu-3 v mozku, byla u myší metodou injekce kolagenázy vyvolána ICH nebo Sham. Vzhledem k objevující se roli galektinu-1 a galektinu-3 v neuroimunitních reakcích byly ipsilaterální řezy mozkem myší s sham nebo ICH podrobeny hodnocení pomocí western blottingu i imunohistochemické analýzy v různých časových bodech od 1. do 7. dne po operaci, tedy v období po poranění, které po ICH vykazovalo pozoruhodnou indukci jak pro-, tak protizánětlivé aktivace mikroglie/makrofágů i astrocytů (Sukumari-Ramesh et al., 2012b, 2016; Bonsack et al., 2016).
Pozoruhodné je, že řezy mozkem z falešných nebo kontralaterálních oblastí mozku po ICH vykazovaly velmi okrajovou nebo nedetekovatelnou expresi galektinu-1 a galektinu-3, zatímco zvýšená exprese galektinu-1 a galektinu-3 byla pozorována 3., 5. a 7. den po ICH (obr. 1, 2). V souladu s tím se počet imunopozitivních buněk Galectin-1 významně zvýšil přibližně 4krát, 6krát a 4krát 3., 5. a 7. den po ICH ve srovnání s falešnými buňkami (obrázek 1B). Toto pozorování bylo dále potvrzeno pomocí analýzy Western blotting, která odhalila pozoruhodnou a významnou indukci galectinu-1 počínaje 3. dnem po ICH ve srovnání s falešným (obr. 1C,D). Dále indukce galectinu-3 (obrázek 2) odrážela expresi galectinu-1 po ICH a počet imunopozitivních buněk galectinu-3 byl přibližně 15, 28 a 24násobně vyšší 3., 5. a 7. den po ICH (obrázek 2B) ve srovnání se shamem a western blotting s následnou denzitometrickou analýzou potvrdil zvýšenou expresi galectinu-3 po ICH vyvolanou zraněním (obrázky 2C,D).
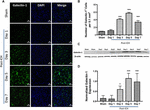
Obrázek 1. Zvýšená exprese galektinu-1 po ICH. (A) Konfokální snímky zobrazující časový průběh exprese galektinu-1 po ICH (měřítko = 20 μm; n = 3-5 na skupinu). (B) Průměrný počet Galectin-1-pozitivních buněk na 0,1 mm2 v ipsilaterálním striatu. (C) Zvýšená exprese galektinu-1 byla potvrzena western blottingem mozkové tkáně z ipsilaterálního striata. (D) Denzitometrická analýza (n = 3-5 na skupinu) dat z western blottingu. ∗p < 0,05, ∗∗∗p < 0,001 vs. sham.
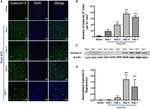
Obrázek 2. Zvýšená exprese galektinu-3 po ICH. (A) Časový průběh exprese galektinu-3 v perihematomální oblasti po ICH. Reprezentativní konfokální snímky ukazují pozoruhodné zvýšení exprese galektinu-3 po ICH ve srovnání se Shamem (měřítko = 20 μm; n = 3-5 na skupinu). (B) Průměrný počet Galectin-3 pozitivních buněk na 0,1 mm2 v ipsilaterálním striatu. (C) Časná exprese galektinu-3 byla dále potvrzena pomocí western blotu. (D) Denzitometrická analýza (n = 3-5 na skupinu) dat získaných western blottingem. ∗∗p < 0,01, ∗∗∗p < 0,001 vs. sham.
Buněčná lokalizace galektinu-1 a galektinu-3 po ICH
Pro stanovení buněčné lokalizace galektinu-1 a galektinu-3 po ICH byly řezy mozkem podrobeny duálnímu imunoznačení. Exprese galektinu-1 byla pozorována převážně v astrocytech pozitivních na GFAP (obr. 3A) a stereotaktické počítání buněk ukázalo, že 85 % buněk pozitivních na galektin-1 po ICH koexprimovalo GFAP. Kromě toho byla exprese galektinu-1 pozorována také u Iba1-pozitivních mikroglie/makrofágů po ICH (obrázek 3B), ale pouze 12 % galektin-1 pozitivních buněk koexprimovalo Iba1.
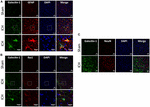
Obrázek 3. Exprese galektinu-1 je po ICH pozorována především v gliových buňkách. Řezy mozkem byly dvojitě imunobarveny na (A) Galectin-1 a GFAP, (B) Galectin-1 a Iba1, (nejnižší panel zobrazuje snímky s velkým zvětšením) a (C) Galectin-1 a NeuN (měřítko = 20 μm; n = 3 na skupinu). Exprese galektinu-1 byla pozorována především v buňkách pozitivních na GFAP a v podskupině buněk pozitivních na Iba1. NeuN pozitivní buňky neexprimovaly galektin-1 (n = 3 na skupinu).
Naproti tomu exprese galektinu-3 byla většinou omezena na Iba1 pozitivní buňky (obr. 4A) a exprese galektinu-3 nebyla přítomna v GFAP pozitivních buňkách (obr. 5A), což ukazuje na rozdílnou buněčnou expresi galektinu-1 a galektinu-3 po ICH. Dále byla exprese galektinu-3 pozorována u prozánětlivých, M1 mikrogliálních nebo makrofágových markerů, CD16/32 pozitivních buněk (obrázek 4B), což naznačuje novou roli galektinu-3 v neurozánětlivých reakcích po ICH. Pozoruhodné je, že 88 % a 92 % galectin-3 pozitivních buněk koexprimovalo Iba1 a CD16/32 pozitivní buňky. Pozoruhodné je, že mikroglie nebo makrofágy exprimující galektin-3 vykazovaly fagocytární fenotyp (obr. 4A,B), což naznačuje jeho neprozkoumanou roli ve fagocytóze zprostředkované mikroglií nebo makrofágy po ICH. Dále NeuN-pozitivní buňky neexprimovaly ani galektin-1, ani galektin-3 (obr. 3C, 5B).
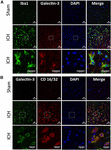
Obrázek 4. Exprese galektinu-3 v mikroglie/makrofágy po ICH. Řezy mozkem byly imunobarveny na přítomnost (A) galektinu-3 a Iba1 a (B) galektinu-3 a CD 16/32. Jak Iba1 (marker mikroglie/makrofágů), tak CD16/32 (marker prozánětlivých M1 mikroglie nebo makrofágů) – pozitivní buňky, exprimovaly Galectin-3 společně (n = 3 na skupinu).
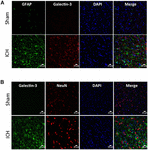
Obrázek 5. Buněčná lokalizace galektinu-3 po ICH. Řezy mozkem byly dvojitě imunobarveny (A) Galectinem-3 a GFAP a (B) Galectinem-3 a NeuN. Exprese galektinu-3 nebyla přítomna ani v buňkách pozitivních na GFAP, ani v buňkách pozitivních na NeuN. Měřítko = 20 μm; n = 3 na skupinu.
Regulace zánětlivé odpovědi zprostředkovaná galektinem-1 a galektinem-3
Pro zjištění možné funkční role galektinu-1 a galektinu-3 po ICH jsme provedli studie in vitro. Rekombinantní galektin-1 (6,25 a 12,5 μg/ml) významně tlumil LPS indukované uvolňování prozánětlivého cytokinu, interleukinu -6 (IL-6) z buněk RAW 264.7, jak bylo hodnoceno metodou ELISA, ve srovnání s kontrolami (obr. 6), což naznačuje negativní regulační úlohu galektinu-1 v zánětu.

Obr. 6. Rekombinantní galektin-1 a zánětlivá odpověď. Před stimulací LPS (100 ng/ml) byly buňky Raw 264.7 ošetřeny rekombinantním galektinem-1 a uvolňování IL-6 bylo měřeno pomocí ELISA, jak je podrobně popsáno v metodách. Rekombinantní galektin-1 významně snížil LPS indukované uvolňování IL-6 z RAW 246,7 buněk (n = 4 na skupinu). ∗∗∗p < 0,001 vs. LPS.
Pro testování funkční role galektinu-3 jsme provedli genetické vyřazení galektinu-3 zprostředkované siRNA u RAW 264.6.1 a RAW 246.1.7 buněk a zkoumala zánětlivou reakci. Umlčení genu pomocí siRNA významně snížilo expresi galektinu-3 v buňkách RAW 264.7 o 52,95 %, jak prokázalo western blotting (obr. 7A,B). Pozoruhodné je, že genetické vyřazení galektinu-3 pomocí siRNA nemodulovalo uvolňování IL-6 vyvolané LPS (obrázek 7C), zatímco genetické vyřazení galektinu-3 významně zvýšilo uvolňování IL-6 vyvolané heminem (metabolit hemoglobinu, který se ve vysoké koncentraci hromadí v intrakraniálních hematomech) (obrázek 7D), což naznačuje neprozkoumanou úlohu galektinu-3 v modulaci zánětlivé reakce po ICH.
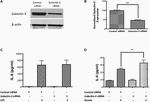
Obrázek 7. Galectin-3 a zánětlivá odpověď (A) Buňky RAW 246.7 byly ošetřeny buď kontrolní siRNA, nebo siRNA Galectin-3, jak je podrobně popsáno v metodách, a genetické vyřazení Galectin-3 bylo ověřeno pomocí (A) western blottingu a následné (B) denzitometrické analýzy. ∗∗∗p < 0,001 vs. kontrolní siRNA. (C) Vyřazení galektinu-3 nemodulovalo LPS indukované uvolňování IL-6 (D), zatímco významně neregulovalo heminem indukované uvolňování IL-6 z buněk RAW 246,7 ve srovnání s kontrolou (n = 3 na skupinu). ∗∗p < 0,01 vs. hemin.
Diskuse
Galectyny jsou rodina endogenních proteinů vázajících sacharidy, které hrají kritickou roli za fyziologických i patologických podmínek tím, že interagují s glykosylovanými receptory na povrchu buněk a modulují intracelulární signální dráhy (Perillo et al., 1995, 1998; Yang et al., 1996; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002; Laaf et al., 2019). Galektiny vykazují značnou sekvenční podobnost ve své sacharidové rozpoznávací doméně (CRD) se zvýšenou afinitou k β-galaktosidům a původně byly definovány schopností rozpoznávat disacharid N-acetyllaktosamin (Barondes et al., 1994a,b; Kasai a Hirabayashi, 1996). Nedávné studie však ukazují podstatné rozdíly v jejich vlastnostech vázání sacharidů (Hirabayashi et al., 2002; Leffler et al., 2002; Carlsson et al., 2007).
Galectin-1, nejvíce ubikvitně exprimovaný člen rodiny galektinů (Stillman et al., 2006), se podílí na regulaci vrozené a adaptivní imunity a je přítomen jak v intracelulárních, tak extracelulárních lokalizacích (Verschuere et al., 2014). Extracelulární funkce galektinu-1 jsou z velké části závislé na vlastnostech vazby sacharidů, zatímco intracelulární funkce zahrnují především interakce nezávislé na sacharidech (Verschuere et al., 2014). V souladu s úlohou galektinu-1 v imunitní odpovědi na periferii je známo, že galektin-1 potlačuje aktivaci makrofágů (Barrionuevo et al., 2007), podporuje selektivní apoptózu T buněk (Toscano et al., 2007), indukuje sekreci protizánětlivého cytokinu IL-10 (van der Leij et al., 2004; Cedeno-Laurent et al., 2012) a tlumí produkci oxidu dusnatého (NO) makrofágy (Correa et al., 2003).
Galectin-1 je v embryonálních stadiích široce exprimován v nervových tkáních, ale po dozrání se omezuje především na periferní tkáně (Horie a Kadoya, 2002). V souladu s tím vykazovalo nepoškozené mozkové striatum okrajovou expresi galektinu-1. Při hemoragickém poranění mozku však byla pozorována velmi výrazná exprese galektinu-1 v GFAP-pozitivních astrocytech. V souladu s tím se Galectin-1 podílí na diferenciaci astrocytů a následném uvolňování BDNF (Brain Derived Neurotrophic factor) po poranění mozku, což naznačuje roli Galectinu-1 v neuroprotekci (Sasaki et al., 2004; Qu et al., 2010). Galectin-1 je dále díky své schopnosti vázat sacharidy jedním z klíčových regulátorů neurogeneze dospělých a podporuje funkční zotavení po cévní mozkové příhodě (Ishibashi et al., 2007). Podávání galektinu-1 snížilo apoptózu neuronů, zmenšilo objem mozkového infarktu a zlepšilo neurologické funkce vyvolané mozkovou ischémií (Qu et al., 2011). Také nativní a rekombinantní galektin-1 chránil myší a potkaní mozečkové neurony před neurotoxickými účinky glutamátu (Lekishvili et al., 2006). Za zmínku stojí, že galektin-1 deaktivuje zánětlivé mikroglie a chrání před neurodegenerací vyvolanou zánětem (Starossom et al., 2012). Naše studie dále prokázaly, že rekombinantní galektin-1 tlumí uvolňování prozánětlivého cytokinu IL-6 z LPS stimulovaných myších makrofágů RAW 264.7 ve srovnání s kontrolami, což implikuje negativní regulační roli galektinu-1 v zánětu.
Galectin-1 je jedním z endogenních ligandů CD45 (Walzel et al., 1999), který reguluje aktivaci mikroglie/makrofágů. Interakce galektinu-1 s CD45 navíc vede k zadržení tohoto glykoproteinu na plazmatické membráně a zvýšení jeho fosfatázové aktivity. Nedávné studie prokázaly, že CD45 negativně reguluje prozánětlivou aktivaci M1 mikroglií, ale podporuje protizánětlivý, M2 fenotyp prostřednictvím modulace signálních drah mitogenem aktivované proteinkinázy p38 (p38MAPK), CREB (cAMP response element binding) a NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) (Starossom et al., 2012). Tento účinek zahrnoval vazbu galektinu-1 na jádro 2 O-glykanů na CD45, což naznačuje, že exprese glykanových částí na aktivovaných mikrogliích/makrofázích je nezbytná pro vazbu a funkci galektinu-1 (Starossom et al., 2012). Galectin-1 navíc potlačil neurozánět vyvolaný metamfetaminem v lidských mozkových mikrovaskulárních endoteliálních buňkách (Parikh et al., 2015) a předpokládá se, že se Galectin-1 podílí na růstu neuritů a synaptické konektivitě. Celkově tyto údaje naznačují, že indukce galektinu-1 v reaktivních astrocytech po ICH by mohla být mechanismem mezibuněčné komunikace usnadňujícím regulaci neuroprotekce po ICH zprostředkovanou astrocyty, který si zaslouží další zkoumání.
Galectin-3 je protein chimérického typu o velikosti 25-35 kDa, jehož funkce úzce závisí na lokalizaci (Thomas a Pasquini, 2018). Exprese galektinu-3 byla zjištěna v jádře a v cytoplazmě (Liu et al., 2002). Dále mohou makrofágy a aktivovaná mikroglie uvolňovat galektin-3 do extracelulárního prostoru, což vede k remodelaci extracelulární matrix, respektive ke změněné zánětlivé odpovědi (Li et al., 2008; Jeon et al., 2010). Namísto klasické cesty sekrece přes endoplazmatické retikulum/Golgiho sleduje galektin-3 alternativní sekreční cestu sekrece a exportu (Mehul a Hughes, 1997) a po uvolnění interaguje s několika extracelulárními receptory. Ačkoli je galektin-3 úzce spojen se zánětlivou kaskádou reakcí, přesná funkční role galektinu-3 v neurozánětu je značně sporná. Uvádí se však, že galektin-3 uvolňovaný mikrogliemi působí jako endogenní ligand TLR-4 (Toll Like Receptor-4) (Burguillos et al., 2015). Dále genetická delece galektinu-3 snížila ztrátu neuronů a podání protilátky proti galektinu-3 mělo neuroprotektivní účinky v preklinickém modelu traumatického poškození mozku (Yip et al., 2017), což společně naznačuje škodlivou roli galektinu-3 po poškození mozku. Naproti tomu cílené odstranění galektinu-3 zhoršilo ischemické poškození mozku a neurodegeneraci po mozkové ischemii (Lalancette-Hebert et al., 2012), což naznačuje neuroprotektivní roli gelectinu-3 po poškození mozku. Kromě toho galektin-3 přispívá k angiogenezi a neurogenezi, což naznačuje jeho možnou úlohu při opravě mozku po ischemii (Yan et al., 2009). Galectin-3 také podporuje diferenciaci oligodendroglie, což přispívá k funkčnímu zotavení po demyelinizačních poruchách (Pasquini et al., 2011). Tyto protichůdné funkční role galektinu-3 po neuropatologii mohou být způsobeny rozdílnou subcelulární expresí galektinu-3 nebo rozdíly v patofyziologii mozkových poruch, které si zaslouží další zkoumání.
Shodně s jinými neuropatologickými stavy jsme pozorovali zvýšenou expresi galektinu-3 po ICH a exprese byla pozorována převážně v Iba1 pozitivních buňkách, zánětlivých buňkách CNS. Iba1 pozitivní buňky po ICH by mohly být buď mikroglie, nebo infiltrující makrofágy, které hrají roli ve vrozené imunitní odpovědi. Nedávné studie ukazují, že mikroglie a makrofágy mohou mít po mozkové patologii rozdílné role (Gao et al., 2017). V souladu s tím studie s primárními kulturami mikroglií dokládají prozánětlivou roli galektinu-3 (Burguillos et al., 2015), zatímco studie s makrofágy prokazují protizánětlivou roli (MacKinnon et al., 2008), což opravňuje k dalšímu zkoumání. Genetické vyřazení galektinu-3 u buněk RAW 246.7 navíc zvýšilo heminem indukované uvolňování IL-6, prozánětlivého cytokinu, což implikuje roli galektinu-3 v zánětlivých reakcích po ICH. Kromě toho mikroglie nebo makrofágy exprimující galektin-3 vykazovaly fagocytární fenotyp, což naznačuje jeho dosud neprozkoumanou roli ve fagocytóze zprostředkované mikroglií nebo makrofágy, která hraje klíčovou roli při řešení hematomu a následném zotavení mozku po ICH. Nedávné zprávy shodně naznačují, že makrofágy, které se hromadí v CNS během infekce parazitem, hojně exprimují galektin-3 (Quenum Zangbede et al., 2018) a aktivovaná mikroglie fagocytuje buňky prostřednictvím galektinu-3 (Nomura et al., 2017). Kromě toho byly zvýšené plazmatické hladiny galektinu-3 silně spojeny se zánětem, závažností a špatnými výsledky u pacientů s akutní ICH (Yan et al., 2016). Proto jsou zapotřebí další studie objasňující funkční role galektinu-3 po ICH.
Závěr
Galektin-1 a galektin-3 vykazovaly velmi hlubokou a zvýšenou expresi od 3. do 7. dne po poranění, v perihematomální oblasti mozku po ICH ve srovnání s Sham. Dále byla exprese galektinu-1 pozorována převážně v GFAP pozitivních astrocytech, zatímco exprese galektinu-3 byla pozorována převážně v Iba1 a také v CD16/32 pozitivních buňkách, zánětlivých buňkách CNS. Genetické studie navíc odhalily negativní regulační roli jak galektinu-1, tak galektinu-3 při uvolňování prozánětlivého cytokinu IL-6 v závislosti na podnětu. Celkově tyto údaje naznačují, že galektin-1 a galektin-3 by mohly být cílem při modulaci gliových reakcí, a tím i poškození mozku po ICH, což si zaslouží další zkoumání.
Etické prohlášení
Studie na zvířatech byly přezkoumány a schváleny Výborem pro použití zvířat pro výzkum a vzdělávání na Augusta University v souladu se směrnicemi NIH a USDA.
Příspěvky autorů
FB provedl imunohistochemické studie a studie buněčných kultur a western blotting a podílel se na analýze dat. SS-R vymyslel a navrhl experimenty, provedl operace na zvířatech, genetické studie a analýzu dat a vypracoval rukopis. Oba autoři přečetli a schválili konečný rukopis.
Financování
Tato práce byla podpořena granty National Institutes of Health (R01NS107853) a American Heart Association (14SDG18730034) pro SS-R.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Přídavné materiály
Přídavné materiály k tomuto článku naleznete online na adrese: https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
Obrázek S1 | Časový obraz hematomu po ICH.
Zkratky
CD16/32, Cluster of Differentiation 16/32; CD45: Cluster of Differentiation 45; CNS, centrální nervový systém; ELISA, enzymatická imunosorbční analýza; GFAP, gliální fibrilární kyselý protein; Hb, hemoglobin; Iba1, ionizovaná adaptorová molekula vázající vápník 1; ICH, intracerebrální krvácení; LPS, lipopolysacharid; NeuN, neuronální jádra; PBS, fosfátový pufr; RIPA, radioimunoprecipitace.
Aguilar, M. I., a Freeman, W. D. (2010). Spontánní intracerebrální krvácení. Seminář. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D. a Dore, S. (2017). Účinnost laropiprantu při minimalizaci poškození mozku po experimentálním intracerebrálním krvácení. Sci. Rep. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., and Adamson, C. (2012). Trombin a hemin jako ústřední faktory v mechanismech sekundárního poškození mozku vyvolaného intracerebrálním krvácením a jako potenciální cíle intervence. Neurosurg. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galectins: a family of animal beta-galactoside-binding lectins. Cell 76, 597-598. doi: 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., and Leffler, H. (1994b). Galectins. Struktura a funkce velké rodiny živočišných lektinů. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). Nová funkce galektinu-1 na křižovatce vrozené a adaptivní imunity: galektin-1 reguluje fyziologii monocytů/makrofágů prostřednictvím neapoptotické dráhy závislé na ERK. J. Immunol. 178, 436-445. doi: 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr. a Sukumari-Ramesh, S. (2016). Zvýšená exprese TSPO po intracerebrálním krvácení: role v zánětu? J. Neuroinflamm. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American heart association/american stroke association stroke council, high blood pressure research council, and the quality of care and outcomes in research interdisciplinary working group. Circulation 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). Mikrogliemi vylučovaný galektin-3 působí jako ligand toll-like receptoru 4 a přispívá k aktivaci mikroglií. Cell Rep. 10, 1626-1638. doi: 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). Aktivované mikroglie jsou méně zranitelné vůči toxicitě heminu díky inhibici aktivace JNK a p38 MAPK v závislosti na oxidu dusnatém. J. Immunol. 187, 1314-1321. doi: 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). Afinita galektinu-8 a jeho sacharidových rozpoznávacích domén k ligandům v roztoku a na povrchu buněk. Glycobiology 17, 663-676. doi: 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). Genomické profily poškození a ochrany u lidského intracerebrálního krvácení. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi: 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K., and Dimitroff, C. J. (2012). Galectin-1 spouští imunoregulační podpis v Th buňkách funkčně definovaný expresí IL-10. J. Immunol. 188, 3127-3137. doi: 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M., and Regan, R. F. (2017). Astrocytární hemová oxygenáza-1 snižuje mortalitu a zlepšuje výsledky po intracerebrálním krvácení vyvolaném kolagenázou. Neurobiol. Dis. 102, 140-146. doi: 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A., and Rabinovich, G. A. (2003). Protichůdné účinky galektinu-1 na alternativní metabolické dráhy L-argininu v rezidentních, zánětlivých a aktivovaných makrofázích. Glycobiology 13, 119-128. doi: 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R., and Bishop, G. M. (2011). Příjem, metabolismus a toxicita heminu v kultivovaných neuronech. Neurochem. Int. 58, 804-811. doi: 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., et al. (2017). Protichůdné funkce mikrogliálního a makrofágového TNFR2 v patogenezi experimentální autoimunitní encefalomyelitidy. Cell Rep. 18, 198-212. doi: 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R., and Watt, D. J. (2002). Vliv galektinu-1 na diferenciaci fibroblastů a myoblastů in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A., and Aronowski, J. (1999). Nukleární faktor-kappaB a buněčná smrt po experimentálním intracerebrálním krvácení u potkanů. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). Oligosacharidová specifita galektinů: hledání pomocí frontální afinitní chromatografie. Biochim. Biophys. Acta 1572, 232-254. doi: 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H. a Kadoya, T. (2002). Galectin-1 hraje zásadní roli v nervových tkáních dospělých savců. Role oxidovaného galektinu-1. Glycoconjugate J. 19, 479-489. doi: 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., et al. (2007). Galectin-1 reguluje neurogenezi v subventrikulární zóně a podporuje funkční zotavení po cévní mozkové příhodě. Exp. Neurol. 207, 302-313. doi: 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., and Park, E. J. (2010). Galectin-3 vykonává regulační účinky podobné cytokinům prostřednictvím dráhy JAK-STAT. J. Immunol. 185, 7037-7046. doi: 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., and Hirabayashi, J. (1996). Galectins: a family of animal lectins that decipher glycocodes. J. Biochem. 119, 1-8. doi: 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., and Kren, V. (2019). Interakce galektinů a sacharidů v biomedicíně a biotechnologiích. Trends Biotechnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R., and Dhandapani, K. M. (2010). Kurkumin zmírňuje edém mozku po traumatickém poranění mozku u myší: možná role aquaporinu-4? J. Neurochem. 113, 637-648. doi: 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., et al. (2012). Galectin-3 je nezbytný pro aktivaci a proliferaci rezidentní mikroglie v reakci na ischemické poškození. J. Neurosci. 32, 10383-10395. doi: 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., and Poirier, F. (2002). Úvod do problematiky galektinů. Glycoconjugate J. 19, 433-440. doi: 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Časné neurologické zhoršení u intracerebrálního krvácení: prediktory a související faktory. Neurology 63, 461-467. doi: 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., and Brown, D. R. (2006). Myší galektin-1 inhibuje toxicitu glutamátu modifikací exprese NR1 NMDA receptoru. Eur. J. Neurosci. 24, 3017-3025. doi: 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., et al. (2008). Galectin-3 je negativním regulátorem zánětu zprostředkovaného lipopolysacharidem. J. Immunol. 181, 2781-2789. doi: 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). Hem aktivuje zánětlivé poškození zprostředkované TLR4 prostřednictvím signální dráhy MyD88/TRIF u intracerebrálního krvácení. J. Neuroinflamm. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., and Wang, J. L. (2002). Intracelulární funkce galektinů. Biochim. Biophys. Acta 1572, 263-273. doi: 10.1016/s0304-4165(02)00313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H. a další (2008). Regulace alternativní aktivace makrofágů galectinem-3. J. Immunol. 180, 2650-2658. doi: 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., and Hughes, R. C. (1997). Cílení na plazmatickou membránu, vezikulární pučení a uvolňování galektinu 3 z cytoplazmy savčích buněk během sekrece. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., and Lee, S. J. (2017). Molekula hemu funguje jako endogenní agonista TLR2 astrocytů, který přispívá k sekundárnímu poškození mozku po intracerebrálním krvácení. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., and de Bono, D. P. (1999). Galectin 1 moduluje přichycení, šíření a migraci kultivovaných hladkých svalových buněk cév prostřednictvím interakcí s buněčnými receptory a složkami extracelulární matrix. J. Vasc. Res. 36, 47-58. doi: 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C., and Brown, G. C. (2017). Aktivovaná mikroglie desialyzuje a fagocytuje buňky prostřednictvím neuraminidázy. Galectin-3 a Mer Tyrosine Kinase. J. Immunol. 198, 4792-4801. doi: 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., et al. (2015). Galectin-1 potlačuje metamfetaminem indukovaný neurozánět v lidských mozkových mikrovaskulárních endoteliálních buňkách: neuroprotektivní role při udržování integrity krevní mozkové bariéry. Brain Res. 1624, 175-187. doi: 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., et al. (2011). Galectin-3 řídí diferenciaci oligodendrocytů za účelem kontroly integrity a funkce myelinu. Cell Death. Diff. 18, 1746-1756. doi: 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., and Baum, L. G. (1998). Galektiny: všestranné modulátory buněčné adheze, buněčné proliferace a buněčné smrti. J. Mol. Med. (Berl.) 76, 402-412. doi: 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J., and Baum, L. G. (1995). Apoptóza T buněk zprostředkovaná galectinem-1. Nature 378, 736-739. doi: 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., and Gordon, S. (1998). Rozpoznávání smrti: fagocytóza apoptotických buněk. Trends Cell Biol. 8, 365-372. doi: 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). Galectin-1 tlumí poškození související s astrogliózou a zlepšuje zotavení potkanů po fokální mozkové ischemii. J. Neurochem. 116, 217-226. doi: 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. P., Tang, Y. X., Zhang, Q., Tian, D. S., et al. (2010). Galectin-1 zvyšuje astrocytární produkci BDNF a zlepšuje funkční výsledky u potkanů po ischemii. Neurochem. Res. 35, 1716-1724. doi: 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J., and Mishra, B. B. (2018). Galectin-3 v makrofázích M2 hraje ochrannou roli při řešení neuropatologie u mozkové parazitární infekce regulací obratu neutrofilů. J. Neurosci. 38, 6737-6750. doi: 10.1523/jneurosci.3575-17.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Ling, G. S., Khan, J., Suri, M. F., Miskolczi, L., Guterman, L. R., et al. (2001a). Kvantitativní analýza poškozených, nekrotických a apoptotických buněk v novém experimentálním modelu intracerebrálního krvácení. Crit. Care Med. 29, 152-157. doi: 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H., and Hanley, D. F. (2001b). Spontánní intracerebrální krvácení. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M. a Grotta, J. C. (2006). Nejnovější pokroky v léčbě intracerebrálního krvácení. Curr. Neurol. Neurosci. Rep. 6, 17-22. doi: 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R., and Bishop, G. M. (2009). Toxicita heminu: zdroj poškození mozku po hemoragické cévní mozkové příhodě, kterému lze předcházet. Redox Rep. 14, 228-235. doi: 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K., and Endo, T. (2004). Galectin-1 indukuje diferenciaci astrocytů, která vede k produkci neurotrofického faktoru odvozeného od mozku. Glycobiology 14, 357-363. doi: 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M., and Inoue, K. (2010). Aktivace receptoru P2X7 indukuje produkci CXCL2 v mikroglie prostřednictvím cest NFAT a PKC/MAPK. J. Neurochem. 114, 810-819. doi: 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., et al. (2012). Galectin-1 deaktivuje klasicky aktivovanou mikroglie a chrání před neurodegenerací vyvolanou zánětem. Immunity 37,249-263. doi: 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). Galectin-3 a galectin-1 vážou odlišné receptory glykoproteinů na povrchu buněk a indukují smrt T-buněk. J. Immunol. 176, 778-789. doi: 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., and Alleyne, C. H. Jr (2016). Podávání terc-butylhydrochinonu po úrazu tlumí akutní neurologické poškození po intracerebrálním krvácení u myší. J. Mol. Neurosci. MN 58, 525-531. doi: 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. a Dhandapani, K. M. (2012a). Exprese survivinu specifická pro astrocyty po intracerebrálním krvácení u myší: možná role v reaktivní glióze? J. Neurotrauma 29, 2798-2804. doi: 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012b). Astroglióza: cíl intervence u intracerebrálního krvácení? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi: 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. a Dhandapani, K. M. (2016). Inhibitor histonové deacetylázy kyselina suberoylanilidová hydroxamová (SAHA) poskytuje akutní neuroprotekci po intracerebrálním krvácení u myší. Transl. Stroke Res. 7, 141-148. doi: 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S., and McColl, S. R. (1997). Chemokinové sítě in vivo: zapojení chemokinů C-X-C a C-C do extravazace neutrofilů in vivo v reakci na TNF-alfa. J. Immunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., and Pasquini, L. A. (2018). Galectinem-3 zprostředkovaný gliový crosstalk řídí diferenciaci oligodendrocytů a (re)myelinizaci. Front. Cell. Neurosci. 12:297. doi: 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., et al. (2007). Diferenciální glykosylace efektorových buněk TH1, TH2 a TH-17 selektivně reguluje náchylnost k buněčné smrti. Nat. Immunol. 8, 825-834. doi: 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A., and Klijn, C. J. (2010). Incidence, fatalita případů a funkční výsledky intracerebrálního krvácení v čase podle věku, pohlaví a etnického původu: systematický přehled a metaanalýza. Lancet Neurol. 9, 167-176. doi: 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). Dimerický galektin-1 indukuje produkci IL-10 v T-lymfocytech: důležitý nástroj v regulaci imunitní odpovědi. J. Pathol. 204, 511-518. doi: 10.1002/path.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., et al. (2014). Gliomem odvozený galektin-1 reguluje vrozenou a adaptivní protinádorovou imunitu. Int. J. Cancer 134, 873-884. doi: 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). Galectin-1 specificky moduluje signály TCR tak, že zvyšuje apoptózu TCR, ale inhibuje produkci IL-2 a proliferaci. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., and Brock, J. (1999). Galectin-1, přirozený ligand pro receptorovou proteinovou tyrozinfosfatázu typu CD45. Immunol. Lett. 67, 193-202. doi: 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Preklinický a klinický výzkum zánětu po intracerebrálním krvácení. Prog. Neurobiol. 92, 463-477. doi: 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., and Dore, S. (2007). Zánět po intracerebrálním krvácení. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Wu, X. F., Liu, R., Tian, Y. a další (2015). N-methyl-D-asparaginový receptor 1 (NMDAR1) zhoršuje sekundární zánětlivé poškození vyvolané cestou hemin-NLRP3 po intracerebrálním krvácení. Chin. J. Traumatol. 18, 254-258. doi: 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y., and Kirino, T. (2000). Exprese mRNA galektinu-1 koreluje s maligním potenciálem lidských gliomů a exprese antisense galektinu-1 inhibuje růst 9 gliomových buněk. J. Neurosci. Res. 59, 722-730. doi: 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q., and Dai, W. M. (2016). Úloha galektinu-3 v plazmě jako prediktivního biomarkeru výsledku po akutním intracerebrálním krvácení. J. Neurol. Sci. 368, 121-127. doi: 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R., and Dempsey, R. J. (2009). Galectin-3 zprostředkovává postischemickou remodelaci tkání. Brain Res. 1288, 116-124. doi: 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., and Liu, F. T. (1996). Exprese galektinu-3 moduluje růst a apoptózu T-buněk. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi: 10.1073/pnas.93.13.6737
PubMed Abstract | CrossRef Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). Galectin-3 uvolněný v reakci na traumatické poranění mozku působí jako alarmin orchestrující imunitní odpověď mozku a podporující neurodegeneraci. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C., and Aronowski, J. (2007). Odlišné vzorce změn v expresi podjednotek NF-kappaB, iNOS a COX-2 vyvolaných intracerebrálním krvácením. J. Neurochem. 101, 652-663. doi: 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar
.