Triacylglyceridy/fosfolipidy Stereochemie
Glycerol je achirální molekula, protože C2 má dva identické substituenty, -CH2OH. Glycerol se v těle může chemicky přeměnit na triacylglyceridy a fosfolipidy (PL), které jsou chirální a které existují v jedné enantiomerní formě. Jak je to možné, když obě skupiny CH2OH na glycerolu jsou identické? Ukazuje se, že i když jsou tyto skupiny stereochemicky ekvivalentní, můžeme je rozlišit následujícím způsobem. Orientujte glycerol tak, aby OH na C2 směřoval doleva. OH na C1 pak nahraďte OD, kde D je deuterium. Nyní nejsou oba alkoholové substituenty na C1 a C3 identické a výsledná molekula je chirální. Otočením molekuly tak, aby H na C2 směřoval dozadu, a přiřazením priorit ostatním substituentům na C2 následujícím způsobem: OH =1, DOCH2 =2 a CH2OH = 3, je vidět, že výsledná molekula je v konfiguraci S. Proto říkáme, že C1 je uhlík proS. Podobně, pokud bychom OH na C3 nahradili OD, vznikne enantiomer R. C3 je tedy uhlík proR. Z toho vyplývá, že ve skutečnosti můžeme rozlišovat mezi dvěma identickými substituenty CH2OH. Říkáme, že glycerol není chirální, ale prochirální. (Představte si to tak, že glycerol má potenciál stát se chirálním úpravou jednoho ze dvou identických substituentů.)
Obrázek: Glycerol – prochirální molekula
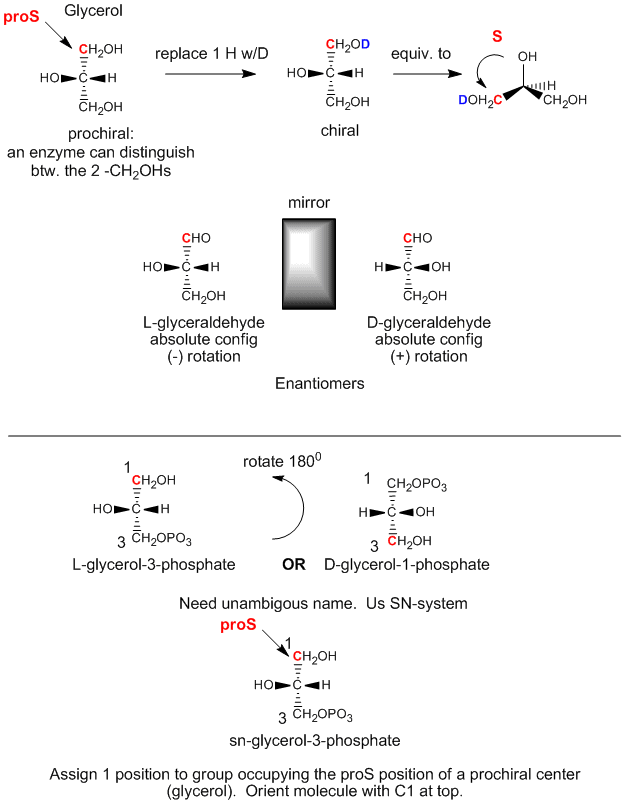
Výše uvedenou konfiguraci glycerolu (kdy OH na C2 směřuje doleva) můžeme vztáhnout k absolutní konfiguraci L-glyceraldehydu, jednoduchého cukru (polyhydroxyaldehydu nebo ketonu), dalšího derivátu 3C glycerolu. Tato molekula je chirální s OH na C2 (jediný chirální uhlík) směřujícím doleva. Je snadné si zapamatovat, že každý L cukr má OH na posledním chirálním uhlíku směřující doleva. Enantiomerem (zrcadlovým izomerem) L-glyceraldehydu je D-glyeraldehyd, u kterého OH na C2 směřuje doprava. Biochemici používají L a D pro stereochemii lipidů, cukrů a aminokyselin namísto názvosloví R,S, které se používá v organické chemii. Stereochemické označení všech cukrů, aminokyselin a glycerolipidů lze určit z absolutní konfigurace L a D-glyceraldehydu.
První krok při syntéze chirálních derivátů in vivo (v těle) z achirálního glycerolu zahrnuje fosforylaci OH na C3 pomocí ATP (fosfoanhydridu podobné struktury jako anhydrid kyseliny octové, vynikajícího acetylačního činidla) za vzniku chirální molekuly glycerolfosfátu. Na základě absolutní konfigurace L-glyceraldehydu a jejího využití k nakreslení glycerolu (s OH na C2 směřujícím doleva) vidíme, že fosforylovanou molekulu lze pojmenovat L-glycerol-3-fosfát. Otočením této molekuly o 180 stupňů, aniž bychom změnili stereochemii molekuly, však molekulu vůbec nezměníme, ale pomocí výše uvedeného názvosloví D/L bychom otočenou molekulu pojmenovali jako D-glycerol-1-fosfát. Nemůžeme dát téže molekule dva různé názvy. Proto biochemici vyvinuli stereospecifický systém číslování (sn), který přiřazuje 1-pozici prochirální molekuly skupině zaujímající polohu proS. Při použití tohoto názvosloví vidíme, že výše popsanou chirální molekulu glycerol-fosfátu lze jednoznačně pojmenovat jako sn-glycerol-3-fosfát. Hydroxylový substituent na uhlíku proR byl fosforylován.
Obrázek: Biologická syntéza triacylglyceridů a kyseliny fosfatidové z prochirálního glycerolu
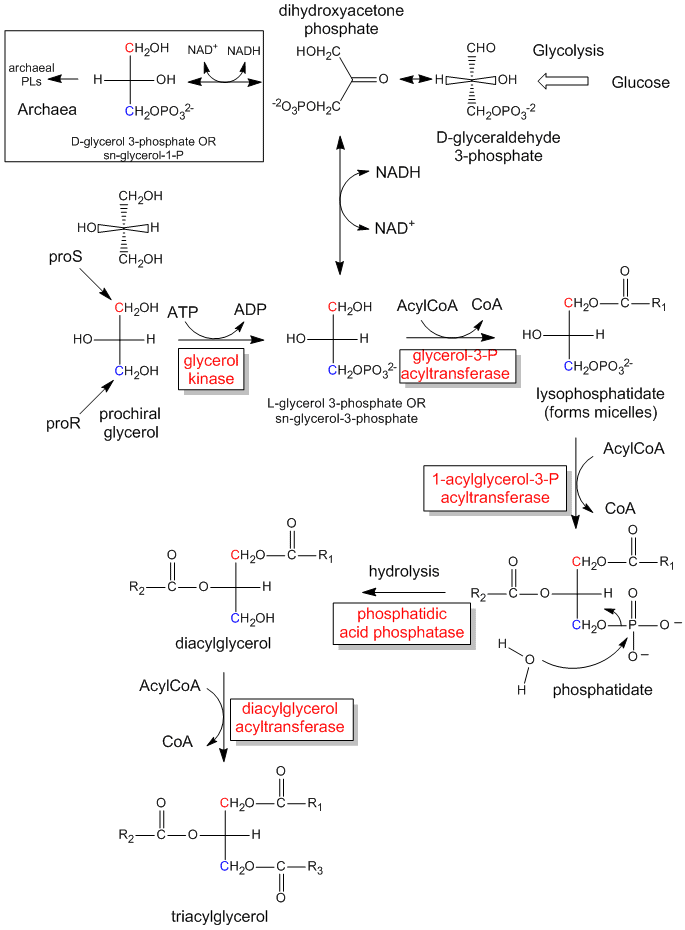
Enzymatická fosforylace prochirálního glycerolu na OH uhlíku proR za vzniku sn-glycerol-3-fosfátu je znázorněna na odkazu níže. Vzhledem k tomu, že jsme byli schopni rozlišit 2 identické substituenty CH2OH jako obsahující buď uhlík proS, nebo proR, může tak učinit i enzym. Enzym dokáže rozlišit identické substituenty na prochirální molekule, pokud prochirální molekula interaguje s enzymem ve třech bodech. Jiný příklad prochirálního systému reaktant/enzym zahrnuje oxidaci prochirální molekuly ethanolu enzymem alkoholdehydrogenázou, při níž se ze dvou H na C2 odstraní pouze proR H. V případě, že se jedná o prochirální molekulu ethanolu, může se jednat o prochirální molekulu. (O tom budeme hovořit později.)
Obrázek: Jak enzym (glycerolkináza) přenáší PO4 z ATP na proR CH2OH glycerolu za vzniku chirálních triacylglycerolů a kyseliny fosfatidové
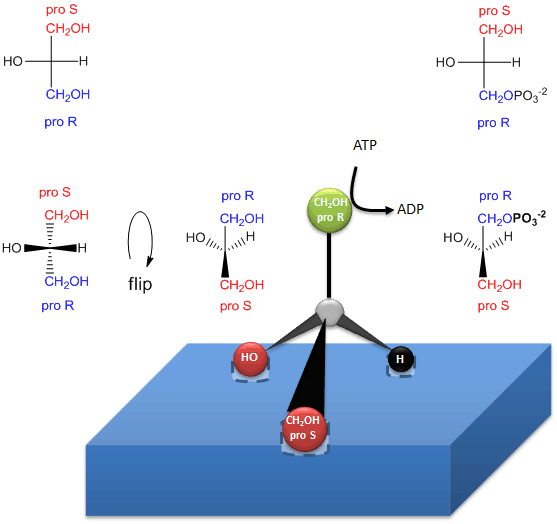
.