Estereoquímica de triacilglicéridos/fosfolípidos
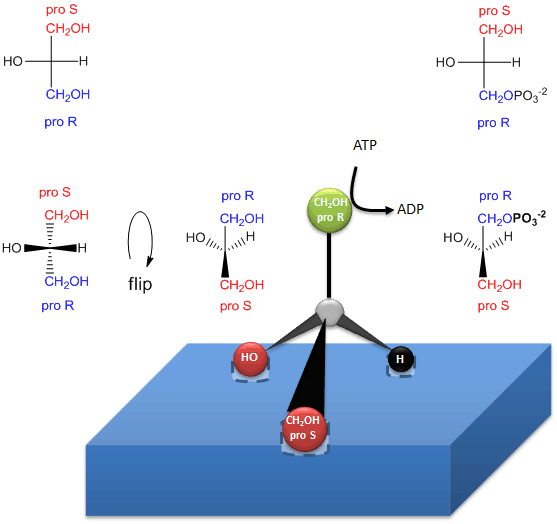
El glicerol es una molécula aciral, ya que C2 tiene dos sustituyentes idénticos, -CH2OH. El glicerol en el cuerpo puede convertirse químicamente en triacilglicéridos y fosfolípidos (PL) que son quirales, y que existen en una forma enantiomérica. ¿Cómo puede ser esto posible si los dos grupos CH2OH del glicerol son idénticos? Resulta que aunque estos grupos son estereoquímicamente equivalentes, podemos diferenciarlos de la siguiente manera. Oriente el glicerol con el OH de C2 apuntando a la izquierda. A continuación, sustituya el OH de C1 por OD, donde D es deuterio. Ahora los dos sustituyentes del alcohol en C1 y C3 no son idénticos y la molécula resultante es quiral. Girando la molécula de forma que el H de C2 apunte hacia atrás, y asignando prioridades a los otros sustituyentes de C2 como sigue OH =1, DOCH2 =2, y CH2OH = 3, se puede ver que la molécula resultante está en la configuración S. Por lo tanto, decimos que C1 es el carbono proS. Igualmente, si sustituimos el OH de C3 por OD, formaremos el enantiómero R. Por lo tanto, C3 es el carbono proR. Esto demuestra que en realidad podemos diferenciar entre los dos sustituyentes CH2OH idénticos. Decimos que el glicerol no es quiral, sino prochiral. (Piensa que el glicerol tiene el potencial de convertirse en quiral modificando uno de los dos sustituyentes idénticos.)
Figura: Glicerol – Una molécula prochiral
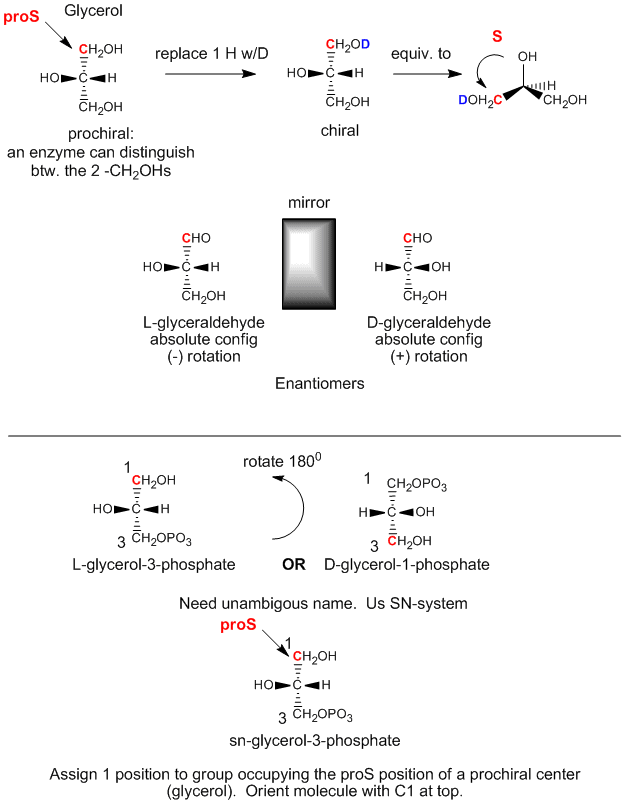
Podemos relacionar la configuación del glicerol arriba, (cuando el OH en C2 está apuntando a la izquierda) con la configuración absoluta del L-gliceraldehído, un azúcar simple (un polihidroxialdehído o cetona), otro derivado 3C del glicerol. Esta molécula es quiral con el OH del C2 (el único carbono quiral) apuntando hacia la izquierda. Es fácil recordar que cualquier azúcar L tiene el OH del último carbono quiral apuntando a la izquierda. El enantiómero (isómero espejo) del L-gliceraldehído es el D-gliceraldehído, en el que el OH de C2 apunta a la derecha. Los bioquímicos utilizan L y D para la estereoquímica de los lípidos, azúcares y aminoácidos, en lugar de la nomenclatura R,S que se utiliza en química orgánica. La designación estereoquímica de todos los azúcares, aminoácidos y glicerolípidos puede determinarse a partir de la configuración absoluta de L y D-gliceraldehído.
El primer paso en la síntesis in vivo (en el cuerpo) de los derivados quirales a partir del glicerol aciral implica la fosforilación del OH en C3 por el ATP (un fosfoanhídrido similar en estructura al anhídrido acético, un excelente agente acetilante) para producir la molécula quiral fosfato de glicerol. Basándonos en la configuración absoluta del L-gliceraldehído, y usando esto para dibujar el glicerol (con el OH de C2 apuntando a la izquierda), podemos ver que la molécula fosforilada puede llamarse L-glicerol-3-fosfato. Sin embargo, al girar esta molécula 180 grados, sin cambiar la estereoquímica de la molécula, no cambiamos la molécula en absoluto, sino que utilizando la nomenclatura D/L anterior, nombraríamos la molécula girada como D-glicerol-1-fosfato. No podemos dar a la misma molécula dos nombres diferentes. De ahí que los bioquímicos hayan desarrollado el sistema de numeración estereoespecífica (sn), que asigna la posición 1 de una molécula prochiral al grupo que ocupa la posición proS. Utilizando esta nomenclatura, podemos ver que la molécula quiral descrita anteriormente, el glicerol-fosfato, puede denominarse inequívocamente sn-glicerol-3-fosfato. El sustituyente hidroxilo en el carbono proR fue fosforilado.
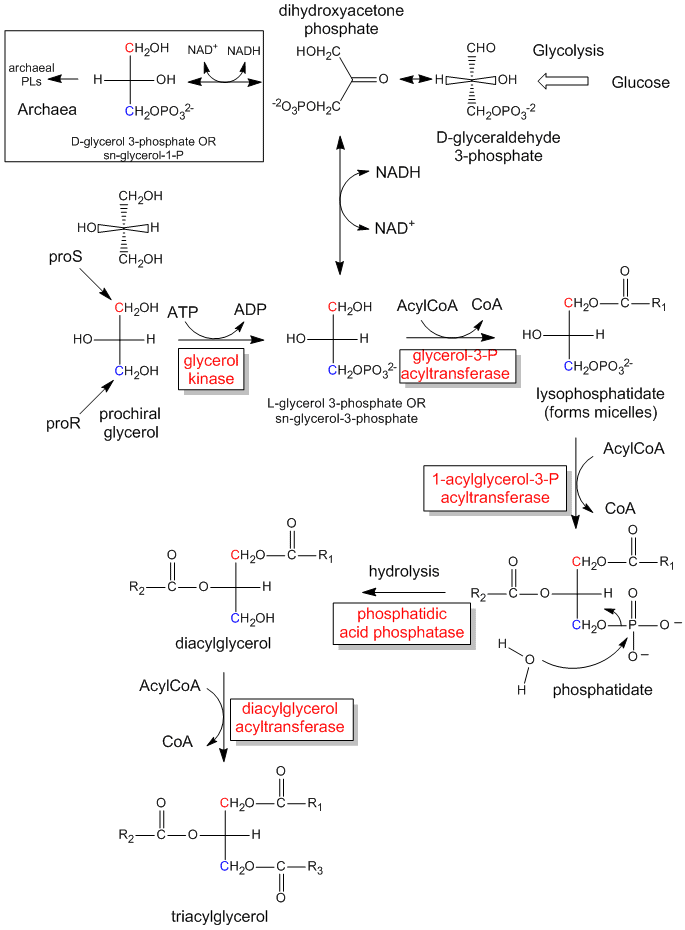
Figura: La síntesis biológica de triacilglicéridos y ácido fosfatídico a partir de glicerol prochiral
La fosforilación enzimática del glicerol prochiral en el OH del carbono proR para formar sn-glicerol-3-fosfato se ilustra en el siguiente enlace. Al igual que hemos sido capaces de diferenciar los 2 sustitutos idénticos CH2OH como conteniendo los carbonos proS o proR, también lo puede hacer la enzima. La enzima puede diferenciar sustituyentes idénticos en una molécula prochiral si la molécula prochiral interactúa con la enzima en tres puntos. Otro ejemplo de sistema reactivo/enzimático prochiral es la oxidación de la molécula prochiral etanol por la enzima alcohol deshidrogenasa, en la que sólo se elimina el H proR de los 2 H de C2. (Discutiremos esto más tarde.)
Figura: Cómo una enzima (glicerol quinasa) transfiere un PO4 del ATP al proR CH2OH del glicerol en la formación de triacilgliceroles quirales y ácido fosfatídico.