Introduktion
En uppskattad glomerulär filtrationshastighet (eGFR) som är lägre än 60 ml/min/1,73 m2 har konstaterats vara förknippad med en ökad risk för dödlighet av alla orsaker och hjärtkärlrelaterad dödlighet i allmänna populationer och högriskpopulationer.1,2 Personer med nedsatt eGFR löper större risk att dö av kardiovaskulära orsaker än av njursvikt.1,3 Förekomsten av eGFR
mL/min/1,73 m2 ökar successivt med åldern och är så hög som 50 % hos personer över 80 år.4,5 Med tanke på den åldrande befolkningen i hela världen väntas njurfunktionen få en allt större inverkan på kardiovaskulära sjukdomar under de kommande åren.
En del studier har rapporterat att sambandet mellan eGFR och dödlighet dämpas med åldern.1,6 Dessutom pågår en debatt om den kliniska betydelsen av måttligt nedsatt njurfunktion (eGFR 45-59 ml/min/1,73 m2) hos personer över 65 år.7,8 Dödligheten visade sig vara betydligt högre vid eGFR 6,9 men endast vid eGFR 4,10-12 Resultaten för kardiovaskulära händelser (CVE) är ännu mer inkonsekventa.12,13 Detta scenario har fått vissa författare att föreslå ett ålderskalibrerat tröskelvärde, dvs. eGFR 8, vilket är intressant på grund av den höga prevalensen av lindrigare minskningar hos äldre personer.
En del av diskrepanserna i resultaten kan bero på skillnader i de metoder som används för att mäta kreatinin, eGFR-skattningsekvationer eller egenskaperna hos de studerade populationerna. Studier i områden med låg förekomst av kranskärlssjukdom (CHD) omfattade dessutom inte personer äldre än 74 år14,15 eller gav inte detaljerad information i olika åldersgrupper.16,17
Syftet med den här studien var att utvärdera det åldersspecifika sambandet mellan eGFR och dödlighet av alla orsaker (ACM) och förekomsten av hjärt-kärlsjukdom hos personer äldre än 60 år i en sydeuropeisk befolkning med låg förekomst av CHD.18
MetoderDesign och studiepopulation
Vi utförde en retrospektiv kohortstudie som inkluderade alla individer födda 1950 eller tidigare som var registrerade på en av 40 primärvårdscentraler med ett centraliserat laboratorium som ingår i Costa de Ponent Primary Care Service i nordöstra Spanien (som betjänar en befolkning på 873 549 individer), och vars kreatinin mättes mellan den 1 januari 2010 och den 31 december 2011. Vi uteslöt patienter med njursjukdom steg 5 (eGFR
Datakällor
Baseline kliniska data hämtades från primärvårdens elektroniska medicinska journaler; för baseline kardiovaskulär sjukdom tog vi även hänsyn till tidigare sjukhusinläggning på grund av kardiovaskulär sjukdom eller revaskulariseringsprocedurer sedan 2005. Vi definierade indexdatum som det datum då den första kreatininmätningen gjordes under inklusionsperioden; baslinjestatus definierades enligt de egenskaper som registrerades mellan 1 år före och 1 månad efter indexdatumet.
Bedömning av renal funktion
Serumkreatininnivåer mättes av ett enda laboratorium med hjälp av den standardiserade Jaffe-kompenserade kinetiska metoden som kan spåras till en isotoputspädningsmassaspektrofotometrireferensmetod. eGFR uppskattades med hjälp av Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) kreatininekvationen19 utan korrigering för ras, som inte var tillgänglig.
Vi klassificerade eGFR i kliniska kategorier enligt KDIGO 2012 Clinical Practice Guideline: 15-29, 30-44, 45-59, 60-89 och 90-119.20
Kovariater
Vi samlade in uppgifter om ålder, kön, rökstatus (aldrig rökare, aktiv rökare och före detta rökare), hyperkolesterolemi (serumkolesterol > 6.4 mmol/L eller statinbehandling), kardiovaskulära riskfaktorer (hypertoni, diabetes mellitus) och tidigare diagnos av kardiovaskulär sjukdom (KOL, cerebrovaskulär sjukdom, perifer artärsjukdom och hjärtsvikt).
Resultat
Data om dödsdatum hämtades från sjukhus- eller administrativa register utan specifikation av orsaken; alla slutpunkter för CVE hämtades från sjukhusjournaler, som omfattar data från alla sjukhus i Katalonien, den nordöstra regionen i Spanien. Den primära ändpunkten var ACM och den sekundära ändpunkten var alla CVE, inklusive CHD (akut hjärtinfarkt , instabil angina pectoris eller angina pectoris ) och stroke (icke-hemorragisk stroke , eller transitorisk ischemisk attack ). Vi analyserade hård CVE (akut hjärtinfarkt och icke-hemorragisk stroke), CHD och stroke separat.
Deltagarna följdes upp från 1 månad efter indexdatumet tills de avled, flyttade till ett annat hälso- och sjukvårdssystem eller till studiens slut (31 december 2013).
Studieprotokollet godkändes av den lokala kliniska forskningsetiska kommittén (IDIAP Jordi Gol P11/43). Vi begärde inget informerat samtycke från deltagarna, eftersom det inte ansågs nödvändigt av den forskningsetiska kommittén.
Statistisk analys
Alla variabler analyserades efter åldersgrupp (60 till 74 år och ≥ 75 år). Vi använde dessa åldersgrupper eftersom de sammanfaller med de flesta aktuella system för uppskattning av risken för hjärt-kärlsjukdom.18 Kontinuerliga variabler beskrivs som medelvärde ± standardavvikelse eller median (icke-normalt fördelade), och kategoriska variabler beskrivs som absoluta och relativa frekvenser. Vi använde Student t-testet och Kruskall-Wallis-testet för att utvärdera skillnader mellan grupper av normalt respektive icke-normalt fördelade kontinuerliga variabler. Vi använde chi-två-testet för kategoriska variabler och testade även om det fanns en linjär trend mellan eGFR-kategorierna. Incidentella händelser beräknades med hjälp av Kaplan-Meier-kurvor vid 3 år.
Inom varje grupp använde vi Cox proportional hazard-modeller för att skatta hazardkvoter (HR) för sambandet mellan eGFR som en kontinuerlig variabel och risken för ACM. Vi verifierade linjäriteten hos eGFR-effekten med hjälp av linjära splines med 4 frihetsgrader i Cox-modellerna. På grund av det lilla antalet individer med eGFR ≥ 120 (n = 14) och den minskade precisionen i skattningarna över denna punkt exkluderades dessa individer från vidare analyser. Vi använde också Cox proportional hazard-modeller för att testa sambandet mellan kategoriskt eGFR, definierat av kliniska avgränsningspunkter enligt KDIGO 2012, och ACM. För alla CVE utfördes analysen med hjälp av överlevnadstekniker med konkurrerande risker (Fine-Gray proportional subdistributional hazards regression) för att ta hänsyn till den möjliga effekten av incident dödlighet på skattningarna.
Antagandet om proportionalitet för faran över tiden bedömdes grafiskt (Schoenfeld residuals) för exponeringsvariabeln (eGFR).
Cox proportional hazard-modeller för både kontinuerligt och kategoriskt eGFR justerades för ålder, kön, rökstatus, hyperkolesterolemi, diabetes mellitus, högt blodtryck och tidigare kardiovaskulär sjukdom (ischemisk hjärtsjukdom, cerebrovaskulär, perifer artärsjukdom eller hjärtsvikt). Modellerna justerades ytterligare för behandlingar med tillgängliga data (statiner och läkemedel för renin-angiotensinsystemet).
Och även om CKD-EPI utvecklades med hjälp av ett urval med ett brett åldersspann (18-97 år) fanns det få individer som var 80 år och äldre. Därför utförde vi en känslighetsanalys med hjälp av Berlin Initiative Study-1 Equation,21 som specifikt utvecklades i ett samhällsbaserat urval av individer ≥ 70 år.
De slutliga modellerna validerades med hjälp av Hosmer-Lemeshow-testet och arean under den mottagaroperativa karakteristiska kurvan. För båda metoderna togs hänsyn till censur och konkurrerande händelser.
Alla statistiska analyser utfördes med hjälp av R version 3.2.3 (R: a language and environment for statistical computing R Foundation for Statistical Computing, Wien, Österrike), med tvåsidiga tester och P
RESULTAT
Vid 138 040 berättigade individer (73.1 % av hela befolkningen ≥ 60 år i detta område), exkluderades 6797 eftersom de var i hemsjukvård, 509 hade njursjukdom i stadium 5 och 501 hade följts upp för Figur 1 i det kompletterande materialet). Det fanns inga kliniskt signifikanta skillnader mellan inkluderade och exkluderade individer när det gäller ålder (P = .374) eller kön (56,1 % respektive 55,1 % kvinnor; P
Medianåldern för hela urvalet var 70 år , och 56,1 % av deltagarna var kvinnor. Medianvärdet för eGFR var 82,42 ; 13,5 % av deltagarna hade ett eGFR Tabell 1), prevalensen av eGFR P
P mL/min/1,73 m2 kategori.
Baslinjekarakteristika för studiepopulationen, Stratifierad efter ålder och kategori för uppskattad glomerulär filtrationshastighet
| ALL | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P totalt | P trend | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- till 74-år-olds | |||||||||
| Patienter | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||
| Ålder, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | |||
| Kön, kvinnor | 47 549 (53,8) | 19 927 (57,7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | |||
| Rökning | |||||||||
| Aldrig rökare | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | |||
| Aktiv rökare | 10 458 (11.8) | 4714 (13.6) | 5189 (10.7) | 422 (9.91) | 107 (10.9) | 26 (12.2) | |||
| Tidigare rökare | 23 446 (26,5) | 8307 (24,0) | 13 452 (27,8) | 1263 (29,7) | 347 (35,2) | 77 (36.2) | |||
| Hyperkolesterolemi | 44 990 (50,9) | 16 710 (48,4) | 24 994 (51,7) | 2529 (59,4) | 613 (62,2) | 144 (67.6) | |||
| Diabetes mellitus | 19 998 (22,6) | 7950 (23,0) | 10 226 (21,1) | 1296 (30,4) | 431 (43.7) | 95 (44.6) | |||
| Hypertoni | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86.9) | |||
| Koronar hjärtsjukdom | 6200 (7.02) | 1825 (5.28) | 3629 (7.51) | 527 (12.4) | 173 (17,5) | 46 (21,6) | |||
| Cerebrovaskulär sjukdom | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12.2) | 36 (16.9) | |||
| PAD | 1686 (1.91) | 510 (1.48) | 906 (1.87) | 171 (4.02) | 76 (7.71) | 23 (10.8) | |||
| Hjärtsvikt | 1891 (2.14) | 453 (1.31) | 1011 (2.09) | 259 (6.08) | 132 (13.4) | 36 (16.9) | |||
| Tidigare CVD* | 12 012 (13.6) | 3628 (10.5) | 6854 (14.2) | 1080 (25.4) | 361 (36.6) | 89 (41.8) | |||
| Statiner | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | |||
| RASD | 40 619 (46,0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | |||
| ≥ 75-år-olds | |||||||||
| Patienter | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| Ålder, y | 79.0 | 77.0 | 79.0 | 81.0 | 82.0 | 83.0 | |||
| Kön, kvinna | 25 482 (60.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | |||
| Rökning | |||||||||
| Aldrig rökare | 30 251 (72.2) | 1202 (68.0) | 20 086 (71.8) | 5836 (72.9) | 2616 (75.8) | 511 (74.7) | |||
| Aktiv rökare | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3.51) | |||
| Tidigare rökare | 9760 (23.3) | 440 (24.9) | 6607 (23.6) | 1844 (23.0) | 720 (20.9) | 149 (21.8) | |||
| Hyperkolesterolemi | 20 705 (49.4) | 798 (45.1) | 13 621 (48.7) | 4115 (51.4) | 1823 (52.9) | 348 (50.9) | |||
| Diabetes mellitus | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36.0) | |||
| Hypertoni | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | |||
| Koronar hjärtsjukdom | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | |||
| Cerebrovaskulär sjukdom | 4567 (10.9) | 171 (9.67) | 2781 (9.94) | 1034 (12.9) | 486 (14.1) | 95 (13.9) | |||
| PAD | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | |||
| Hjärtsvikt | 3275 (7,82) | 90 (5,09) | 1648 (5,89) | 822 (10,3) | 551 (16,0) | 164 (24.0) | |||
| Tidigare CVD* | 11 691 (27,9) | 389 (22,0) | 6900 (24,7) | 2657 (33,2) | 1419 (41.1) | 326 (47,7) | |||
| Statiner | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | |||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72,8) | |||
CVD, kardiovaskulär sjukdom; PAD, perifer artärsjukdom; RASD, läkemedel för renin-angiotensinsystemet.
Om inte annat anges är uppgifterna uttryckta som antal (%) eller median .
Inklusive cerebrovaskulär, PAD och hjärtsvikt.
För att testa eGFR-sambanden i Cox-modellerna definierade vi eGFR = 80 som referens (användes även i CKD-Prognostic Consortiums metaanalys)6 i båda grupperna eftersom detta var medianen för eGFR i populationen, och 60-90 som den kliniska kategorin, eftersom den omfattade det högsta antalet individer och var kliniskt signifikant.
Medianuppföljningen var 38,2 månader . Totalt registrerades 6474 dödsfall, 1573 CHD-händelser och 2236 cerebrovaskulära händelser. Alla utfall var signifikant vanligare i den äldre åldersgruppen (P Tabell 2), med undantag för strokehändelser, som var något mindre vanliga hos individer med ett eGFR på 15 till 29.
Upplevda resultat i studiepopulationen, stratifierade efter ålder och beräknat glomerulärt filtrationsflöde enligt Kaplan-Meier-estimat efter 3 år. Log Rank Test (P Totalt), Linear Trend Wald Test (P Trend)
| Alla | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P totalt | P trend | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- till 74-åringar | |||||||||
| Patienter | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||
| Alla-dödlighet på grund av alla orsaker, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | |||
| Någon CVE, % | 2.09 | 1.51 | 2.26 | 3.78 | 5.60 | 7.94 | |||
| Hård CVE, % | 1.46 | 1.06 | 1.56 | 2.76 | 4.05 | 4.78 | |||
| CHD, % | 0.96 | 0.74 | 1.02 | 1.38 | 2.83 | 4.80 | |||
| Stroke, % | 1.16 | 0.79 | 1.27 | 2.44 | 2.88 | 3.17 | |||
| ≥ 75-årig-olds | |||||||||
| Patienter | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| Dödlighet av alla orsaker, % | 9.88 | 10.5 | 7.89 | 11.7 | 17.8 | 28.5 | |||
| All CVE, % | 4.34 | 3.31 | 3.90 | 4.80 | 6.77 | 8.35 | |||
| Hård CVE, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.93 | |||
| CHD, % | 1.69 | 1.30 | 1.48 | 1.77 | 2.86 | 5.41 | |||
| Stroke, % | 2.74 | 2,13 | 2,49 | 3,17 | 4,00 | 3,34 | |||
CHD, koronar hjärtsjukdom; CVE, kardiovaskulär händelse.
Båda modellerna, för ACM och alla CVE, visade proportionalitet i faran över tiden för exponeringsvariabeln (eGFR; data visas inte).
Sambandet mellan eGFR och risken för ACM följde ett U-format mönster i båda åldersgrupperna, men var mer försvagat i den äldre gruppen (figur 1). Däremot uppvisade HRs för någon CVE en linjär fördelning, med en progressiv ökning av risken från högre eGFR till lägre; detta mönster var likartat i båda åldersgrupperna och även för andra kardiovaskulära endpoints (figur 2 i tilläggsmaterialet). För alla utfall blev HRs hos ≥ 75-åringar signifikanta under eGFR = 60 (figur 1), mellan eGFR = 55 och eGFR = 60 för ACM och vid eGFR ∼ 50 för någon CVE.
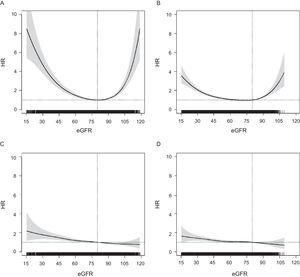
Samband mellan eGFR (kontinuerlig variabel) och risk för ACM hos personer i åldern P-värde
Med avseende på de kliniska kategorierna av eGFR ökade risken för ACM och eventuell CVE successivt i eGFR-kategorierna under 60 till 89 i båda åldersgrupperna (Figur 2). Ökningen av risken för ACM var mycket högre och brantare hos 60-74-åringar än hos ≥ 75-åringar, medan ökningen för någon CVE var mer likartad i båda åldersgrupperna och var på gränsen till signifikant i kategorin eGFR = 45 till 59 för ≥ 75-åringar. Ytterligare justering för behandling med statiner och läkemedel för renin-angiotensinsystemet ändrade inte HR-värdena (data visas inte). Vi fann också att individer med ett eGFR på 90-119 hade en högre risk för dödsfall i den äldsta gruppen och en signifikant lägre risk för någon CVE endast i den yngsta gruppen. Resultaten av modellerna för CHD, stroke och hård CVE liknade dem för all CVE (figur 3 i tilläggsmaterialet). En känslighetsanalys där man använde Berlin Initiative Study-1 Equation för att beräkna eGFR visade inga skillnader (figur 4 i det kompletterande materialet).

Samband mellan eGFR-kategorier och risken för dödlighet av alla orsaker och någon kardiovaskulär händelse, bedömt med hjälp av justerade Cox-proportionalriskmodeller med hänsyn till död som en konkurrerande händelse för kardiovaskulära händelser (övergripande P-värde
De slutliga modellerna uppvisade god kalibrering och diskriminering (figur 5 i tilläggsmaterialet och tabell i tilläggsmaterialet).
DISKUSSION
I en population av individer ≥ 60 år i ett land med låg kardiovaskulär risk ökade risken för ACM och någon CVE gradvis med minskande eGFR, både hos 60-74-åringar och hos ≥ 75-åringar, oberoende av andra riskfaktorer och kardiovaskulär sjukdom. HRs i den äldre åldersgruppen blev dock signifikanta vid lägre eGFR (under eGFR = 60) och var på gränsen till signifikanta för någon CVE i kategorin eGFR = 45-59. Den eGFR-associerade ökningen av dödlighetsrisken var högre hos 60-74-åringar än hos ≥ 75-åringar, men var likartad för CVE-risk. Dessutom följde sambandet mellan eGFR och mortalitet ett U-format mönster, med ökad mortalitet i kategorin 90 till 119 och var högre hos ≥ 75-åringar.
I denna studiepopulation definierade ålderskategorierna 2 väl differentierade grupper, där antalet individer med eGFR
Som väntat var incidensen av kardiovaskulära utfall lägre än vad som rapporterats för äldre individer i länder utanför Medelhavsområdet22 , men var högre än hos yngre individer i vårt område23 . Incidentella cerebrovaskulära händelser var vanligare än koronara händelser, vilket också har beskrivits i studier av äldre personer.22
I överensstämmelse med tidigare rapporter 1,6,14,22,24 observerade vi ett U-format samband mellan eGFR som en kontinuerlig variabel och ACM i båda åldersgrupperna. Anmärkningsvärt är att den överrisk för ACM som observerades i kategorin eGFR = 90 till 119 var högre hos äldre patienter. Denna riskökning skulle kunna återspegla förväxling av muskelförtvining sekundärt till andra sjukdomar som leder till döden; detta är en känd begränsning av kreatininbaserade skattningsformler.19 Däremot fann vi att risken för ny CVE ökade från högre till lägre eGFR. Detta stämmer överens med vissa tidigare rapporter,13,23,25 även om andra har rapporterat ett mindre uttalat U-formigt förhållande för kardiovaskulär dödlighet6,12 och kardiovaskulär sjukdom.15 Således kan incident CVE, som tycks påverkas mindre av begränsningarna i kreatininbaserade skattningsformler, vara ett mer tillförlitligt index för den prognostiska effekten av eGFR på den kardiovaskulära risken.
Det finns motstridiga bevis för den kliniska betydelsen av måttligt nedsatt eGFR hos äldre personer. Få studier har använt den för närvarande rekommenderade ekvationen för att bedöma eGFR-associerad risk och för att jämföra resultaten mellan olika ålderskategorier. Såvitt vi vet är vår studie den första som gör detta i en äldre population som är bosatt i en region med låg incidens av CHD.
För ACM rapporterade CKD-PC-metaanalysen6 en signifikant justerad HR vid eGFR 9 gjorde ett liknande resultat i 60-69, 70-79 och ≥ 80-åringar. Däremot fann Cardiovascular Health Study12 hos åttiotalister endast signifikanta HRs vid eGFR ≤ 43. I Sydeuropa har man funnit att dödligheten ökar hos personer äldre än 65 år med eGFR 16 och hos 60-74-åringar med eGFR 15 Hos 35-74-åringar utan kardiovaskulär sjukdom har man funnit att eGFR är en gränssignifikant prediktor för ACM,14 och med signifikant högre risk vid eGFR = 45-59.
För kardiovaskulär dödlighet var HRs i grupperna 65-74 år och ≥ 75 år signifikanta för eGFR 6 medan Cardiovascular Health Study, som använde kreatininbaserade ekvationer, inte fann något liknande samband hos åttiotalister.12 När det gäller risken för incident CVE fann PREVEND-studien ett samband med eGFR hos personer yngre än 60 år, men inte hos personer ≥ 60 år.13 I Sydeuropa har en ökad risk för kardiovaskulär dödlighet rapporterats vid eGFR 16 och en ökad risk för incident kardiovaskulär sjukdom (marginellt signifikant) vid eGFR 15 och eGFR 23
I vår studie ökade HR:erna för ACM och eventuell CVE stadigt med sjunkande eGFR under 60-89-kategorin, i både grupperna i åldern 60-74 och ≥ 75 år. Liksom i tidigare rapporter var HR-värdena och riskgradienten lägre i den äldsta gruppen,6,9 och vid analys av kontinuerligt eGFR blev HR:erna signifikanta vid eGFR 6
De flesta nuvarande internationella riktlinjer tar hänsyn till alla individer med eGFR 18,20,26 I den aktuella studien hade 20 % av deltagarna i åldrarna ≥ 75 år ett eGFR = 45-59, av vilka 74 % hade ett eGFR ≥ 50. Att betrakta alla äldre personer i kategorin 45-59 som mer riskfyllda skulle således utsätta många personer med ”ingen signifikant ökad risk” för mer aggressiva mål och behandling av kardiovaskulära riskfaktorer. Dessutom är den 11 % ökade relativa risken för KOL-händelser hos 60-74-åringar kanske inte tillräcklig för att betrakta kategorin eGFR = 45-59 som en KOL-riskekvivalent i länder med låg förekomst av KOL.
Styrkor och begränsningar
En stor styrka i vår studie är det mycket stora antalet inkluderade individer och det faktum att de hämtades från ett representativt befolkningsbaserat urval, vilket återspeglar den verkliga situationen för patienter som hanteras inom primärvården. Nästan alla individer i åldern > 60 år (93 %) fick vård inom den katalanska primärvården, och en hög andel hade en kreatininmätning, troligen för att detta är en del av den grundläggande förebyggande hälsokontrollen och rutinmässig uppföljning av andra utbredda kroniska sjukdomar i denna population. Dessutom kalibrerades analyserna för kreatininmätning mot en referensmetod med hjälp av isotoputspädningsmassaspektrofotometri enligt rekommendationerna och utfördes i ett centraliserat laboratorium, vilket ytterligare minskar variabiliteten.
Resultaten av denna studie bör också tolkas mot bakgrund av olika begränsningar. För det första tilldelades eGFR-värden och kategorier på grundval av en enda mätning, vilket är vanligt i epidemiologiska studier av prognoser. På grund av regressionsutspädningsbias kan detta underskatta det verkliga sambandet mellan eGFR och de aktuella resultaten. Låga eGFR-mätningar från ambulanta laboratoriedatabaser har dock visat sig vara relativt stabila hos äldre personer.27 För det andra tog vi inte hänsyn till effekten av vissa faktorer som kan förändra njurfunktionen, t.ex. neoplasier, nefrotoxiska läkemedel, infektioner eller kliniskt interkuranta händelser. Vi tror att dessa effekter minimeras av det stora antalet inkluderade patienter. För det tredje uppskattade vi eGFR från serumkreatininmätningar med hjälp av CKD-EPI-formeln, och vi accepterar begränsningarna med kreatininbaserade skattningsformler, som har större effekt vid högre eGFR.19 Vi korrigerade inte för ras, även om kaukasisk etnicitet dominerar i vår population, särskilt i detta åldersintervall. Dessutom, även om den diagnostiska och prognostiska användningen av CKD-EPI hos äldre personer är föremål för debatt och nya formler har utvecklats, är CKD-EPI för närvarande det rekommenderade tillvägagångssättet20 och används i stor utsträckning inom primärvården. Dessutom gav en känslighetsanalys med eGFR beräknat enligt Berlin Initiative Study-1 Equation liknande resultat. För det fjärde kunde vi inte utvärdera effekten av urinalbumin, eftersom dessa uppgifter inte fanns tillgängliga. eGFR och albumin rekommenderas visserligen båda för att utvärdera CKD, men de har visat sig ha oberoende prognostiska implikationer,1 och de resultat som presenteras här tillför värdefull information om eGFR:s effekt på kardiovaskulär risk och cutoff-nivåer hos äldre personer. För det femte hämtades uppgifterna från elektroniska hälsoregister, och felaktig registrering kan inte uteslutas. Data för kardiovaskulära sjukdomar inom primärvården har visat sig vara av högre kvalitet än för andra sjukdomar och lämpliga för epidemiologiska studier i vår population.28,29 Dödliga CVE utanför sjukhuset ingick inte. Specifikt kan vi ha underskattat strokehändelser hos patienter med avancerad njursjukdom som inte togs in på sjukhus, och dessa var sannolikt allvarligare och med större komorbiditet som resulterade i dödsfall. Mönstret för strokehändelser hos personer med eGFR mellan 45 och 80 liknade mönstret för andra CVE; vi anser inte att detta ogiltigförklarar våra resultat, eftersom vårt fokus låg på mild CKD. För det sjätte justerades modellerna för kardiovaskulära riskfaktorer och sjukdomar samt statinbehandling och läkemedel för renin-angiotensinsystemet, men inte för andra komorbiditeter, läkemedel eller socioekonomiska faktorer som kan påverka förekomsten av CVE. Slutligen hade vi inte tillgång till uppgifter om dödsorsak. Dödlighet av alla orsaker omfattar flera etiologier som inte är relaterade till njurfunktionen utan till andra åldersassocierade sjukdomar, diabetes mellitus eller hjärtsvikt, t.ex. infektioner eller fallolyckor. Även om vi justerade för vissa av dessa komorbiditeter kan vi inte utesluta förekomsten av andra källor till förväxling, såsom svaghet.30
KONKLUSIONER
Slutsatsen är att vi hos personer ≥ 60 år som är bosatta i ett land med låg förekomst av hjärt-kärlsjukdom observerade vi en ökad risk för ACM och någon CVE med sjunkande eGFR i båda grupperna i åldrarna 60 till 74 år och ≥ 75 år. HRs blev dock signifikanta vid eGFR
FUNDING
Detta projekt stöddes av ett forskningsbidrag från Carlos III Institute of Health, Ministry of Economy and Competitiveness (Spanien), beviljat under 2011 års utlysning av Health Strategy Action, inom det nationella forskningsprogrammet orienterat mot samhällsutmaningar. Detta program är en del av den nationella planen för teknisk, vetenskaplig och innovativ forskning 2008-2011, som samfinansieras med medel från Europeiska unionens ERUF (Europeiska regionala utvecklingsfonden) (PI11/02220). Ministeriet för ekonomi och konkurrenskraft genom Carlos III Institute of Health (Red RedIAPP RD12/0007) och ERUF-medel Generalitat de Catalunya genom AGAUR (A for Management of Universities and Research Grants) (2014 SGR 1225) (2014 SGR 902). M. Grau finansierades av ett Miguel Servet-stipendium (Carlos III Institute of Health, Ministeriet för ekonomi och konkurrenskraft, Spanien) (PI12/03287).
INTRESSEKONFLIKTER
L. Pascual-Benito har fått föreläsningsarvoden från Alter. A. Martínez-Castelao har mottagit konsultarvoden/betalda rådgivande nämnder från Boëhringer-Ingelheim och föreläsningsarvoden från och Boëhringer-Ingelheim.
- –
Individer med ett eGFR
mL/min/1,73 m2 löper ökad kardiovaskulär risk. Prevalensen av minskat eGFR ökar progressivt med åldern och är så hög som 50 % hos personer som är äldre än 80 år. Det pågår en debatt om den kliniska betydelsen av de mer frekventa mildare minskningarna (eGFR 45-59 ml/min/1,73 m2) hos äldre personer. Dessutom har studier i områden med låg incidens av CHD inte inkluderat personer som är äldre än 74 år eller inte gett detaljerad information om olika åldersgrupper.VAD LÄGGER DENNA STUDIE TILL?
- –
I en population av individer ≥ 60 år bosatta i ett land med låg kardiovaskulär risk ökade risken för ACM och eventuell CVE gradvis med minskande eGFR, både hos 60-74-åringar och hos ≥ 75-åringar, oberoende av andra riskfaktorer och kardiovaskulära sjukdomar. HR:erna i den äldre åldersgruppen blev dock signifikanta vid eGFR under 60. Den eGFR-associerade ökningen av dödlighetsrisken var högre i gruppen 60-74 år än i gruppen ≥ 75 år, men var likartad för CVE-risken.
.