Abstract
Lågkvalitativ ilmenit kan lakas ut med koncentrerad HCl vid atmosfäriskt tryck och 80oC. Efter filtrering för att avskilja olösligt material värms lösningen som innehåller TiO2+ och Fe2+ för att fällas ut titanhydroxid och återvinna HCl. Titanhydroxiden bränns sedan till syntetisk rutil som innehåller 95+% TiO2 medan FeCl2 utsätts för oxyhydrolys eller fluidisering för att återvinna HCl och Fe2O3. Processen kan naturligtvis tillämpas på högkvalitativ ilmenit. Den kringgår elugnsprocessen som endast gäller för högkvalitativ ilmenit och är överlägsen svavelsyraprocessen som är mycket förorenande. Produkten från denna process kan användas för att framställa vitpigment samt titanmetall.
Nyckelord
HCl-utlakning, Magpeiprocessen, Syntetisk rutil, Oxyhydrolys, Elektrisk ugn, Klorering, Svavelsyraprocess
Introduktion
De viktigaste titanmineralerna är rutil, TiO2, och ilmenit, FeTiO3 (figur 1 och 2). Rutil är lätt att bearbeta till titanmetall eller TiO2-pigment genom klorinering medan ilmenit är mer komplicerat på grund av dess höga järnhalt. Eftersom världsreserverna av titan till 90 % finns i form av ilmenit och endast 10 % i form av rutil, är behandlingen av ilmenit uppenbarligen en viktig fråga inom metallurgin .

Figur 1: Museumsprov av rutil, ~ 90 % TiO2

Figur 2: Museumsprov av ilmenit, FeTiO3 (59.4 % TiO2)
Ilmenitfyndigheter kan vara massiva som i provinsen Quebec (figur 3) eller som svart sand (figur 4) i samband med magnetit, monazit och andra värdefulla mineraler som separeras med fysiska metoder (figur 5). I den första magnetiska separationen används en svag magnet för att separera magnetit medan en högintensiv magnet används i den andra magnetiska separationen för att separera ilmenit.

Figur 3: Ett prov av massiv ilmenit från Quebec

Figur 4: Svart strandsand som i Indien
Främre metoder för pigmentframställning
Svavelsyrametoden
År 1916 inledde Titanium Pigment Corporation i Niagara Falls, New York och Titan Company i Norge samtidigt en kommersiell produktion av detta nya vita pigment. De viktigaste vitpigmenten som användes i färger var då blyvitt, zinkvitt och litopon. I denna metod behandlades ilmenit med koncentrerad H2SO4 vid 110-120°C för att bilda järn- och titanylsulfater:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Reaktionen genomförs i stora betongtankar som är fodrade med syrabeständigt tegel (figur 6), som värms upp genom direktinsprutning av högtrycksånga eller i en pug mill (figur 7) . Den stelnade massa som produceras i reaktorn i slutet av reaktionen avlägsnas sedan från reaktorn genom att lösas upp i vatten eller utspädd syra. Efter att ha avlägsnat den olösliga resterna genom filtrering koncentrerades lösningen som innehöll 120-130 g/L TiO2 och 250-300 g/L FeSO4 under vakuum vid 10°C för att kristallisera FeSO4-7H2O som sedan centrifugerades. Titanoxid fälls sedan ut ur lösningen genom utspädning och utsäde, vilket leder till att det bildas utspädd H2SO4 som ska bortskaffas (figurerna 8 och 9). Den största tillverkaren av pigment i Salvador, Brasilien, använder dock fortfarande denna teknik eftersom avfallsprodukterna hamnar i havet och avlägsnas med tidvattnet.

Figur 5: Förädling av svart sand för att återvinna dess värdefulla komponenter

Figur 6: Stora betongtankar fodrade med syrabeständigt tegel
Figur 7: Uppvärmd pug mill

Figur 8: Framställning av TiO2-pigment genom svavelsyraprocessen

Figur 9: Framställning av TiO2-pigment genom svavelsyraprocessen

: Titanvitt, ~ 100 % TiO2
Klorineringsmetod
DuPont i USA producerar pigmentet sedan 1950 genom direkt klorering av ilmenitmalm, separering av produkter genom fraktionerad destillation och sedan oxidering av TiCl4 (figur 10):

Figur 10: Förenklad Du Pont-process för produktion av pigment från ilmenit
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Problemet med denna process är återvinningen av klor från järnklorid eller marknadsföringen av de stora mängderna av denna biprodukt.
Separation av järn
På grund av föroreningsproblemen i samband med bortskaffande av utspädd svavelsyra och FeSO4 separeras järn i malmen i ett tidigt skede. Detta sker på två sätt: genom elektriska ugnar och genom hydrometallurgiska vägar.
Elektrougnsprocessen
Elektrougnsmetoden utvecklades på 1950-talet . Malmen blandades med en viss mängd antracit, vilket var precis tillräckligt för att reducera järnoxidkomponenten i malmen, och laddades sedan i en elektrisk ugn vid 1 650 °C där järnoxid reduceras till metall medan titan avskiljs som slagg (figur 11). De reaktioner som äger rum under reduktionen är följande:

Figur 11: Elektrisk ugnsprocess för järnseparation
FeTiO3 + C → Fe + CO + TiO2(slagg)
Fe2O3 + 3C → 2Fe + 3CO
Denna metod används av Rio Tinto QIT vid anläggningen i Sorel nära Montreal och vid Richards Bay i Sydafrika. Den används också i Sovjetunionen i Zaporozhye (Ukraina) och i Japan.
Titanslagg består huvudsakligen av järnmagnesiumtitanat, (Fe,Mg)Ti4O10, och en liten mängd silikater; typiska analyser är 72-85 % totalt TiO2. En liten mängd TiO2 reduceras till Ti2O3. Reduktionen av järnoxiderna tas inte till slut så att en del järnoxid lämnas kvar i slaggen för att sänka dess smältpunkt. Smältpunkten för TiO2 1840°C och ilmenit 1435°C.
Slaggen har hög halt av titan och låg halt av järn (figur 12) och är därför att föredra framför ilmenit vid tillverkning av TiO2-pigment eller titanmetall. Slaggen som produceras i Quebec är dock inte lämplig för klorering på grund av dess höga föroreningsgrad – ca 16,6 % jämfört med ca 6 % i andra slagger . Dessa föroreningar kommer inte bara att förbruka onödiga mängder klor utan också att skapa problem med bortskaffandet. Vissa av dessa föroreningar, t.ex, kalcium och magnesium, stör själva kloreringsprocessen som utförs vid 800 °C genom att bilda en smält fas (CaCl2 m.p. 770 °C, MgCl2 m.p. 708 °C).

Figur 12: Mald titanslagg, FeTi4O10 (70-80 % TiO2)
Av dessa skäl användes titanslagg endast för att framställa pigment genom svavelsyraprocessen. Slaggen behandlades på samma sätt som ilmenit med det undantaget att ingen separation av järnsulfat var nödvändig eftersom huvuddelen av järnet redan hade separerats genom reduktion i det tidigare steget (figur 13). Svavelsyrabehandlingen av slaggen hade dock fortfarande problem med bortskaffandet av avfallssyran och därför övergavs den på 1980-talet och ersattes av en ny teknik som bygger på att uppgradera slaggen till 94,5 % TiO2 genom att laka bort de flesta orenheterna med HCl under tryck för att göra den lämplig för klorering.

Figur 13: Lakning av titanslagg för framställning av TiO2-pigment, numera föråldrad
Hydrometallurgisk väg
Den hydrometallurgiska vägen utvecklades på 1960-talet och innebar att man lackerade järn från ilmenit och erhöll en rest som var rik på titan (90-95 % TiO2) och som kallas ”syntetisk rutil” . I ett fall, Altair-processen, erhölls TiO2 av pigmentkvalitet. Alla dessa processer använder en oxyhydrolys för att behandla järnklorid för att få HCl för återvinning och Fe2O3 som biprodukt.
Högtrycksmetoden
I denna metod sönderdelas högkvalitativ ilmenit i autoklaver med 20 % HCl vid 120 °C och 200 kPa; järnet löses upp i form av järnklorid och lämnar ett fast ämne som innehåller cirka 95 % TiO2, som har den kemiska analysen av rutil, varför det kallas syntetisk rutil (figur 14):

Figur 14: Syntetisk rutil
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Lågkvalitativ ilmenit kan inte behandlas med denna metod eftersom alla silikater och olösliga ämnen kommer att förorena produkten. Den syntetiska rutilen behandlas sedan med klor för att framställa TiCl4 från vilket TiO2 eller titanmetall erhålls utan föroreningsproblem. Processen används i USA, England, Japan, Taiwan och Australien. Oxyhydrolys kan genomföras på en mängd olika sätt som beskrivs nedan.
Atmosfärisk process
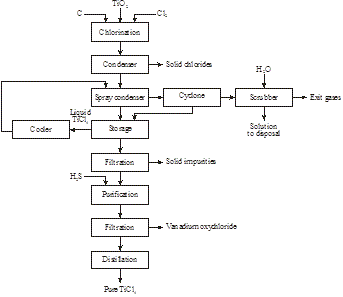
Under 2014 upptäckte Magpie Incorporation i Kanada att lågkvalitativ ilmenit kan lösas upp vid 80 °C med koncentrerad HCl vid atmosfäriskt tryck. Efter filtrering för att avlägsna olösliga ämnen destilleras lösningen för att återvinna HCl och för att hydrolysera titanyljonen till TiO2. Efter filtrering bränns restprodukten för att producera syntetisk rutil (figur 16):

Figur 15: Produktion av syntetisk rutil från ilmenit

Figur 16: Produktion av 98+% TiO2 från lågkvalitativ ilmenit
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Det är uppenbart att den nya urlakningstekniken vid omgivningstryck är överlägsen den gamla uppgraderingen av smältning i elugn och autoklav.
Oxyhydrolys
Fjärroch kloridlösning regenereras till HCl och Fe2O3 genom oxyhydrolys:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Det är samma teknik som används för att behandla saltgurklösning. Två metoder används
Oxyhydrolys i fluidiserad bädd
I en fluidiserad bäddreaktor introduceras järnkloridlösningen på en stor bädd av varm järnoxid där uppvärmningen tillhandahålls av de heta fluidiserande förbränningsgaserna (figur 17). När förbränningsgasen strömmar genom den väl omrörda oxidbädden når den snabbt termisk jämvikt med bädden. Lösningen matas in ovanpå oxidbädden. Den flytande tillförseln fuktar det yttre skiktet av de heta oxidpartiklarna och avdunstar snabbt för att bilda ett lökliknande lager av ny fast oxid ovanpå den befintliga oxiden, vilket ger täta homogena partiklar.

Figur 17: Fluidiserad bäddreaktor för oxyhydrolys av järnklorid
Sprayroaster oxyhydrolys
I denna typ av roster för oxyhydrolys sprutas järnkloridlösningen in i ett tomt cylindriskt kärl, medan den erforderliga energin tillförs genom uppströmsflödet av heta gaser som alstras i bottenbrännarna (figur 18). Sprutrosterna har stora diametrar för att hålla gashastigheterna låga. Om gashastigheten är hög, slås för många partiklar ut med avgaserna, och produktkvaliteten och rosteriets effektivitet sjunker. Avgasen och oxiderna lämnar rostmaskinen i motström vid ca 400-500 °C. De sprayade partiklarnas uppehållstid i reaktionszonen med hög temperatur är mycket kort; därför bör mycket små vätskedroppar, som snabbt kan upphettas, skapas genom atomisering. Den snabba uppvärmningen leder till att det bildas en fast oxidskorpa på ytan av varje droppe. När huvuddelen av droppen värms upp förångas vatteninnehållet och bryter igenom oxidskalet. Därför består den sprayrostade oxiden av mycket fina ”fluffiga”, ihåliga sfärer.

Figur 18: Regenerering av HCl från järnkloridlösning genom oxyhydrolys i sprayroster
Produktion av titan
Metalliskt titan framställs genom klorering av rutil, syntetisk rutil eller titanslagg och därefter reduktion i en metallotermisk reaktor av TiCl4 med magnesium till titan (figurerna 19 och 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
Figur 19: Framställning av TiCl4 från rutil, syntetisk rutil eller titanslagg

Figur 20: Produktion av titan från TiCl4
TiCl4 + Mg → Ti + MgCl2
Magnesiumklorid elektrolyseras sedan för att få tillbaka magnesium och klor för återvinning. Figur 21 visar den metallotermiska reaktorn som avlägsnats från ugnen efter reduktionen från vilken titansvampen återvinns (figur 22).

Figur 21: Metallotermisk reaktor avlägsnas från ugnen

Figur 22: Titansvamp (överst) och MgCl2 (nederst) avlägsnas från reaktorn
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) ”Titanium”, s. 1129-1179 i Handbook of Extractive Metallurgy redigerad av F. Habashi, utgiven av WILEY-VCH, Weinheim, Tyskland.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Kanada.
- DuPont (2007) Broschyr™ Ti-Pure® titandioxid.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgy Extractive Québec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Reprinted in Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. Behandling av titanmalm för produktion av pigment och metaller. Arab Min J 11: 74-84