Abstract
Arsenik stimulerar proliferation vid låga nivåer och hämmar celltillväxt vid höga koncentrationer, vilket visar på en bifasisk effekt på biologiska processer. Den bifasiska effekten kräver att arsenikkoncentrationen måste hållas på ett lämpligt tröskelvärde för att hämma cancerceller under kemoterapi. Apoptosen kan vara en primär mekanism relaterad till arsenikens dubbla egenskaper.
Nyckelord
arsenik, bifasisk effekt, endemisk arsenism, karcinogenes, kemoterapi
Highlights
- Arsenik är en cancerframkallande substans som kan stimulera cellproliferation vid låga nivåer.
- Arsenik är också en cancerundertryckare som hämmar celltillväxt vid höga koncentrationer.
- Arsenikens biologiska roll visar en bifasisk effekt på celltillväxt.
- Apoptos kan vara en potentiell mekanism som är relaterad till arsenikens dubbla egenskaper.
Kommentar
Arsenikelementet (As) är vitt utspritt i naturen, vilket ofta kombineras med syre eller svavel för att bilda föreningar. Arsenik är också nära förknippad med den biologiska processen. Dess patofysiologiska egenskaper är införlivade i följande aspekter: (a) Låg dos arsenik stimulerar cellproliferation och karcinogenes. När natriumarsenit användes för att behandla humana HepG2 cancerceller eller icke-tumör HHI-5 hepatocyter, fann vi att procentandelen celldöd var negativ i inledningsfasen, vilket innebär att lågdosarsenit främjar celltillväxt (figur 1). Arseniten kunde öka cellviabiliteten vid ett smalt intervall av låga koncentrationer. När arsenitnivån ökades för att nå en kritisk punkt började den hämma proliferationen och påskynda celldöd. Det konsekventa resultatet har också rapporterats av andra studier . I olika geologiska regioner överstiger arsenikkoncentrationen i dricksvatten den standardhalt (0,01 mg/L) som rekommenderas av Världshälsoorganisationen. Lokalbefolkningen som dricker det arsenikberikade vattnet lider av endemisk arsenism. Förekomsten av cancer i olika organ (t.ex. hud, lungor, njurar, urinblåsa, lever osv.) i de endemiska områdena är betydligt högre än i icke endemiska områden. Arsenik har identifierats som cancerframkallande för människor av Internationella organet för cancerforskning. b) Höga koncentrationer av arsenik hämmar celltillväxten. I klinisk praxis används ofta arsenikföreningar (dvs. As2O3, As2S2 osv.) för att döda cancerceller under kemoterapi. Dessutom har arsenid varit förstahandsmedicin för behandling av vissa cancerformer som leukemi och solid visceral neoplasm . Ibland används arsenikföreningar i kombination med andra läkemedel för att uppnå bästa terapeutiska effekt. Arseniden inducerar inte bara tumörutveckling utan dödar också cancerceller som basläkemedel vid klinisk behandling. Arsenik har dubbla egenskaper som cancerframkallande och cancerundertryckare. Därför föreslås ett nytt begrepp ”bifasisk effekt” för att beskriva dess dubbelriktade roll i celltillväxten.
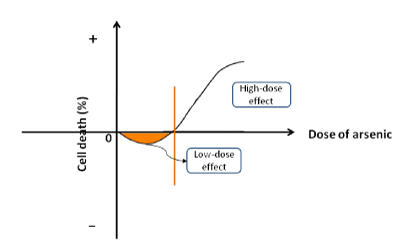
Figur 1. Schematisk bild av den bifasiska effekten. Arsenik stimulerar cellproliferation vid låga doser, medan den påskyndar celldöd vid höga koncentrationer
Vad är exakt den mekanism som ger upphov till arsenikens dubbla egenskaper? För närvarande finns det inget tydligt svar på frågan. Tillgängliga data stöder dock att apoptos spelar en avgörande roll. Apoptos är en genstyrd, energikrävande, självmordsprocess för att upprätthålla vävnadsstrukturen. En balans mellan apoptotisk och antiapoptotisk kompetens avgör inte bara cellens livskraft utan påverkar också direkt vävnadsfunktionen. Hittills har apoptos betraktats som den primära mekanismen för att koppla samman karcinogenes och cancerbekämpning. Hämmare av apoptosproteiner (IAP) har en kraftfull funktion när det gäller att reglera cellöverlevnad och kontrollera apoptoskaskaden. Dessutom moduleras uttrycket av IAPs av flera kärnfaktorer, t.ex. NF-kappa B, FoxA2, C/EBP-beta och så vidare . Förhållandet mellan arsenik och apoptos förtjänar en noggrann undersökning. Vi behöver fler bevis för att visa att a) låga doser arsenik hämmar apoptos och stimulerar cellproliferation. Det är välkänt att karcinogenesen måste övervinna apoptosens motståndskraft, b) höga doser arsenik utlöser apoptos och dödar cancerceller. Den centrala strategin för cancerbehandling är att framkalla apoptos hos cancerceller. En rimlig hypotes är att arsenik hämmar apoptos vid låga koncentrationer, medan den främjar apoptos vid höga koncentrationer. Det spekuleras också i att IAP och deras regleringsnätverk kan vara ansvariga för arsenidens dubbla egenskaper.
En utforskning av den bifasiska effekten av arsenik (arsenid) har särskild betydelse för den kliniska behandlingen av cancer. När arsenikföreningen administreras tillsammans med andra läkemedel minskas ofta dosen av arsenikföreningarna. På grund av arsenikens dubbla egenskaper bör vi utvärdera arsenikföreningens medicinska värde när vi tar läkemedel i kombination. För närvarande måste den lokala koncentrationen av arsenid hållas på en specifik nivå för att inducera apoptos av cancerceller. Annars kan arseniden främja spridningen av cancerceller. Det finns ingen terapeutisk effekt, till och med ett motsatt resultat. Därför måste vi överväga arsenidens dubbelriktade respons, särskilt i kombination med andra läkemedel. Vilket är det exakta tröskelvärdet för att arsenid ska hämma tumören? Hur ska arseniden administreras för att nå tröskelkoncentrationen och hålla den konstant? Vilka biomarkörer är rimliga för att övervaka koncentrationen av arsenid i blodet? Hittills har det inte funnits några svar på ovanstående frågor. Arsenikens biologiska egenskaper ger också upphov till nya frågor inom toxikologin. I den traditionella definitionen av toxikologi anses det i allmänhet att döda celler eller öka dödshastigheten som ett toxikologiskt beteende. Att öka spridningen av cancerceller är emellertid också giftigt för kroppen. Så beteendet hos arsenik i låga doser är en annan aspekt av toxikologi. Kanske kan det definieras som omvänd toxikologi eller omvänd toxikologi. För närvarande arbetar vi med molekylära markörer som kan uppskatta koncentrationen av arsenid i blodet och utvärdera dess terapeutiska effekt. Leukemi och solida tumörer kan kräva olika koncentrationer av arsenikläkemedel (4). Kliniska prövningar i stora prover behövs för att testa arsenidens verkliga roll i behandlingen av olika cancerformer. Dessutom är kvantifiering av cellernas funktionella tillstånd det aktuella fokuset.
Sammanfattningsvis har arsenik en bifasisk effekt på celltillväxt, vilket manifesteras av proliferation vid låga koncentrationer och hämning vid höga koncentrationer. På grund av den bifasiska effekten måste ett tröskelvärde för arsenikkoncentrationen upprätthållas för att döda cancerceller under cancerbehandling. Annars kan arseniden stimulera spridningen av cancerceller, vilket ger en omvänd effekt. Preliminära studier visar att den antiapoptotiska IAPs-familjen och dess regleringsnätverk spelar en viktig roll i arsenikens biologi. Apoptos kan vara en väsentlig mekanism relaterad till arsenikens dubbla egenskaper.
Intresseförklaring
Författarna har inget att avslöja.
Acknowledgments
Detta arbete stöddes av ”The National Natural Science Foundation of China”, projektnummer 81773367. Vi tackar professor Yang Jianbos förslag och råd vid utarbetandet av manuskriptet.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells. J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with inorganic arsenic exposure from drinking water. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lung-, blås- och njurcancerdödlighet 40 år efter minskad arsenikexponering. Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Mak V, Lin SY, et al. (2018) Long-term outcome of relapsed acute promyelocytic leukemia treated with oral arsenic trioxide-based reinduction and maintenance regimens: En 15-årig prospektiv studie. Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP-antagonister inducerar autoubiquitinering av c-IAPs, NF-kappaB-aktivering och TNFalpha-beroende apoptos. Cell 131: 669-681.