Innehåll
- 1 Funktion
- 2 Mekanism för sträng-överföring av hämmande verkan
- 3 HIV och aids
- 4 Strukturens inverkan
- 5 PFV Intasomkristallisering
- 5.1 Kristalliseringsteknik
- 5.2 Kristallografisk och förädlingsstatistik
- 6 Övergripande arkitektur & Komponenter
- 6.1 Struktur
- 6.2 Interaktioner mellan integrase och DNA
- 6.3 Aktiv plats
- 7 Integrase-hämmare
- 7.1 Ytterligare resurser
- 8 3D-strukturer av retroviral integrase
Funktion
Retroviral integrase är ett essentiellt retroviralt enzym som binder till viralt DNA och infogar det i en värdcellskromosom. Det omvänt transkriberade cDNA av humant immunbristvirus typ 1 (HIV-1) infogas i värdcellens arvsmassa för att öka patogenens fitness och virulens. Integrase produceras av en klass av retrovirus (som hiv) och används av viruset för att införliva sitt genetiska material i värdcellens DNA. Värdcellens maskineri producerar sedan mRNA och sedan protein från det införlivade genetiska materialet och replikerar på så sätt viruset. Även om flera integrashämmande läkemedel har undersökts, har man ännu inte klarlagt den mekanism som är ansvarig för den hämmande effekten av strängöverföringen. Hare el al (2010) fastställde dock de strukturella beståndsdelarna av retroviral integration. Ytterligare belysning av den fullständiga strukturen för retroviral integrase och dess tillämpning för att reglera funktionella och enzymatiska aktiviteter kan potentiellt göra det möjligt för forskare att fördröja utvecklingen av retrovirala sjukdomar. Dessutom kan studiet av hiv-1-integration leda till en lovande ny måltavla och bidra till att skapa farmakofore-modeller för antiviral terapi.
HIV Integrase-hämmare: Raltegravir, som marknadsförs som Isentress, är för närvarande godkänt som en terapeutisk hivintegrashämmare. Det godkändes den 12 oktober 2007. för fagintegrase se fagintegrase.
Mekanism för strängöverföringshämmande actio
Caption
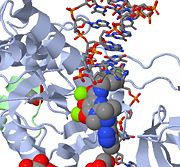
Ovanför är en JMOL-bild av MK-0518 som blockerar virus-DNA:s 3′-ända från att binda den aktiva platsen. Lägg märke till de metallkeleaterande syreatomerna i MK-0518 som interagerar med de magnesiumkatjoner som finns i den aktiva platsen.
HIV integrase typ 1 är ett relativt nytt och nytt mål för hämmare. År 2007 godkändes den första hiv-1 integrashämmaren, Raltegravir, av FDA för användning mot hiv-1 som kombinationsbehandling . Hämmare av strängöverföring fungerar genom att förhindra den samordnade integrationen av virus-DNA i värdkromosomen. Efter virusets inträde i värdcellen omvandlar det omvända transkriptaset det virala ssRNA till dsDNA. Vid denna tidpunkt bildar integrase ett komplex med det virala DNA:t, vilket skapar preintegrationskomplexet (intasome). Pre-integrationskomplexet chaperoneras sedan in i kärnan, där två nukleotider skärs bort från 3′-ändan. Därefter integreras DNA:t kovalent i värd-DNA:t. Strängöverföringshämmare avbryter denna process och förhindrar att virus-DNA integreras i värdkromosomen. Strängöverföringshämmare verkar genom att engagera de metalljonkofaktorer som finns på den aktiva platsen för retroviral integrase. De metallkeleaterande syreatomer som finns i inhibitorerna interagerar direkt med metallkofaktorerna, medan halobenzylgruppen passar in i den ficka som skapats av det förskjutna 3′-virala DNA:t i den aktiva platsen.
Hiv och aids

Under 2010 har mer än 25 miljoner människor dött av aids, och man uppskattar att cirka 33 miljoner människor lever med hiv.
I dagsläget har mer än 25 miljoner människor dött av aids, och man uppskattar att cirka 33 miljoner människor lever med hiv idag. För retrovirala integrashämmare se Raltegravir och Retroviral Integrase Inhibitor Pharmacokinetics.
Impact of Structure
Tredimensionella strukturer för vissa värdcellsproteiner som är kritiska för att förstå mekanismen för hivinfektion och virulens har framkommit genom röntgenkristallografiska analyser. Strukturer för hivproteas och integrase är bland de högst rankade strukturerna som har bidragit till att rädda många liv och ökat livskvaliteten för många hiv-sjuka individer. Den implementeras i strukturbaserad läkemedelsdesign för att utveckla proteashämmare och integrashämmare och används som en viktig komponent i högaktiv antiretroviral terapi (HAART).
Men även om befintliga antiretrovirala medel förbättrar livskvaliteten samt förlänger livet för många patienter, lyckas det inte utrota sjukdomen. Studier av integrashämmare visar att kombinationen med andra antiretrovirala läkemedel minskar de virala anpassningarna och kan ha potential att användas som räddningsterapi för patienter som har förvärvat resistens mot andra läkemedel. För mer information se
- Aids före proteashämmare & HIV-proteashämmare: A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
För att efterlikna de virala DNA-ändarna av hiv-1 använde Hare et al (2010) lösliga och fullt funktionella prototype foamy virus (PFV) intasome-preparat, erhållna med hjälp av rekombinant PFV-integras och dubbelsträngade oligonukleotider.
Den anmärkningsvärda stabiliteten hos integrase-DNA-komplexen fastställdes genom att observera in vitro-strängöverföringsreaktionerna, som klassificerades i tre modus av deproteineringsmigration: (1) enstaka samordnade händelser: linjäriserad målplasmid, (2) flera samordnade händelser: smet, (3) händelser på halva platsen: öppet cirkulärt DNA. Ytterligare karakterisering av PFV-intasomen visade också på strukturell substans som innebar starka protein-protein- och protein-DNA-interaktioner trots långvarig inkubation under förhållanden med hög jonstyrka. Omfattande kristalliseringsanalyser gav upphov till en livskraftig kristallkonfiguration som diffrakterade röntgenstrålar med en upplösning på 2,9 Angström. En tredimensionell struktur fastställdes slutligen. Den asymmetriska enheten innehöll en enda integrase-dimer med en stabilt bunden viral DNA-molekyl och ett par integrase-dimerer som är associerade med symmetrin och som bildade en avlång tetramer. Dimergränssnittet stabiliseras av intermolekylära interaktioner mellan aminoterminaler och katalytiska kärndomäner (inre underenhet-yttre underenhet). Den övergripande formen av den avlånga tetramern är unik även om den har likheter med tidigare rapporterade HIV-1 integrasekomplex.
Kristalliseringsteknik
Protein-DNA-komplexen bildades med hjälp av PFV IN i full längd av vildtypen PFV IN och syntetiskt dsDNA som modellerade virusändan.
Intasomen kristalliserades med hjälp av ångdroppshängande diffusionsmetod. Reservoarlösningen bestod av 1,35 M ammoniumsulfat, 25 % (v/v) glycerol, 4,8 % (v/v) 1,6-hexandiol och 50 mM 2-(N-morfolino)etansulfonsyra (MES) vid pH 6,5. Protein-DNA-kristallerna blötlades också i närvaro av MK0518, GS9137, Mg(II) och/eller Mn(II). Kristallstrukturen löstes med hjälp av molekylär ersättning.
Kristallografisk och förädlingsstatistik
Hare et al (2010) har publicerat data om sju kristallstrukturer. Dessa data omfattar PFV IN-komplexet (apo-form) och sex ytterligare strukturer, inklusive komplexet bundet till Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137 och Mn/GS9137. Alla sju strukturerna tillhör rymdgruppen P41212. De har förfinats till en upplösning på mellan 2,85 och 3,25 Å.
Övergripande arkitektur Komponenter
Struktur
Den övergripande strukturen för det sammansatta PFV intasomen är en tetramermodell som bygger på två domänstrukturer med ett gränssnitt för dimer-dimer. Tidigare intasommodeller skildrar en liknande men mer flexibel struktur medan PFV-intasomen har visat sig vara starkt begränsad. Med hjälp av homologimodellering föreslår Hare et al (2010) att kortare interdomänlänkare kan vara en faktor för flexibilitet, särskilt i HIV-1 integrase. De inre underenheterna i tetramern är involverade i den övergripande tetrameriseringen och den virala DNA-bindningen. De katalytiska kärndomänerna i de yttre subenheterna kan fungera som stöd, men eftersom de amino- och karboxyterminala domänerna inte är upplösta i elektrontäthetskartor är deras funktion inte entydig. Den katalytiska kärndomänen och den karboxyterminala domänförbindaren antar en förlängd konformation under större delen av sin längd och är belägen parallellt med den inre underenhetens aminoterminala domän och katalytiska kärndomänförbindare. Interdomänlänkarna Interdomänlänkarna (CCD-CTD-länkarna och NTD-CCD-länkarna) binder ihop intasomens båda halvor, och strukturen stabiliseras ytterligare av ett par karboxyterminala domäner som interagerar med båda de inre katalytiska kärndomänerna.
Integrase och DNA-interaktioner
Starka protein-DNA-interaktioner finns inom de terminala sex nukleotiderna. Varje karboxyterminal domän interagerar med fosfodiesterryggen i båda de virala DNA-molekylerna. Dessutom interagerar den aminoterminala domänens förlängningsdomän och den aminoterminala domänen med det virala DNA:t vid den aktiva platsen för den motsatta katalytiska kärndomänen.
Aktiva platsen
Aktiva platsens karboxylater är sidokedjor av Asp 128, Asp 185, Glu 221.
En zinkatom vardera är belägen nära de aktiva platserna.
- .
- .
Integrashämmare
| Namn | Varumärke | Företag | Patent | Anteckningar |
| Raltegravir | Isentress | Merck & Co. | – | även känt som MK-0518. Isopropyl- och metyl-oxadiazol i MK-0518 är involverade i hydrofoba och staplingsinteraktioner med sidokedjor av Pro 214 och Tyr 212 för att stabilisera detta läkemedel inom den aktiva platsen för PFV intasome. Detta sätt att interagera med läkemedlet orsakar förskjutning av den reaktiva 3′-virala DNA-änden från PFV-intasomens aktiva plats. Efter bindning av MK-0518 till den aktiva platsen förflyttar sig den reaktiva 3′-hydroxylgruppen från PFV-intasomens aktiva plats med mer än 6 Angström. Raltegravir godkändes av FDA den 12 oktober 2007 för användning tillsammans med andra anti-HIV-medel vid behandling av hiv-infektion hos vuxna. Det är den första integrashämmaren som godkänts av FDA. |
| Elvitegravir | – | Gilead Science | – | GS-9137 interagerar med Pro 214 i PFV intasome genom sin kinolonbas och isopropylgrupp. I experimentella stadier; har samma kärnstruktur som kinolonantibiotika. Fas II-studier av elvitegravir hos personer som har behandlingserfarenhet har avslutats. Fas III-studier hos patienter med behandlingserfarenhet pågår. En fas II-studie av elvitegravir hos personer som aldrig har fått antiretroviral behandling pågår. I denna studie kommer man också att utvärdera ett boostingmedel i stället för Norvir, som för närvarande kallas GS9350. Elvitegravir är lovande för hiv-positiva patienter som tidigare har tagit andra antihivläkemedel. |
| MK-2048 | – | Merck & Co. | – | En andra generationens integrashämmare, avsedd att användas mot hiv-infektion. Den är överlägsen den första tillgängliga integrashämmaren, raltegravir, genom att den hämmar hiv-enzymet integrase 4 gånger längre. Den undersöks för användning som en del av preexpositionsprofylax (PrEP). |
Se även Retroviral integrashämmare Farmakokinetik.