Immunofluorescens (IF) är en vanlig morfologisk metod som används för att bestämma fördelningen av subcellulära komponenter. Antikroppar som är konjugerade med fluorescerande färgämnen krävs i IF-analysen. Antikroppen känner specifikt igen antigenet genom att binda till målets epitop, och fluoroforen kommer att detekteras i ett fluorescerande mikroskop. Därför kan subcellulära komponenter visualiseras i en mörk bakgrund. IF kan också användas som en alternativ semikvantitativ analysmetod för att övervaka uttrycket av det aktuella ämnet.
Det finns tre typer av IF: direkt IF, indirekt IF och kombinerad IF.
Direkt IF använder en enda primär antikropp som är konjugerad med fluorescerande färgämne.
Indirekt IF använder två antikroppar för färgning: en primär antikropp som specifikt binder till epitopen och en matchad sekundär antikropp som är konjugerad med ett fluorescerande färgämne.
Kombinerad IF är en kombination av direkt och indirekt IF-färgning.
Tabell 1. Jämförelse av direkt, indirekt och kombinerad IF.
| IF-typ | Direkt | Indirekt | Kombinerad |
|---|---|---|---|
| Skematiskt schema | 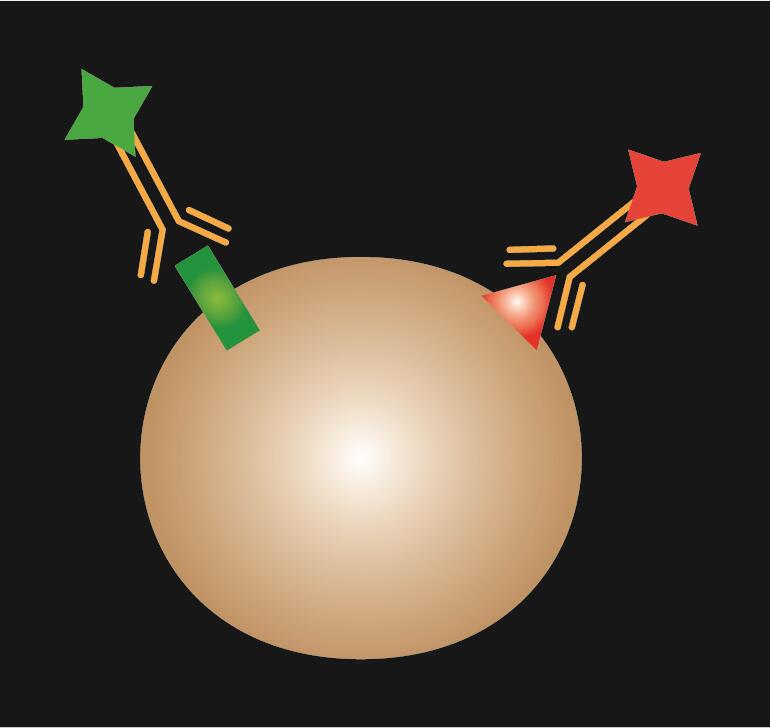 |
. 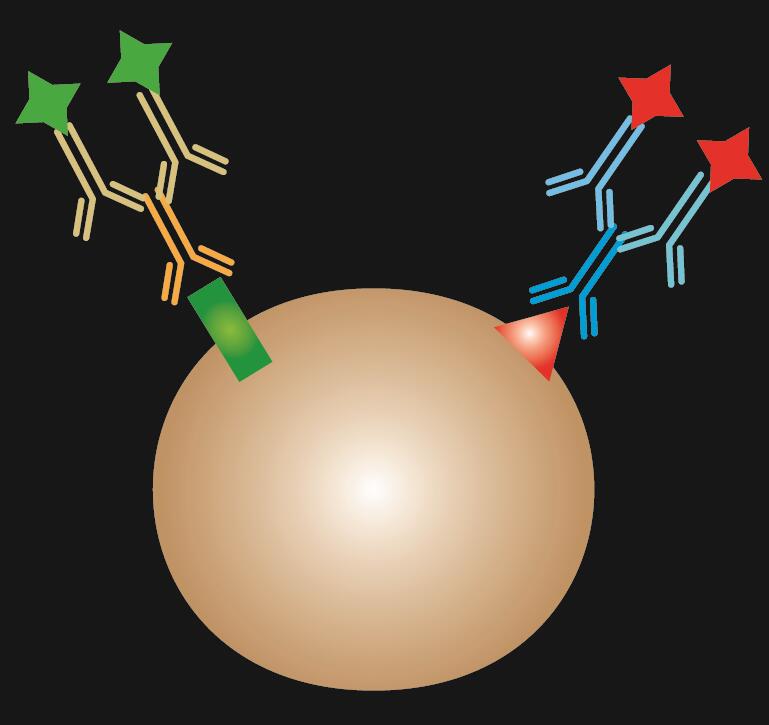 |
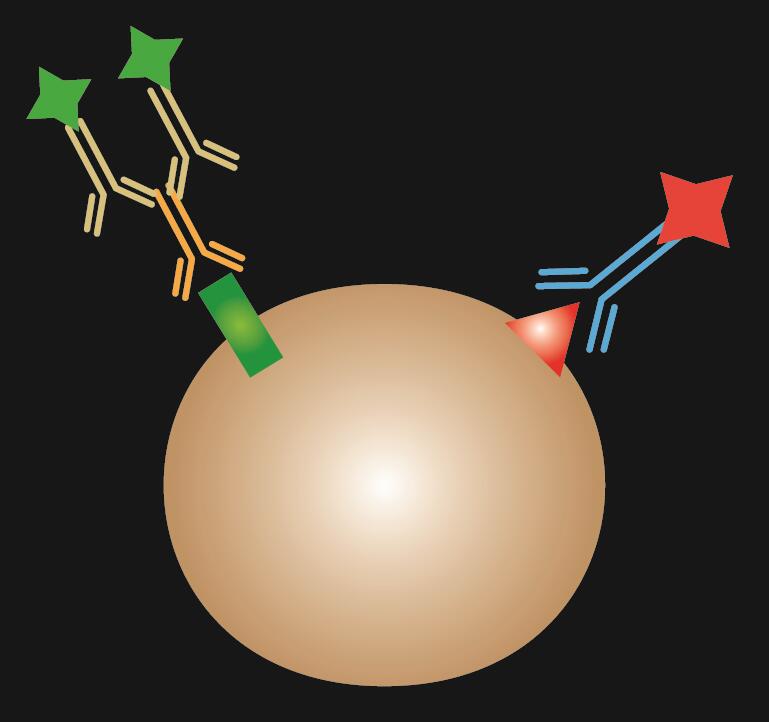 |
| Fördelar |
|
|
|
| Nackdelar |
|
|
|
En av de tre typerna av IF, är den indirekta IF-metoden mest populär.
IF-metoden kan användas på vävnadssektioner, odlade cellinjer och enskilda celler. Processen för IF liknar immunohistokemi (IHC).
- Provinsamling och fixering
Proverna måste fixeras snabbt efter avlägsnande av vävnad, och det är bättre att utföra prefixering genom hjärtinfusion med 4 % formaldehyd eller paraformaldehyd i små djur som gnagare. Det rekommenderas att vävnaderna inte är tjockare än 10 mm och att fixeringsmedlets volym bör vara minst 15-20 gånger större än vävnadens volym. Fixering är mycket viktigt för att bevara cellens morfologi och struktur samt antigenets integritet. Fixeringslösningar måste därför väljas noggrant beroende på olika antigener och vävnadsprover.
Tabell 2. Fixeringsstrategi för partiella antigener.
| Antigen | Fixeringslösning | Fixeringsvillkor | |
|---|---|---|---|
| Mest protein | 95~100%. alkohol 4% paraformaldehyd |
3~10 min vid 37℃ 4~24 timmar vid 4℃ |
|
| Enzym | Aceton | 15 min vid RT | |
| Hormon | 95% alkohol plus 1~5% isättika | 30 min vid 4℃ | |
| Immunglobulin | 95% alkohol Kol tetraklorid |
10 min vid 37℃ och sedan 15 min vid 4℃ | |
| Fiberprotein | 95% alkohol plus 1~5% isättiksyra | 10 min vid 37℃ sedan 15 min vid 4℃ | |
| Virus | Aceton Kolvtetraklorid Alkohol |
5~10 min vid RT sedan 30~60 min vid 4℃ | |
| Polysackarid och bakterier | Aceton 10% formaldehyd Metanol |
3~10 min vid RT och sedan 30~60 min vid 4℃ | |
| Lipoid | 10% formaldehyd | 3~10 min vid RT | |
| Kulturerade celler | Varmt 4 % paraformaldehyd | 15~20 min vid RT |
- Dehydrering och inbäddning
Dehydrering krävs vid framställning av vävnadssnitt av följande skäl:
1. Paraffinsnitt: Paraffin är omblandbart med vatten.
2. Frysta snitt: Fryst-avtinade iskristaller skulle förstöra cellernas morfologi.
Dehydrering utförs alltid genom att vävnaden sänks ner i en allvarlig etanol- eller sackaroslösning med stigande gradient.
Därefter kan vävnadsproverna inbäddas genom att man tillsätter smält paraffinvax för paraffinsektioner, medan OCT-preparat tillsätts för frysta sektioner. Detta steg ger lämplig hårdhet för mjuka vävnadsprover och gör att vävnaden lätt kan skäras.
- Sektion och färgning
Inbäddade vävnader kan sektioneras till tunna skivor med mikrotom eller frysmikrotom. Skivornas tjocklek bör bestämmas i enlighet med celldiametern och syftet med IF-analysen. Tunnare skivor (≤10 μm) föreslås att monteras direkt på självhäftande objektglas före färgning, eftersom de är lätta att stavas i de många tvättstegen. Tjockare skivor (10-30 μm) ger bättre bilder om man använder metoden med fritt flytande skivor, eftersom den primära antikroppen kan tränga igenom skivans båda sidor. De fritt flytande sektionerna monteras på objektglas efter färgning. Det är svårt att utföra fria flytande sektioner av små vävnader, t.ex. musens dorsala gangliarot (DRG), och det är lätt att förlora provet. Därför rekommenderas stick section-metoden för vissa små vävnadsprover. Färgningsstegen bör utföras i mörker när en antikropp konjugerad med fluorescerande färgämne är inblandad.
Att nå ut till IF-protokoll:
- Stick section
- Free floating section
- Odlade celler
- Avbildning och analys
Positiv signalering virtualiseras under ett fluorescerande mikroskop i en mörk bakgrund. Den intressanta platsen bestäms vanligen genom samfärgning av ett protein vars plats är känd. Alternativt kan mängden positiva celler eller fluorescensintensiteten för positiv signalering mätas för kvantitativ analys. Till exempel hänvisar en starkare fluorescensintensitet till ett relativt högt uttryck av målproteinet.
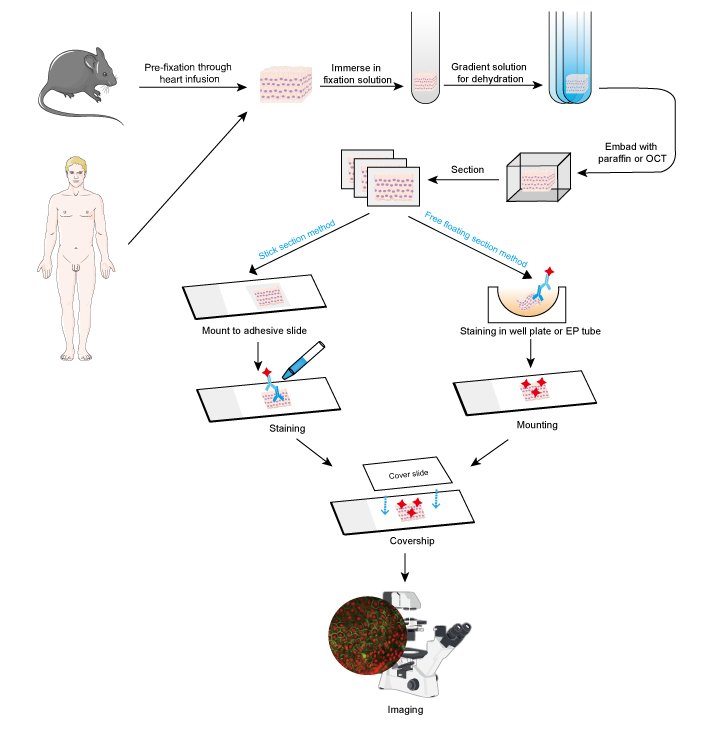
Figur 1. Arbetsflöde för IF på vävnadssnitt.
IF och IHC är båda kraftfulla metoder för morfologisk analys med viktiga diagnostiska och prognostiska tillämpningar. Flera skillnader måste beaktas i din forskning:
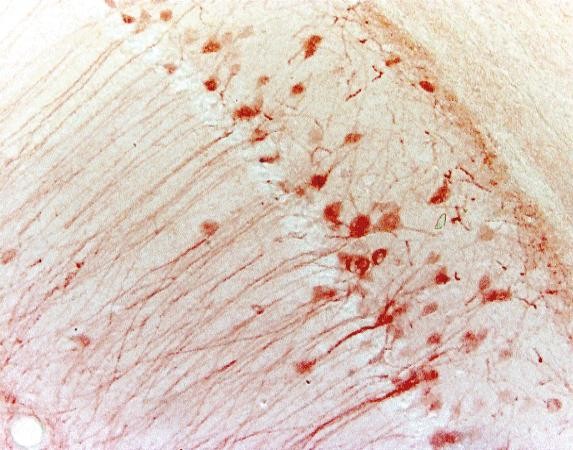
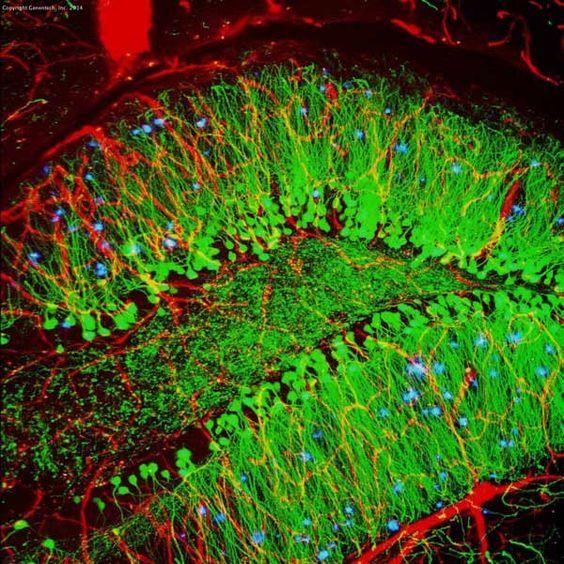
Tabell 3. Jämförelse mellan IHC och IF
| IHC | IF | |
|---|---|---|
| Märkningsmetod | Kromogena | Fluorescerande |
| Behandlingssteg | Mer som substrat krävs | Mindre |
| Bild |
|
|
| Mikroskop | Ljusmikroskop | Fluorescerande mikroskop |
| Stabilitet | Stabil för år | Mindre stabil på grund av fotoblekning |
| Exempel (musens hippocampus) |
 |
 |