Patient med subepitelskada i magsäcken
Martín Gómez Zuleta, MD (1)
(1) Gastroenterologiavdelningen, avdelningen för internmedicin, Colombias nationella universitet. Sjukhus Tunal. Bogotá, Colombia..
Received: 05-10-10-10 Accepterad: 25-11-10
Abstract
Och även om subepiteliella lesioner sällan påträffas i övre mag-tarmkanalen kan de orsaka osäkerhet i diagnostiskt tillvägagångssätt och behandling. Endosonografiska fynd beskrivs och aktuella rekommendationer granskas mot bakgrund av ett fall för att möjliggöra ett rationellt tillvägagångssätt för dessa lesioner.
Nyckelord
Submucosala tumörer, endoskopiskt ultraljud, GIST.
Kliniskt fall
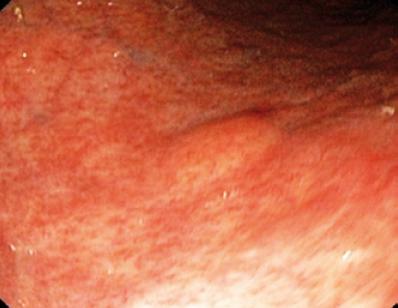
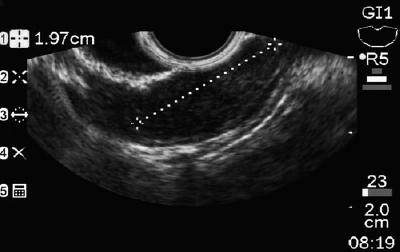
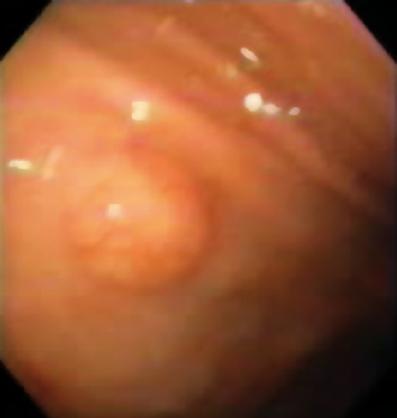
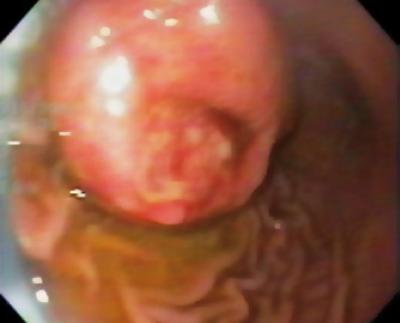
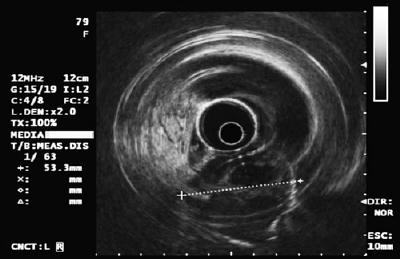
En 50-årig man med dyspepsi skickades till en övre endoskopi där man hittade en 9 mm stor subepitelial lesion i magsäckskorpus (Figur 1). Biopsi av den överliggande slemhinnan var normal. Patienten hade ingen tidigare sjukdomshistoria och hans fysiska undersökning var normal.
Figur 1. Gastrisk subepitelial lesion.
Initialt tillvägagångssätt:
En massa eller utskjutning i lumen i ett organ som täcks av normalt epitel kallas för en subepitelisk lesion. Det är ovanliga lesioner som förväntas förekomma vid 1 av 300 endoskopier (1, 2). Orsakerna kan vara intrinsiska benigna eller maligna lesioner i väggen i mag-tarmkanalen eller extrinsisk kompression orsakad av normala eller patologiska intilliggande strukturer (3).
Dessa lesioner upptäcks vanligen incidentellt och har ofta inget samband med symtom, vilket var fallet med vår patient. Detta kan få läkaren att tvivla på om hon eller han ska följa upp med mer specifik utredning och utföra ytterligare (4). Enligt vår mening bör alla dessa lesioner utvärderas för att klargöra deras ursprung. Vi bör alltid ta en biopsi av den överliggande slemhinnan (om vi inte misstänker ett vaskulärt eller cystiskt ursprung), eftersom många av dessa lesioner kan ha ett ursprung i lamina propria eller muscularis mucosa. I dessa fall kan de nås med en tång och en exakt diagnos kan ställas. Om biopsierna är normala är det här vi måste definiera om vi ska avbryta eller fortsätta undersökningen.
När endoskopin har utförts och en subepitelial lesion har upptäckts kan vi omedelbart utvärdera den. Inledningsvis måste vi beskriva dess storlek, form, färg och rörlighet samt om den pulserar eller inte. Slutligen kan vi bedöma dess konsistens med en sluten biopsitång, vilket gör att vi kan upptäcka om den är cystisk, fast eller mjuk, tryckbar och kuddliknande (en lesion som långsamt återhämtar sig). Kuddliknande lesioner med gula halos är mycket troliga för lipom. Om lesionen är en lätt oregelbundenhet i slemhinnan och har en central fördjupning tyder det på en ektopisk bukspottkörtel. Vanligtvis har cystor eller varicer en slät, symmetrisk slemhinna. GIST (gastrointestinala stromala tumörer) kan vara lätt såriga, men de är fasta och rörliga (9). Det är också användbart att ändra patientens position för att utesluta möjligheten av en extrinsisk lesion, vars endoskopiska utseende förändras om patienten ändrar sin position, inhalerar eller om patientens mage är fylld med luft (10-12).
Vad är differentialdiagnosen?
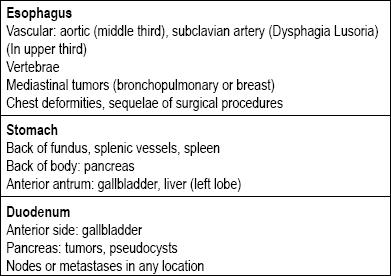
Det finns många olika typer av lesioner i mag-tarmkanalen som kan kategoriseras som subepiteliala. Deras orsaker beror vanligtvis på om lesionen är belägen i matstrupen, magsäcken, tolvfingertarmen eller rektum. Nästa punkt att ta hänsyn till är om det verkligen är en lesion i väggen eller om det är en extrinsisk kompression eftersom det finns strukturer runt om i hela mag-tarmkanalen som kan leda till kompression (tabell 1) (5-8).
Tabell 1. Primära orsaker till extraluminala kompressioner i övre mag-tarmkanalen.
Bör alla lesioner utvärderas med endoskopiskt ultraljud (EUS)?
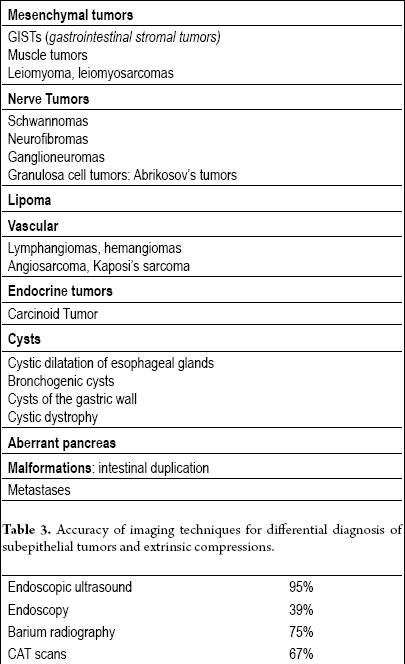
Egentligen måste alla subepiteliala lesioner (tabell 2) utvärderas med ytterligare bildteknik, men om lesionen är mindre än en centimeter i diameter (särskilt om den är gul) är en utvärdering inte nödvändig eftersom det finns en hög sannolikhet att det är ett lipom.
Tabell 2. Subepiteliala tumörer i mag-tarmkanalen.
Det endoluminala eller endoskopiska ultraljudet (EUS) är den bästa tekniken (13, 14). Noggrannheten hos EUS för differentiering av extraluminell kompression från en subepitelial tumör är över 95 %. Detta är mycket bättre än andra avbildningstekniker som konventionellt ultraljud eller datortomografi (15-17) (tabell 3).
Tabell 3. Noggrannhet hos avbildningstekniker för differentialdiagnos av subepiteliala tumörer och extrinsiska kompressioner.
När vi har fastställt att lesionen är intrinsisk i väggen och inte är en extrinsisk kompression, måste vi utvärdera vilket väggskikt den motsvarar. Normalt är magsäcksväggen uppdelad i mukosa, submucosa, muscularis propria och serosa. Slemhinneskiktet är indelat i epitel, basalmembran, lamina propria och muskelslemhinna. Med EUS och med radioutrustning kan väggen delas in i 5 lager (18):
Det första hyperechoiska lagret motsvarar den mest ytliga delen av magslemhinnan.
Det andra hypoechoiska lagret motsvarar den djupaste delen av slemhinnan som kan korreleras med muskelslemhinnan.
Det tredje hyperechoiska lagret motsvarar det submucosala lagret.
Det fjärde hypoechoiska lagret motsvarar själva muskeln.
Det femte hyperechoiska lagret motsvarar serosa eller adventitia.
Normalt sett finns det inga lesioner i lagren ett och fem (19), så de är begränsade till tre lager. De är vanligtvis hypoekoiska, anekoiska eller hyperechoiska.
Diagnostik med endoskopiskt ultraljud
Vi kommer att beskriva varje presentation enligt dess skikt.
Ekologiskt skikt två
Korresponderar till den djupaste delen av slemhinnan eller till lamina propria och till muscularis mucosa. De lesioner som uppstår i detta lager är sällsynta och är vanligtvis hypoekoiska.
Hypoekoiska lesioner: De flesta av de tumörer som uppstår i detta skikt är muskulära, vanligen leiomyom. De kan ha förkalkningar och stora kan vara heterogena och visa noduli till skillnad från små lesioner som är homogena. (20).
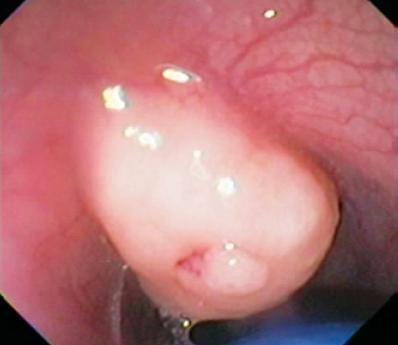
I det här lagret finner vi också Abrikosovs tumörer eller granulära celler. De är vanligtvis små och till skillnad från leiomyom deformerar de endoskopets kula på grund av sin hårdhet (figur 2 och 3). Karcinoider kan också ha sitt ursprung i detta skikt, vanligtvis i fundus eller rektum (figur 4).
Figur 2. Gulfärgad subepitelial lesion i den distala matstrupen.
Figur 3. EUS visar en isoechoisk lesion i det tredje ekoskiktet som deformerar kulan, vilket tyder på en 2 cm stor granulär celltumör
Figur 4. Subepitelisk lesion med ett retikulärt mönster i mitten som tyder på en neuroendokrin tumör.
Anechoiska lesioner: Vanligtvis kan vi se att inklusions- eller retentionscystor kan ha sitt ursprung i detta lager.
Ekologiskikt tre
Är ett vävnadsband som ser hyperechoiskt ut i EUS. Många tumörer kan ha sitt ursprung i detta lager.
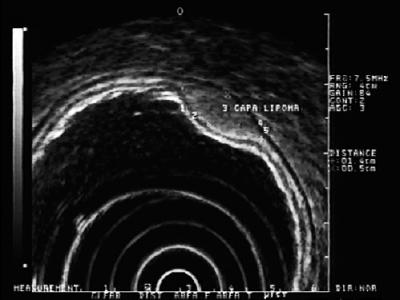
Hyperechoiska lesioner: De vanligaste lesionerna i detta skikt är lipom. De karakteriseras som homogena hyperechoiska lesioner. Vanligtvis är de kuddliknande när man trycker på dem med en endoskopisk tång (figur 5) (9).
Figur 5. EUS: hyperechoisk lesion i submucosal lager 3 som är kompatibel med lipom.
Neurofibromer tenderar att vara hyperechoiska. De har sitt ursprung i submucosan eller muscularis propria.
Hypoekoiska lesioner i detta lager kan motsvara ektopiska eller avvikande pankreata. Dessa lesioner är vanligtvis heterogena och ibland kan anekoiska kanalstrukturer som kan motsvara dukter ses i mitten. Vid endoskopi ses en lesion med deprimerat centrum (21).
Hypoechoiska lesioner kan också motsvara karcinoida tumörer. Även om de inte är subepiteliala tumörer eftersom de är neuroendokrina snarare än mesenkymala, kan de vara lokaliserade i digestionsväggen och ge upphov till samma typ av noduli. Vanligtvis är de små (mindre än en cm), hypoechoiska (men mer ekogena än muskulösa) och sätter sig i slemhinnan. Histologisk undersökning är vanligtvis möjlig från en biopsi (22, 23).
Gastriska lymfom kan också förekomma som hypoechoiska eller hyperechoiska lesioner i submucosan (24).
Anechoiska lesioner som observeras i det här skiktet är troligen kärlstrukturer eller cystor (25).
Ekologiskt skikt fyra
Korresponderar till det muskulära skiktet. Därför är majoriteten av tumörer i detta lager av muskulärt ursprung.
Hyperechoiska lesioner är mycket sällsynta, men kan vara kopplade till lymfom, neurogena tumörer eller metastaser (26).
Hypoechoiska lesioner: De flesta tumörer i detta skikt är hypoekoiska, oftast stromala tumörer (GIST) när de är belägna i magsäcken. Om de är lokaliserade i matstrupen kallas de dock vanligen leiomyom. Andra lesioner som kan ha detta utseende är metastaser med ursprung i lungorna eller brösten och glomustumörer (27). Lymfom kan också äventyra detta lager men åtföljs i allmänhet av engagemang i de övre lagren.
GIST (gastrointestinal stromal tumör) är namnet på en lesion om vilken vår kunskap har förbättrats avsevärt under de senaste åren (28-30). Dessa tumörer tycks ha sitt ursprung i totipotentiella celler som också är ursprungspunkterna för de så kallade interstitiella cellerna av Cajal. De kan differentieras i grupper: övervägande muskulära, övervägande neurala eller en kombination av de två. Diagnosen ställs genom immunohistokemisk identifiering av CD-117-protein (även kallat c-kit-protein) som är en membranreceptor med tyrosinkinasaktivitet (31).
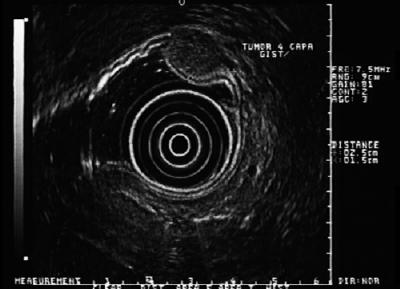
Viktigt är att 30 % av dessa lesioner kan ha malignt beteende och ge upphov till metastaser. Enbart i USA rapporteras 5 000 till 6 000 fall varje år (32). Deras fördelning i mag-tarmkanalen är: mage (40-70 %), tunntarm (20-40 %), tjock- och ändtarm (5-15 %) och matstrupe (<5 %) (33). Detta innebär att om vi har en hypoekoisk lesion i fjärde lagret i esofagus är det troligen ett leiomyom, men om det är i magsäcken är det vanligtvis en GIST (Figur 6, 7 y 8). De flesta patienter är i sitt femte eller sjätte levnadsårtionde. Vanligtvis har de en lesion som ligger i det fjärde lagret eller muscularis propria, även om den också kan ligga i muscularis mucosa (34). De flesta patienter är symtomfria tills tumören blir tillräckligt stor för att ulcera, blöda eller metastasera.
Figur 6. EUS visar hypoechoisk lesion i det fjärde lagret som är kompatibel med GIST.
Figur 7. Ulcererad lesion som tyder på GIST.
Figur 8. EUS i figur 7 visar en hypoekoisk lesion i det fjärde ekoskiktet som i hög grad tyder på en GIST, mer än 5 cm.
Av denna anledning är det en indikation för kirurgi om vi identifierar en GIST som är större än 3 cm, även om den är asymtomatisk (andra författare föreslår en gräns på 4 cm). (35). Lesioner på mindre än 3 cm utgör dock utmaningar för hanteringen eftersom majoriteten är godartade. Icke desto mindre bör det klargöras att alla GIST är potentiellt maligna, och små GIST som har metastaserat har rapporterats, särskilt i den nedre mag-tarmkanalen. För närvarande kan vi inte med endoskopiskt ultraljud förutsäga den maligna potentialen hos en GIST. Vi vet dock att lesioner som är större än 4 cm, har oregelbundna gränser och/eller cystiska utrymmen inom dem eller har ekogena foci har hög sannolikhet att vara maligna (36).
Å andra sidan kan endoskopisk ultraljudsstyrd finnålsaspiration (EUS-FNA) inte bara diagnostisera GIST genom att identifiera CD-117, utan även förekomsten av Ki-67-proteinet, som indikerar proliferation och tyder på malignt beteende (37). Det är mycket viktigt att betona att GIST-lesioner är mycket farliga. Vi måste följa dem kontinuerligt och bedöma tumörstorlek och proliferationsgrad i enlighet med de fastställda riskerna. Även efter fullständig resektion kan dessa lesioner återkomma, särskilt på ursprungsplatsen, men även i peritoneum eller lever. 40-90 procent av lesionerna återkommer trots fullständig resektion. I 50 % av återfallen är levern inblandad. GIST har 4 gånger större risk för återfall när den primära platsen är tarmen än när den ligger i magsäcken (38).
Vad är noggrannheten hos endoskopiskt ultraljud?
Flera studier har visat att EUS är mycket exakt när det gäller att avgöra om en lesion finns på väggen eller inte, och för att fastställa från vilket väggskikt lesionen kommer. Detta gör det möjligt för oss att välja det bästa diagnostiska tillvägagångssättet. I en studie fastställdes källskiktet hos 48 av 50 patienter (96 %) med kirurgisk bekräftelse (39). Överensstämmelsen mellan observatörerna är mycket god, särskilt vid identifiering av lesioner som leiomyom och vaskulära lesioner. Det är viktigt att notera att det sonografiska utseendet på lesioner inte gör det möjligt att fastställa deras orsaker med 100 % säkerhet. En studie av Karaca et al. (40) av 22 patienter som genomgick EUS följt av mukosektomi visade att noggrannheten hos EUS var endast 45 %. Läsionerna var dock oftast mindre än 20 mm och ultraljudets precision ökade till 66 % för att skilja maligna från benigna tumörer. Eftersom de sonografiska kriterierna kan vara oprecisa verkar det rimligt att vi om möjligt bör försöka få en specifik diagnos. Detta kan uppnås med EUS-FNA eller mukosal resektion av lesionen, vilket visats i detta arbete. Mekky et al. studerade 141 patienter som genomgått EUS-FNA som kontrollerats kirurgiskt. De fann en noggrannhet på 95,6 % för sina slutresultat (41).
Monitorering, punktionsbiopsi eller resektion?
Beslutet att övervaka, använda eller utföra en resektion beror på flera faktorer, bland annat lesionens storlek, dess endoskopiska utseende, ursprungsskiktet och dess ekogena egenskaper. Om vi står inför en subepitelial lesion på mindre än 1 cm är fler tester inte motiverade, men en uppföljande endoskopi bör utföras. Om lesionen är större än 1 cm är EUS obligatoriskt. Om lesionen är liten och beror på det första, andra eller tredje ekoskiktet kan diagnostisk mukosaresektion, som också är terapeutisk, utföras. Om lesionen emellertid finns i det fjärde skiktet och är mindre än 2 cm, rekommenderas övervakning med enbart endoskopi. Om den mäter mellan 2 cm och 5 cm är EUS-FNA idealiskt. Om det konstateras att det är en godartad skada kan en uppföljande undersökning göras efter sex månader. Om den inte har vuxit behövs ingen ytterligare uppföljning. Om den är malign, har malign potential eller är större än 5 cm rekommenderas behandling (42).
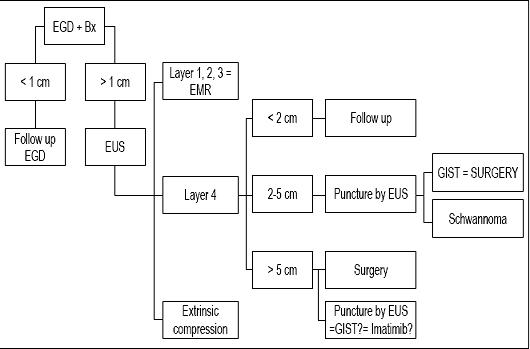
Slutsatsen är att eftersom vår patient hade en lesion som var mindre än 1 cm anser vi att hans lesion endast förtjänade en uppföljande endoskopi (se algoritm, figur 9). En ny uppföljningsundersökning föreslogs om ett år. Om lesionen inte har vuxit kommer ytterligare uppföljningar att planeras vartannat eller vart tredje år, men om den växer kommer vi att föreslå EUS-FNA och en immunohistokemisk undersökning.
Figur 9. Behandlingsalgoritm vid subepiteliala lesioner. EGD: övre endoskopi. Bx: Biopsi. EUS: endoskopiskt ultraljud. EMR: endoskopisk mukosaresektion.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskopiskt tillvägagångssätt vid gastrointestinala stromala tumörer. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS i submucosala tumörer. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopiskt ultraljud och endoskopisk ultraljudsstyrd finnålsaspiration för diagnos av maligna submucosala tumörer. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografiska egenskaper hos gastriska ektopiska bukspottkörtlar som kan särskiljas från mesenkymala tumörer. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonografiska egenskaper hos esofageala granulära celltumörer. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Roll för endoskopiskt ultraljud vid behandling av submucosala tumörer i matstrupen och magsäcken. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Fin nålsaspirationsbiopsi av gastriska duplikationscystor med endoskopisk ultraljudsstyrning. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskopisk mukosalresektion för gastriska neoplasmer. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopisk mukosaresektion. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoskopisk ultraljudsundersökning av gastrointestinala stromala tumörer (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. En studie av myogena tumörer i övre mag-tarmkanalen genom endoskopisk ultraljudsundersökning med särskild hänvisning till differentialdiagnostik av godartade och maligna lesioner. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Utvärdering av submucosala skador i övre mag-tarmkanalen med endoskopiskt ultraljud. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopisk ultraljud vid diagnos av submucosal tumör i magsäcken. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologiska korrelat av gastrointestinala ultraljudsbilder. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiv utvärdering av en US-sond med kateter över ledningen. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopisk ultraljud för utvärdering av tumörer med glatt muskulatur i övre mag-tarmkanalen: en erfarenhet av 42 fall. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskopisk ultraljud. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal avbildning: endoskopiskt ultraljud. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Utfallet av vävnadsprovtagning för submukosala lesioner som utvärderas med EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopisk ultraljud för initial stadieindelning och uppföljning hos patienter med låggradigt gastriskt lymfom av mukosa-associerad lymfoid vävnad som behandlas medicinskt. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnostik av fördubblingscystor i förloppet med hjälp av endoskopisk ultraljudsundersökning. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografisk differentiering av godartade och elakartade stromalcellstumörer. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiska egenskaper som kan förutsäga godartade och maligna gastrointestinala stromalcellstumörer. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologi och diagnostiska kriterier för gastrointestinala stromala tumörer (GIST): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Gastrointestinala stromala tumörer och andra mesenkymala lesioner i tarmen. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinala stromala tumörer: Från ett kirurgiskt till ett molekylärt tillvägagångssätt. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Behandling av maligna gastrointestinala stromala tumörer. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromala tumörer. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Mätning av lesioner med endoskopi: en översikt. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Klinisk presentation av gastrointestinala stromala tumörer och behandling av operabel sjukdom. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. En studie av myogena tumörer i övre mag-tarmkanalen med hjälp av endoskopisk ultraljudsundersökning med särskild hänvisning till differentialdiagnosen av godartade och maligna lesioner. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostisk bedömning av gastrointestinal stromal tumör. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. En klinisk-patologisk studie av 77 fall med korrelation av egenskaper med icke-aggressiva och aggressiva kliniska beteenden. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosal tumors and thick gastric fols. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosal lesions. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoskopiskt tillvägagångssätt vid gastrointestinala stromala tumörer. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS in submucosal tumors. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoskopiskt ultraljud och endoskopisk ultraljudsstyrd finnålsaspiration för diagnos av maligna submucosala tumörer. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonografiska egenskaper hos gastriska ektopiska bukspottkörtlar som kan särskiljas från mesenkymala tumörer. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonografiska egenskaper hos esofageala granulära celltumörer. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Roll för endoskopiskt ultraljud vid behandling av submucosala tumörer i matstrupen och magsäcken. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsi med finnålsaspiration av dubbleringscystor i magsäcken med endoskopisk ultraljudsstyrning. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoskopisk mukosalresektion för gastriska neoplasmer. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoskopisk mukosaresektion. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoskopisk ultraljudsundersökning av gastrointestinala stromala tumörer (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. s. 21-27.
15. Yamada Y, Kida M, Sakaguchi. En studie av myogena tumörer i övre mag-tarmkanalen genom endoskopisk ultraljudsundersökning med särskild hänvisning till differentialdiagnosen av godartade och maligna lesioner. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluation of submucosal upper gastrointestinal tract lesions by endoscopic ultrasound. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoskopisk ultraljud vid diagnos av submucosal tumör i magsäcken. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Histologiska korrelat av gastrointestinala ultraljudsbilder. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospektiv utvärdering av en US-sond med kateter över ledningen. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoskopisk ultraljud för utvärdering av tumörer med glatt muskulatur i övre mag-tarmkanalen: en erfarenhet av 42 fall. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoskopisk ultraljud. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal avbildning: endoskopiskt ultraljud. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Utfallet av vävnadsprovtagning för submukosala lesioner som utvärderas med EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoskopisk ultraljud för initial stadieindelning och uppföljning hos patienter med låggradigt gastriskt lymfom av mukosa-associerad lymfoid vävnad som behandlas medicinskt. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnostik av fördubblingscystor i förloppet med hjälp av endoskopisk ultraljudsundersökning. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Endosonografisk differentiering av godartade och elakartade stromalcellstumörer. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonografiska egenskaper som kan förutsäga benigna och maligna gastrointestinala stromalcellstumörer. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologi och diagnostiska kriterier för gastrointestinala stromala tumörer (GIST): A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Gastrointestinala stromala tumörer och andra mesenkymala lesioner i tarmen. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinala stromala tumörer: Från ett kirurgiskt till ett molekylärt tillvägagångssätt. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Behandling av maligna gastrointestinala stromala tumörer. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromala tumörer. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Mätning av lesioner med endoskopi: en översikt. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Klinisk presentation av gastrointestinala stromala tumörer och behandling av operabel sjukdom. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. En studie av myogena tumörer i övre mag-tarmkanalen med hjälp av endoskopisk ultraljudsundersökning med särskild hänvisning till differentialdiagnosen av godartade och maligna lesioner. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Prognostisk bedömning av gastrointestinal stromal tumör. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. En klinisk-patologisk studie av 77 fall med korrelation av egenskaper med icke-aggressiva och aggressiva kliniska beteenden. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosal tumors and thick gastric fols. ASGE- 2002. s. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial Lesions. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.