Glykogen och stärkelse, megadaltonstora glukospolymerer, är den viktigaste reservoaren av lätt tillgänglig energi och kolföreningar i de flesta levande organismer. Hos däggdjur är glukosupptag och -användning under noggrann kontroll. Brister i den normala glukoshanteringen är förknippade med en rad olika mänskliga patologier, t.ex. glykogenlagringssjukdomar och diabetes, där ihållande hyperglykemi korrelerar med tidig insjuknande och ökad svårighetsgrad av sjukdomen. De metaboliska vägarna för den katalytiska omvandlingen av glykogen inbegriper flera enzymer, bland annat glykogensyntas som katalyserar förlängningen och glykogenfosforylas som katalyserar nedbrytningen av a(1,4)-länkade glukaner. Under de senaste 30 åren har en stor mängd information om glykogennedbrytning erhållits genom biokemiska och strukturella studier av glykogen- och maltodextrinfosforylaser. Dessa studier har visat att regleringen av glykogenfosforylas är ett fascinerande exempel på kovalent och icke-kovalent allosterism som samordnas på ett utmärkt sätt av hormonell kontroll. Information som beskriver de tertiära och kvartära strukturerna finns nu tillgänglig för praktiskt taget alla enzymer som är direkt involverade i glykogenförädlingen. Överraskande nog har mycket lite strukturell information rapporterats om glykogensyntas, som katalyserar glykogenförlängningen genom successiv addition av ![]() -(1,4)-länkade glukosrester till polymerens icke-reducerande ände, med ADP/UDP-glukos som glukosdonator.
-(1,4)-länkade glukosrester till polymerens icke-reducerande ände, med ADP/UDP-glukos som glukosdonator.
Vi har nu bestämt kristallstrukturen av glykogensyntaset från Agrobacterium tumefaciens (AtGS) med en upplösning på 2,3 Å, både i apo-form och i närvaro av ADP. Data samlades in på ID29 och strukturen löstes med hjälp av SAD-tekniken (single wavelength anomalous diffraction), följt av förfaranden för densitetsmodifiering. Proteinet återfinns som en dimer i den asymmetriska enheten, där varje monomer består av två ”Rossmann-fold”-domäner (figur 81) som är organiserade på samma sätt som i strukturerna av glykogenfosforylas och andra glykosyltransferaser i GT-B-superfamiljen . En djup spricka mellan de båda domänerna innehåller det katalytiska centret. En viktig skillnad mellan glykogensyntaser från däggdjur (familj GT3) och bakteriella glykogensyntaser (GT5) är att endast GT3-enzymer är starkt reglerade genom fosforylering och icke-kovalent allosterisk modulering. Enligt de strukturbaserade multipla sekvensanpassningarna mellan GT3-, GT5- och glykogenfosforylassekvenser är de reglerande fosforyleringsställena i humant glykogensyntas troligen belägna i de 25-residualer N-terminala och 120-residualer C-terminala inläggen, utanför den icke-reglerade GT-B-kärnan i bakteriella glykogensyntaser. Mutagenesestudier hade tidigare identifierat två konserverade Arg-kluster i GT3-enzymer som en del av de allosteriska platserna för både fosfo-Ser/Thr-rester och den icke-kovalenta aktivatorn Glc-6P. De motsvarande resterna i AtGS är belägna i ena änden av den C-terminala domänen, långt från reaktionscentrumet, vilket tyder på en reglerande effekt på långdistans.
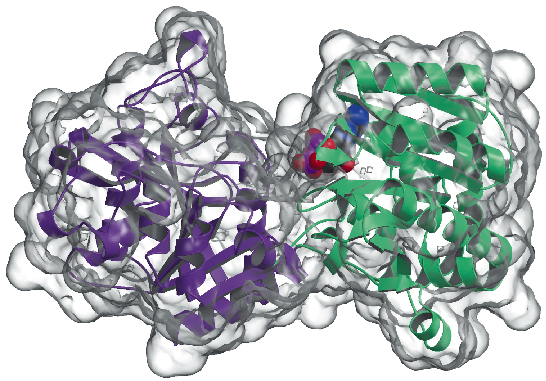
Fig. 81: Glykogensyntasets struktur: Den yta som är tillgänglig för lösningsmedel är representerad i transparent. Notera den bundna ADP-molekylen (ritad som VDW-kulor).
Strukturen hos AtGS visar en slående topologisk likhet med kärnstrukturerna hos glykogen/maltodextrinfosforylaser (familj GT35) (figur 82a), även om sekvensidentiteterna är låga (~14 %). Strukturen av varje Rossmann-fold-domän i AtGS är betydligt närmare de av fosforylaser från GT35-familjen än något annat nukleotidberoende glykosyltransferas. Glykogensyntas och fosforylaser uppvisar också en stark likhet vid sina katalytiska platser (figur 82b). ADP-ribosen och pyridoxalgrupperna ligger i likvärdiga positioner, liksom ADP:s distala fosfat i AtGS och det oorganiska fosfat-substratet i fosforylaser. Dessutom är kritiska aminosyror som interagerar med substratens glukosdelar också konserverade. Den katalytiska mekanism som används av glykogensyntaser och fosforylaser är därför troligen likartad, med subtila förändringar i strukturen som förklarar deras totalt sett olika funktionella egenskaper.
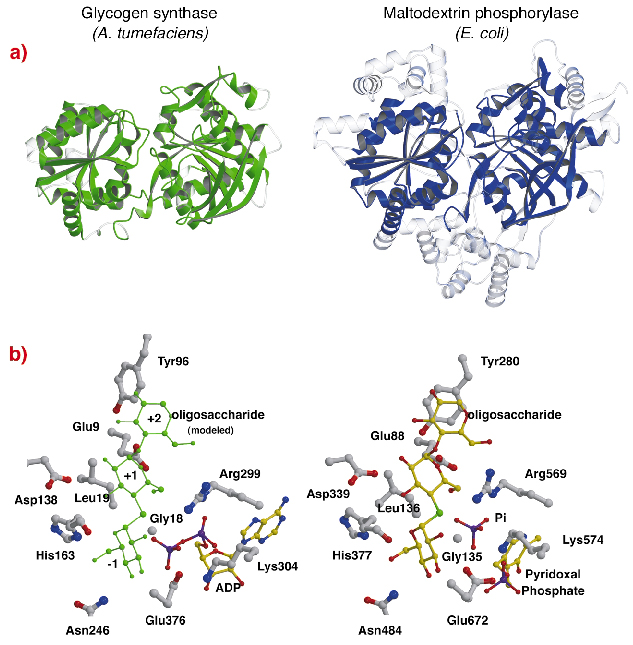
Fig. 82: Homologi till glykogenfosforylas: (a) efter strukturell anpassning, överlagrade likvärdiga rester mellan AtGS och E. coli maltodextrinfosforylas MalP, är representerade i fast material (icke-justerade områden, i transparent); (b) de katalytiska platserna hos AtGS och MalP.
Det ursprungliga förslaget att glykogensyntesen helt enkelt representerade en omvändning av dess nedbrytande fosforolys visade sig vara felaktigt när Leloir visade att UDP-Glc och glykogensyntas, inte Glc-1-P och glykogenfosforylas, var ansvariga för polysackaridförlängningen . Vårt arbete visar nu dock att de motsatta oberoende reaktionerna i interkonversionen av glukos och glykogen katalyseras av nära besläktade homologa enzymer.