Det är viktigt att känna till en molekyls Lewisstruktur för att förstå dess fysiska egenskaper, hybridisering och molekylens form. Idag ska vi gå igenom Lewisstrukturen för I3- eller även känd som triodidjonen eftersom den har en negativ laddning. Det finns tre jodmolekyler i denna molekyl och därav namnet på föreningen är Triodid. För att förstå molekylens Lewisstruktur bör vi känna till jodmolekylens valenselektroner.
Lewisstruktur
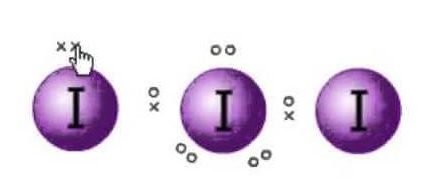
Lewisstruktur är representationen av elektronerna i molekylerna. Det finns ensamma par och valenselektroner som hjälper till att bestämma molekylens hybridisering och form. Eftersom det finns molekyler av jod kommer en molekyl av jod att befinna sig i centrum. Dessutom är jod i den sjunde gruppen i det periodiska systemet och har sju valenselektroner i sin yttre omloppsbana.

Vi har här tre molekyler av jod som tillsammans med en extra elektron som ger den en negativ laddning. Så det totala antalet valenselektroner är : 7×3 + 1= 22.
Det finns totalt 22 valenceelektroner i denna molekyl. Nu finns det en oktettregel som varje atom följer. Enligt denna regel ska varje atom ha åtta elektroner i sin yttre omloppsbana. Om det finns åtta elektroner i den centrala atomens yttre skal finns det två andra atomer som måste komplettera sin oktett. Eftersom alla atomer behöver åtta elektroner i sitt yttre skal för att komplettera oktetten kommer en elektron från den centrala jodatomen att tas av båda de angränsande jodatomerna. Det innebär att 8-1-1=6.
Då elektronerna kommer att tas av båda atomerna.
Så nu kommer valenselektronerna på den centrala jodatomen att vara sex. Dessa sex elektroner kommer att bilda de ensamma elektronparen som inte binder. Eftersom den bildar elektronparet nu kommer det att finnas tre ensamma par och två bindningspar av elektronerna eftersom varje jodatom har en bindning med den centrala atomen som delar en elektron vardera totalt finns det 3 ensamma par och 2 bindningspar på den centrala atomen.
Hybridisering
För att känna till hybridiseringen av en molekyl finns det en enkel formel som kan användas. Denna formel används för att ta reda på hybridiseringstalet som hjälper till att känna till hybridiseringen av molekylen.
Hybridiseringstalen och den hybridisering det bestämmer anges på följande sätt:
- 2: sp hybridisering
- 3: sp2 hybridisering
- 4: sp3 hybridisering
- 5: hybridisering
Formeln för att hitta talet är,
Hybridiseringstal: Antal valenselektroner + monovalent + (negativ laddning) – (positiv laddning)/2
Valenselektronerna hos jodatomerna är 7 eftersom det finns sju elektroner i det yttersta skalet. Antalet monovalenta atomer är två eftersom två av tre jodatomer är monovalenta. När vi nu kommer till I3-jonens laddning har den en negativ laddning så värdet på denna negativa laddning blir 1.
Placera nu alla värden enligt formeln,
7+1+2/2
=10/2
=5
Det innebär att hybridiseringsnumret är 5, vilket betyder att dess hybridisering är sp3d.
Ett annat sätt att hitta hybridiseringen hos en viss molekyl är med hjälp av ensamstående par och valenselektroner. Antalet ensamstående par i denna molekyl är 3 och antalet atomer som delar valenceelektroner är 2.
Därmed är 3+2=5 vilket också bestämmer sp3d-hybridiseringen.
Förmågan hos I3-jonen

Förmågan hos molekylen I3- är linjär. Det finns tre jodatomer varav en har en extra negativ laddning. På grund av denna extra elektron finns det tre ensamstående elektronpar och två bindningspar, vilket gör att dess steriska nummer är 5. Eftersom det finns tre ensamstående par på den centrala jodidatomen försöker dessa par stöta bort varandra så mycket som möjligt. Så för att vara på större avstånd intar paren de ekvatoriella positionerna, och de två andra jodatomerna befinner sig 180 grader från varandra. Således är I3-jonens övergripande form linjär.
Polaritet
Så här är den knepiga delen om denna jon, för det första eftersom den har en laddning på sig kan vi kalla den för en polyatomär jon istället för att kalla den för en molekyl. Ioner är de laddningar som vi ser på molekylerna. Eftersom I3- har en elektron har denna jon en negativ laddning totalt sett. Molekyler har polaritet eftersom den har båda laddningarna som är en delvis positivt laddad ände och den delvis negativt laddade änden. Det finns ett dipolmoment på molekylerna beroende på separation av laddningarna på molekylen. Om avståndet mellan de båda laddningarna är större blir dipolmomentet också större.
Men när vi talar om I3-jonen är det en negativt laddad jon. Även när vi ritar upp dess Lewisstruktur ser vi inget dipolmoment eller polära bindningar i den eftersom den totala laddningen i sig är negativ på jonen. Den är alltså varken polär eller opolär. Men om man måste beskriva jonen kan man använda frasen den ” som en polär molekyl” eftersom I3- är löslig i vatten.
I avslutande kommentarer, för att sammanfatta, hela denna artikel, är I3- en polyatomär jon som har 22 valenselektroner, 3 ensamma par, 2 bindningspar och sp3d-hybridisering. Den är linjär i sin form och har ingen polaritet.