Introduktion
Kronisk njursjukdom (CKD) är förknippad med hög dödlighet, särskilt av kardiovaskulärt ursprung. Det begränsade sambandet mellan mortalitet och traditionella kardiovaskulära riskfaktorer hos dessa patienter är dock paradoxalt. Endast vissa markörer relaterade till inflammation eller näring (t.ex. C-reaktivt protein och serumalbumin) har visat sig vara konsekventa prediktorer för dödlighet vid CKD.1
Under de senaste åren har vissa observationsstudier visat ett samband mellan förhöjda koncentrationer av alkaliskt fosfatas (ALP) i serum och dödlighet hos patienter med CKD2-5. Den biologiska och kliniska betydelsen av detta fynd är dock fortfarande okänd.
Gamma-glutamyltransferas (GGT) är ett enzym som finns i serum och på den yttre ytan av celler från olika organ, t.ex. lever, bukspottskörtel, tarm, lungor och njurar.6 Serum GGT är inte bara en traditionell markör för alkoholkonsumtion och hepatobiliära sjukdomar, utan flera studier har också visat ett samband mellan förhöjda serum GGT-nivåer och kardiovaskulära sjukdomar, diabetes mellitus, högt blodtryck och metaboliskt syndrom.7
GGGT-nivåer är en prediktor för dödlighet i den allmänna befolkningen; faktum är att detta enzym nyligen har inkluderats som en av en uppsättning biokemiska parametrar som förutspår dödlighet.8 Dessutom skulle GGT-nivåer i serum kunna hjälpa till att tolka höga ALP-värden av oklart ursprung.
Det finns endast ett fåtal studier som har analyserat den kliniska och prognostiska betydelsen av serum GGT vid CKD.9,10 Syftet med denna studie var att undersöka de kliniska egenskaperna hos CKD-patienter med onormalt förhöjda GGT-nivåer i serum och deras interaktion med ALP samt att fastställa värdet av denna parameter som en prediktor för mortalitet.
Material och metoder
Detta är en retrospektiv observationsstudie som genomfördes på en kohort av vuxna patienter som följdes på öppenvårdskliniken för patienter med låg clearance (avancerad CKD) vid nefrologiavdelningen vid sjukhuset Infanta Cristina, Badajoz, Spanien, från januari 2002 till oktober 2013. Studien omfattade alla patienter före dialys i åldern >18 år med en uppskattad glomerulär filtrationshastighet (eGFR)
mL/min/1,73m2. Patienter med CKD på grund av njurtransplantationsdysfunktion ingick inte.
Demografiska data och kliniska parametrar som ålder, kön, kroppsmasseindex (BMI), komorbiditeter och medicinering registrerades vid inklusionen.
Komorbiditet utvärderades med hjälp av Davies-poängen,11 och patienterna klassificerades enligt summan av sina olika komorbiditeter: inga komorbiditeter, milt-måttligt (1 eller 2 komorbiditeter), eller svårt (3 eller fler komorbiditeter). De viktigaste komorbiditeterna som registrerades var: diabetes mellitus, hjärtsvikt, kranskärlssjukdom, cerebrovaskulär eller perifer kärlsjukdom, kronisk obstruktiv lungsjukdom, cancer och kroniska inflammatoriska processer.
I den här studien innefattade begreppet ”leversjukdom” inte bara patienter som diagnostiserats med kroniska leversjukdomar, cirros eller levertransplantationer, utan även patienter med aktiv alkoholism, eller aktiv infektion med hepatotropa virus (B eller C). Icke-alkoholisk steatohepatit (fettleversjukdom) var ett vanligt ultraljudsfynd bland dessa patienter, även om denna sjukdom inte ingick i listan över leversjukdomar.
Patienterna följdes upp regelbundet från det att de inkluderades i studien fram till deras död, njurtransplantation, förlust av uppföljning eller slutet av datainsamlingsperioden (31 december 2014).
Med tanke på studiens retrospektiva utformning inhämtades inte individuellt informerat samtycke.
Biokemiska mätningar
Med början i januari 2002 lades serum GGT och total ALP till de rutinmässiga biokemiska parametermätningarna hos patienter från vår avancerade CKD-klinik.
GGGT-nivåerna bestämdes med hjälp av en autoanalysator (Advia Chemistry, Siemens Healthcare Diagnostics, New York, USA) med hjälp av en kinetisk kolorimetrisk metod med gamma-glutamyl-3-karboxi-4-nitroanilid och glykylglycin. Variationskoefficienten är mindre än 4,5 % och referensintervallet 0-36U/L.
Serum ALP-nivåer mättes också med autoanalysator (Advia Chemistry) med ALPI-metoden, som kvantifierar alkalininfosfatasaktiviteten genom att mäta transfosforyleringen av p-nitrofenylfosfat till p-nitrofenol i närvaro av 2-amino-2-metyl-1-propanol. Variationskoefficienten var mindre än 4 % och referensintervallet var 45-120U/L.
För att karaktärisera patienter med onormalt förhöjt GGT eller ALP i serum inkluderades även hematologiska och biokemiska grundparametrar (se tabell 1) i studien. De biokemiska parametrarna bestämdes med konventionella laboratoriemetoder (Advia Chemistry, New York, USA). Nivåerna av parathormon (molekyl 7-84) (PTH) bestämdes med hjälp av automatiserad kemiluminiscent immunoassay (DiaSorin, Italien), serumalbuminkoncentrationer med hjälp av bromkresolgrönmetoden och högkänsligt C-reaktivt protein med hjälp av kemiluminiscent enzymimmunoassay i fast fas (Immulite autoanalysator, Diagnostic Product Corporation, New York, USA).
Kliniska och biokemiska egenskaper hos patientgruppen och undergrupper enligt onormalt höga GGT- eller ALP-värden.
| Total | Normala GGT- och ALP-värden | Höga GGT | Hög ALP | Hög GGT och ALP samtidigt | P* | ||
|---|---|---|---|---|---|---|---|
| N patienter | 909 | 596 | 141 | 104 | 68 | ||
| Ålder (år) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 | |
| Kön, man/kvinna | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 | |
| Komorbiditetsindex % | |||||||
| Ingen | 31 | 37 | 21 | 29 | 9 | ||
| Mild-måttlig | 52 | 48 | 63 | 59 | 54 | ||
| Allvarlig | 17 | 15 | 16 | 12 | 37 | ||
| Aktiva rökare, % | 15 | 14 | 21 | 10 | 25 | 0.011 | |
| Diabetes mellitus, % | 39 | 35 | 46 | 41 | 50 | 0.013 | |
| Leversjukdom, % | 3 | 2 | 6 | 2 | 10 | ||
| Ischemisk hjärtsjukdom, % | 16 | 14 | 10 | 16 | 38 | ||
| CNS eller perifer ischemi, % | 21 | 19 | 18 | 23 | 34 | 0.031 | |
| Hjärtsvikt, % | 18 | 16 | 21 | 14 | 37 | ||
| BMI, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5,9) | 0,176 | |
| eGFR, mL/min/1,73 m2 | 14,7 (5,1) | 14,8 (5,1) | 14.6 (4,6) | 14,1 (4,4) | 15,6 (6,2) | 0,234 | |
| Hemoglobin (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 | |
| Serumurinsyra, mg/dL | 7,6 (1,9) | 7,5 (1,9) | 7,9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | ||
| Totalt kolesterol, mg/dL | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 | |
| Triglycerider, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 | |
| Serumalbumin, g/dL | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 | |
| Serum totalt kalcium, mg/dL | 9.1 (0.8) | 9.2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 | |
| Serumfosfor, mg/dL | 4,7 (1,1) | 4,7 (1) | 4,7 (0,9) | 4,6 (1.2) | 4,6 (1,2) | 0,851 | |
| Serumbikarbonat, mEq/L | 21,4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 | |
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | ||
| ALT, IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | ||
| GGT, IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | ||
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | ||
| Serumferritin, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | ||
| C-reaktivt protein, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | ||
| Proteinuri, mg/g kreatinin | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 | |
| Renin-angiotensinhämmare, % | 79 | 80 | 78 | 78 | 72 | 0.502 | |
| Betablockerare, % | 26 | 25 | 30 | 22 | 35 | 0.140 | |
| Diuretika, % | 60 | 59 | 62 | 60 | 65 | 0.829 | |
| Statiner, % | 53 | 54 | 53 | 55 | 47 | 0.762 | |
| Alopurinol, % | 22 | 22 | 25 | 26 | 13 | 0.200 | |
| D-vitaminanaloger, % | 10 | 10 | 7 | 15 | 9 | 0.201 | |
| Trombocythämmande medel, % | 34 | 33 | 28 | 41 | 38 | 0.124 | |
Data presenteras som medelvärde (standardavvikelse) om inget annat anges.
ANOVA eller χ2 mellan grupperna.
P0.05 hög GGT-ALP jämfört med normal GGT-ALP eller hög ALP, Scheffé-test.
P0,05 hög GGT jämfört med normal GGT-ALP, Scheffé-test.
P0,0001 hög ALP vs. Scheffé test.
P0.0001 hög GGT eller hög GGT-ALP jämfört med normal GGT-ALP eller hög ALP, Scheffé test.
P0.0001 hög ALP eller hög GGT-ALP jämfört med normal GGT-ALP eller hög ALP. normal GGT-ALP eller hög GGT, Scheffé-test.
P0,001 hög GGT eller hög GGT-ALP jämfört med normal GGT-ALP eller hög ALP, Scheffé-test.
Data tillgängliga för 845 patienter.
MDRD-4-formeln användes för att uppskatta den glomerulära filtrationshastigheten (eGFR).12
Serumferritin var den enda parametern med saknade värden. Medelvärdet av de tillgängliga värdena inkluderades i den deskriptiva analysen, men de saknade värdena beräknades inte, och denna variabel inkluderades inte som en kovariabel i överlevnadsanalysen.
Utfallsvariabel
Utfallsvariabeln var död av någon orsak. Dödsorsakerna klassificerades i fem grupper: plötslig död, kardiovaskulär, infektiös, malignitet och andra orsaker.
Statistisk analys
Parametriska eller icke-parametriska test användes för den beskrivande jämförelsen av de kontinuerliga variablerna, beroende på deras egenskaper, och chi-två-testet användes för de kategoriska variablerna. Pearsons test användes för den bivariata korrelationsanalysen.
Differenser i överlevnad mellan patienter enligt GGT- eller ALP-kvartilerna analyserades med hjälp av Kaplan-Meier-kurvor och jämfördes med hjälp av Mantel-Haenszel log-rank-testet.
Multivariata Cox proportional hazard-modeller användes för att analysera effekten av GGT- och ALP-värdena i utgångsläget på tiden till dödlighet av alla orsaker.
Då GGT- och ALP-nivåerna i utgångsläget uppvisade en positivt snedfördelad fördelning, transformerades värdena logaritmiskt för att kunna inkluderas som en kontinuerlig variabel.
För att ta hänsyn till de olika rekryteringsperioderna justerades de multivariata modellerna också i enlighet med en kategorisk variabel som motsvarar rekryteringsperioderna (2002-2005, 2006-2009, 2010-2014).
GGGT och ALP analyserades som kontinuerliga variabler (logaritmisk omvandling) och som kategoriska variabler: övre kvartil och onormalt höga värden (GGT>36IU/L och ALP>120IU/L).
Följande regressionsmodeller ingick: (1) Univariat. (2). Justerad för ålder, kön, comorbidity score, diabetes, leversjukdom, aktiv rökare, BMI, baseline eGFR och rekryteringsperiod. (3) Justerad för samma variabler som i modell 2 plus total serumkalcium, fosfor, PTH, albumin, C-reaktivt protein, triglycerider, urinsyra- och alaninaminotransferasnivåer (ALT). (4) Bäst passande modell med hjälp av den bakåtriktade konditionella stegvisa elimineringsprocessen.
Det proportionella riskanta antagandet testades med hjälp av log-minus-log-kurvor och Schöenfeld-residualer för varje variabel. Patienterna censurerades vid dödsfall, förlust av uppföljning, njurtransplantation eller i slutet av uppföljningen (31 december 2014), beroende på vilket som inträffade först.
Beskrivande data presenteras som medelvärde och standardavvikelse eller median och interkvartilintervall för kontinuerliga variabler, och absoluta värden och procentandelar för kategoriska variabler. A p-värde
ResultatPatientkarakteristika
Studiegruppen omfattade 909 patienter i CKD-stadium 4 eller 5, före dialys (genomsnittligt eGFR 14,7±5,1mL/min/1,73m2). Medelåldern (±SD) var 65±15 år och 53 % av patienterna var män. Alla var kaukasiska. De kliniska och biokemiska egenskaperna vid baslinjen visas i tabell 1.
För att analysera patienternas kliniska och biokemiska egenskaper enligt förekomsten av onormalt höga GGT- eller ALP-nivåer delades patienterna in i fyra undergrupper (tabell 1): normala GGT- och ALP-nivåer (66 % av patienterna), höga GGT- men normala ALP-nivåer (16 %), normala GGT- men höga ALP-nivåer (11 %) och samtidigt höga GGT- och ALP-nivåer (7 %).
Därmed hade 209 (23 %) och 172 (19 %) patienter onormalt höga GGT- respektive ALP-nivåer i utgångsläget. Det övre kvartilvärdet för GGT och ALP var 34IU/L respektive 112IU/L.
Det fanns inga signifikanta skillnader i medelålder och könsfördelning mellan undergrupperna. Komorbiditetspoängen och andelen aktiva rökare var anmärkningsvärt högre hos patienter med hög GGT, särskilt i gruppen med samtidigt hög GGT och ALP (tabell 1).
Leversjukdomar var sällsynta komorbiditeter i denna patientgrupp. Cirka 8 % av patienterna med höga GGT-värden hade dock diagnostiserats med en leversjukdom.
Förekomsten av kardiovaskulära sjukdomar hos patienter med antingen höga GGT- eller höga ALP-värden var likartad med den hos patienter med normala GGT- och ALP-värden, men denna förekomst av kardiovaskulära sjukdomar var dock signifikant förhöjd hos patienter med samtidigt höga GGT- och ALP-värden.
Signifikanta skillnader observerades i de biokemiska parametrarna mellan undergrupperna (tabell 1). Patienter med hög GGT hade högre serumkoncentrationer av urinsyra, triglycerider, ALT, ferritin och CRP än patienter med normala GGT- och ALP-nivåer eller enbart hög ALP. Undergruppen av patienter med enbart hög ALP hade högre PTH-nivåer. De genomsnittliga albuminvärdena vid baslinjen var likartade mellan subgrupperna.
Dessa biokemiska mönster som var associerade med GGT eller ALP bekräftades genom bivariat korrelationsanalys (tabell 2).
Koefficienter för korrelation mellan biokemiska parametrar.
| Log GGTa | Log ALPb | Haemoglobin | Ursyra | Triglycerider | ALT | Fosfor | Kalcium | Ferritin | Albumin | PTH | C-reaktivt protein | eGFR | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | |||||||||||||||
| Log ALPb | 0.337** | ||||||||||||||
| Haemoglobin | -0.001 | 0.029 | |||||||||||||
| Mjursyra | 0.162** | 0.051 | 0.068* | ||||||||||||
| Triglycerider | 0.164** | 0.011 | 0.063 | 0.083* | |||||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | ||||||||||
| Fosfor | -0.013 | 0.024 | -0.092* | 0.075* | 0.020 | 0.026 | |||||||||
| Calcium | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0.014 | -0.178** | ||||||||
| Ferritin | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | |||||||
| Albumin | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | ||||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0,072* | |||||
| C-reaktivt protein | 0,197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0.077* | ||||
| eGFR | 0.080* | -0.028 | 0.163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0,054 | |||
| Proteinuri | 0,098* | 0,131** | -0,055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0,01.
Log-transformerat gamma-glutamyltransferas.
Log-transformerat alkaliskt fosfatas.
Mortalitet och andra händelser av intresse
Totalt 365 patienter (40 %) avled under studieperioden, med en mediantisk överlevnad för patientuppsättningen på 74 månader (tabell 3). Som förväntat var de vanligaste dödsorsakerna kardiovaskulära och infektioner, utan några signifikanta skillnader mellan undergrupperna (tabell 3).
Dödlighet och andra utfallsvariabler av intresse i gruppen som helhet och i undergrupperna enligt GGT och alkaliskt fosfatas (ALP).
| Total | Normal GGT och ALP | Hög GGT | Hög ALP | Hög GGT och ALP samtidigt | |
|---|---|---|---|---|---|
| Medianöverlevnadstid , månader | 74 | 86 | 61 | 82 | 38 |
| Dödsfall, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) |
| Dödsorsak, N (%): | |||||
| Plötslig | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) |
| Hjärt-kärl | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) |
| Infektiösa | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) |
| Malignitet | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) |
| Övriga | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) |
| Dialys, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) |
| Njurtransplantation, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) |
| Uppföljning saknas, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) |
Under uppföljningsperioden, 58 % av patienterna var tvungna att påbörja dialys och 15 % fick en njurtransplantation (det fanns inga förebyggande transplantationer). Inga skillnader observerades vare sig mellan undergrupperna när det gäller andelen patienter som påbörjade dialys, genomgick transplantation eller förlorades i uppföljningen (tabell 3).
Gamma-glutamyltransferas och alkaliskt fosfatas som bestämningsfaktorer för överlevnad
Figurerna 1 och 2 visar Kaplan-Meier-överlevnadskurvorna enligt frekvensfördelningskvartilerna för GGT- respektive ALP-värdena. Patienter med höga GGT- eller ALP-nivåer (övre kvartiler) hade sämre överlevnad.
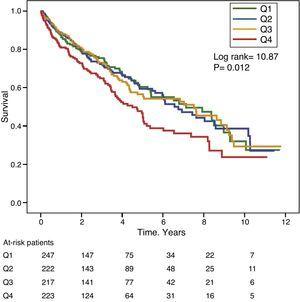
Kaplan-Meier överlevnadskurvor enligt frekvensfördelningskvartiler för GGT-nivåer i serum (Q, kvartiler).
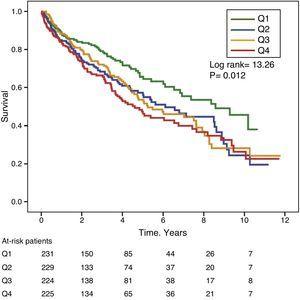
Kaplan-Meier överlevnadskurvor enligt frekvensfördelningens kvartiler av ALP-nivåer i serum. (Q=kvartiler).
Med hjälp av Cox-regressionsmodeller var GGT som kontinuerlig eller kategorisk variabel (övre kvartilen eller serumvärde >36IU/L) signifikant förknippat med ökad dödlighet i de analyserade modellerna (tabell 4). ALP var också signifikant och oberoende förknippat med ökad dödlighet i alla analyserade modeller, utom om ALP ingick i den bäst anpassade modellen som en kategorisk variabel definierad som värdet i den övre kvartilen. I denna modell nådde graden av association mellan ALP och mortalitet inte statistisk signifikans (P=0,052) (tabell 4).
Cox regressionsmodeller för association med mortalitet.
| Variabel | Univariat HR (95 % CI) | Multivariat modell 1a HR (95 %) CI) | Multivariat modell 2b HR (95% CI) | Multivariat modell 3c HR (95% CI) |
|---|---|---|---|---|
| Log-transformerad GGT | 1.310 (1.154-1.489) P0.0001 |
1.260 (1.095-1.449) P0.0001 |
1.174 (1.005-1.371) P=0.042 |
1.166 (1.010-1.347) P=0.036 |
| GGT övre kvartil | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.788) P=0.004 |
1.329 (1.036-1.705) P=0.025 |
1.315 (1.064-1.714) P=0.013 |
| GGT>36IU/L | 1.513 (1.202-1.905) P0.0001 |
1.509 (1.185-1.923) P=0.001 |
1.393 (1.078-1.800) P=0.011 |
1.390 (1.089-1.779) P=0.009 |
| Log-transformerad ALP | 1.635 (1.278-2.093) P0.0001 |
1.479 (1.149-1.904) P=0.002 |
1.395 (1.061-1.833) P=0.017 |
1.327 (1.008-1.746) P=0.044 |
| ALP övre kvartil | 1.332 (1.062-1.670) P=0.013 |
1.288 (1.023-1.621) P=0.031 |
1.277 (1.001-1.630) P=0.049 |
1.261 (0.998-1.594) P=0.052 |
| ALP>120IU/L | 1.527 (1.197-1.947) P=0.001 |
1.419 (1.109-1.815) P=0.005 |
1.362 (1.048-1.770) P=0.021 |
1.305 (1.015-1.678) P=0.038 |
Justerat för ålder, kön, komorbiditetsindex, diabetes, rökning, leversjukdom, BMI, eGFR och studieperioder.
Justerad för alla kovariabler i modell 1 plus kalcium, fosfor, PTH, urinsyra, triglycerider, ALT, albumin och C-reaktivt protein.
Bäst anpassade modell som inkluderar alla variabler i modell 1 och 2 plus GGT eller ALP, med automatisk process för val av variabler.
Hasiskvoten (HR) för dödlighet hos patienter med höga GGT-nivåer (>36IU/L) (HR=1,39) var likartad med den som observerades hos patienter med höga ALP-nivåer (>120IU/L) (HR=1,31) i den fullt justerade modellen (tabell 4). Fig. 3 visar Kaplan-Meier-överlevnadskurvorna som illustrerar detta samband och den additiva effekten på minskad överlevnad av samtidigt hög GGT och ALP.
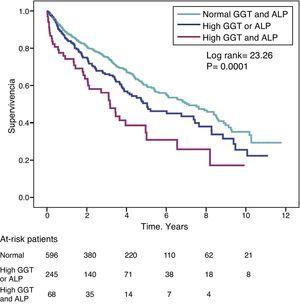
Kaplan-Meier överlevnadskurvor för studiepatienter enligt normala GGT- och ALP-nivåer, onormalt höga GGT- eller ALP-nivåer (den ena eller den andra) och samtidigt höga GGT- och ALP-nivåer.
För att utvärdera den möjliga förväxlingseffekten av leverkomorbiditet på sambandet mellan GGT och ALP med mortalitet konstruerades en Cox-regressionsmodell, med uteslutande av 27 patienter som tidigare diagnostiserats med leversjukdom. I denna anpassade modell upprätthöll hög GGT (>36IU/L) ett statistiskt signifikant samband med mortalitet (HR=1,316; 95% CI: 1,016-1,705; P=0,03), medan högt ALP (>120IU/L) visade ett samband på gränsen till statistisk signifikans (HR=1,296; 95% CI: 0,999-1,680; P=0,05).
Diskussion
Resultaten av den aktuella studien visar att förhöjt GGT eller ALP i serum är oberoende av varandra förknippat med högre dödlighet hos patienter med CKD. Denna studie visar också för första gången att samtidig förhöjning av båda parametrarna har en additiv effekt på förutsägelsen av mortalitet, även hos patienter utan leversjukdom.
I denna studie hade patienter med CKD och höga GGT-nivåer större komorbiditet, särskilt diabetes och hjärtsvikt, och en biokemisk profil som liknade den som observerades vid metaboliskt syndrom, även om BMI i denna undergrupp inte skiljde sig från BMI hos de övriga patienterna i studien.
Med tanke på ALP:s allmängiltiga natur i kroppen kan höga serumnivåer av detta enzym vara ett uttryck för olika patologiska processer. I denna mening kan bestämning av specifika ALP-isoenzymer vara användbart för att särskilja deras ursprung i fall där isolerade förhöjningar inte kan tillskrivas ökad benremodellering.
Den överdödlighet som rapporterats hos patienter med CKD och höga ALP-nivåer har kontroversiellt tillskrivits potentiella kardiovaskulära biverkningar som ett resultat av en mycket allvarlig brist på kontroll av ben-mineralmetabolismen.2,3,13,14 Flera patogena mekanismer har föreslagits för att förklara detta samband, bland annat ökad kärlförkalkning via pyrofosfathydrolys i artärväggen,15 systemisk inflammation16,17 och D-vitaminbrist.18 Avsaknaden av ett signifikant samband mellan serumnivåer av ALP:s isoenzym som härrör från benet (ben-specifikt ALP) och mortalitet hos patienter med CKD19 väcker dock allvarliga tvivel om hypotesen om ett patogent samband med ben-mineralmetabolismen.
I den här studien hade 11 % av patienterna förhöjda ALP-nivåer med normala GGT-nivåer, och det viktigaste kännetecknet för denna undergrupp var de höga medelvärdena för PTH-nivåerna, vilket tyder på att benet kan vara ursprunget till denna ALP-förhöjning. Samtidigt höga ALP- och GGT-värden kännetecknade dock en undergrupp av patienter med en högre grad av komorbiditet, främst kardiovaskulära sjukdomar, och en biokemisk profil som mer liknade den hos patienter med enbart höga GGT-värden än den hos patienter med enbart höga ALP-värden. Således kan man skilja mellan två riskprofiler hos patienter med CKD och högt ALP beroende på om de har höga GGT-nivåer eller inte. Medan hög ALP ensam var förknippad med en måttlig risk för dödlighet, var samtidig förhöjning av båda enzymerna förknippad med en högre risk för dödlighet.
GGT är det enzym som ansvarar för hydrolys av extracellulärt reducerat glutation (GSH), en av de viktigaste intracellulära antioxidanterna hos däggdjur, vilket gör det möjligt för prekursoraminosyrorerna att senare användas för ny intracellulär GSH-syntes.6 Ett ökat GGT är således ett uttryck för intracellulär GSH-utarmning och GGT kan därför betraktas som en markör för oxidativ stress.6
Serum GGT har visat sig vara en kardiometabolisk biomarkör i den allmänna befolkningen. I olika studier har man funnit ett signifikant, oberoende samband mellan GGT-nivåer och både kardiovaskulär dödlighet och dödlighet av alla orsaker.20-22 Höga GGT-nivåer har visat sig vara förknippade med en sämre prognos vid kranskärlssjukdom och hjärtsvikt.23,24 En möjlig patogen inblandning av GGT i bildandet av aterosklerotiska plack, dess erosion och efterföljande ruptur har också observerats,25 vilket skulle kunna bidra till att förklara förhållandet till kardiovaskulär sjuklighet och dödlighet ur biologisk synvinkel.
GGGT:s prediktiva värde hos CKD-patienter har knappt studerats. Postorino et al.9 observerade ett starkt, oberoende samband mellan höga GGT-nivåer och total och kardiovaskulär dödlighet hos 584 CKD-patienter i dialys. ALP-koncentrationer i serum bestämdes dock inte i denna studie.
I en annan studie var höga GGT-nivåer förknippade med uttalad endotelisk dysfunktion hos patienter med CKD, vilket tyder på en koppling mellan förhöjda nivåer av denna markör och risken för hjärt- och kärlsjukdomar.10
Förutom den möjliga systemiska pro-oxidativa effekten skulle andra hypoteser kunna bidra till att förklara sambandet mellan förhöjda GGT-nivåer och dödlighet hos patienter med CKD. Således kan hög GGT helt enkelt tyda på alkoholmissbruk eller leversjukdomar, komorbiditeter som skulle motivera den överdrivna mortaliteten. I den här studien behöll GGT dock ett signifikant samband med mortalitet efter att ha uteslutit patienter med kroniskt alkoholmissbruk, kroniska leversjukdomar eller hepatotropa virusinfektioner, vilket utesluter leversjukdomars exklusiva roll i det här sambandet.
Fetleversjukdom och kongestiv leversjukdom är dock två subkliniska leversjukdomar som kan orsaka höga GGT-nivåer.26,27 Fettleversjukdom är ett relativt vanligt fynd hos patienter med CKD och har ett närmare samband med kardiovaskulära riskfaktorer än utvecklingen av leverkomplikationer.27 De kliniska och biokemiska egenskaperna som är förknippade med fettleversjukdom liknar dem som observerades i den subgrupp av patienter i vår studie som hade hög GGT. I den här studien studerades dock inte diagnosen fettleversjukdom på ett adekvat sätt hos de flesta patienterna och det kan därför inte garanteras att högt GGT huvudsakligen berodde på denna sjukdom.
Kongestiv leversjukdom avser ett spektrum av leveravvikelser som tillskrivs den passiva överbelastning som är sekundär till högersidig hjärtsvikt eller någon annan orsak som höjer det centrala venösa trycket, inklusive volymöverbelastning, allvarlig lunghypertoni eller valvulopatier.28 Förhöjt serum GGT eller ALP är karakteristiska biokemiska avvikelser hos CKD-patienter med vänsterkammardiastolisk dysfunktion, särskilt om de är förknippade med pulmonell kongestion,29 vilket också är en erkänd riskfaktor för dödlighet hos dessa patienter.30
Ett förhöjt GGT kan också avspegla induktion av mikrosomala enzymer.31 Förutom alkoholintag kan många läkemedel inducera leverenzymer. I den här studien var inget av de läkemedel som oftast förskrivs till CKD-patienter signifikant förknippat med höga GGT- eller ALP-nivåer, även om den potentiella effekten av receptfria läkemedel (särskilt smärtstillande medel) på höga GGT-nivåer hos våra patienter inte kan uteslutas.
Denna studie har en rad begränsningar. Med tanke på dess retrospektiva utformning kunde orsakssamband inte fastställas. Studien genomfördes på en enda plats och den studerade kohorten var etniskt homogen (kaukasisk), även om den var representativ för den lokala befolkningen. GGT och ALP analyserades inte som tidsvarierande kovariater och därför är det troligt att den prognostiska betydelsen av övergående ökningar av GGT skiljer sig från ökningar som bibehålls över tid. I den här studien var dock upptäckten av hög GGT i tvärsnittsanalysen i ett visst skede av CKD förknippad med en klinisk fenotyp av stort intresse på grund av dess samband med kardiovaskulär komorbiditet och dödlighet. Slutligen mättes inte benspecifik ALP och andra parametrar som mer specifikt är relaterade till benremodellering.
Slutsatsen är att en onormalt förhöjd GGT-nivå är ett vanligt fynd hos patienter med CKD, som observeras oftare hos patienter med större komorbiditet, i synnerhet kardiovaskulära sjukdomar, och som är oberoende förknippat med mortalitet. Samtidigt förhöjda serum GGT och ALP ökar mortalitetsrisken. Därför kan kombinerad mätning av serum GGT med ALP ge ytterligare prediktiv information hos patienter med CKD.
Intressekonflikter
Författarna förklarar att det inte finns några intressekonflikter.