- Introduktion: Tidigare uppgifter om taxonomi för Cannabis har tidigare granskats (Russo, 2007) och kommer här att sammanfattas och kompletteras. Cannabis är en tvåårig ettårig växt av familjen Cannabaceae som traditionellt omfattar humle, Humulus spp. Alternativt har Cannabis också hänförts till Moraceae, Urticaceae eller till och med till Celtidaceae-familjerna på grundval av kartor över kloroplastens restriktionsställen (Weigreffe et al., 1998) och sekvenser av kloroplastens mat K-gen (Song et al., 2001). På senare tid har Cannabaceae underordnats åtta släkten: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema och Parasponia, som omfattar 170 udda arter (McPartland, 2018), ett resultat som stöds av genetisk analys av fyra plastidloci (Yang et al., 2013). Aktuell forskning om fossila pollenprover i samband med de ekologiska associationerna av Cannabis med stäppkompanjoner (Poaceae, Artemisia, Chenopodiaceae) och Humulus (humle) med skogssläkten (Alnus, Salix, Populus) har fastställt att även om Cannabis tycks ha sitt ursprung på den tibetanska högplatån för minst 19,6 miljoner år sedan, så har den också varit inhemsk i Europa i minst en miljon år (McPartland et al, 2018), och har motbevisat den konventionella visdomen att denna ”lägerföljare” fördes dit av människan.
- Cannabisgenomet och alternativ biokemisk produktion av värddjur
- Cannabis Synergy
- Författarens bidrag
- Intressekonfliktutlåtande
- Acknowledgments
Introduktion: Tidigare uppgifter om taxonomi för Cannabis har tidigare granskats (Russo, 2007) och kommer här att sammanfattas och kompletteras. Cannabis är en tvåårig ettårig växt av familjen Cannabaceae som traditionellt omfattar humle, Humulus spp. Alternativt har Cannabis också hänförts till Moraceae, Urticaceae eller till och med till Celtidaceae-familjerna på grundval av kartor över kloroplastens restriktionsställen (Weigreffe et al., 1998) och sekvenser av kloroplastens mat K-gen (Song et al., 2001). På senare tid har Cannabaceae underordnats åtta släkten: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema och Parasponia, som omfattar 170 udda arter (McPartland, 2018), ett resultat som stöds av genetisk analys av fyra plastidloci (Yang et al., 2013). Aktuell forskning om fossila pollenprover i samband med de ekologiska associationerna av Cannabis med stäppkompanjoner (Poaceae, Artemisia, Chenopodiaceae) och Humulus (humle) med skogssläkten (Alnus, Salix, Populus) har fastställt att även om Cannabis tycks ha sitt ursprung på den tibetanska högplatån för minst 19,6 miljoner år sedan, så har den också varit inhemsk i Europa i minst en miljon år (McPartland et al, 2018), och har motbevisat den konventionella visdomen att denna ”lägerföljare” fördes dit av människan.
Arttillhörigheten för Cannabis i sig är mycket omdiskuterad. Cannabis sativa, som betyder ”odlad Cannabis”, namngavs så av bland annat Fuchs år 1542 (Fuchs, 1999), en tilldelning 211 år före systematiseringen av botaniska binomialer Linnaeus i hans Species Plantarum (Linnaeus, 1753). Lamarck föreslog senare Cannabis indica, en mer diminutiv berusande indisk växt från Indien, som en separat art (Lamarck, 1783). Frågan har förblivit olöst under de följande århundradena med två motsatta filosofier. Ernest Small har förespråkat konceptet med en enda art (Small och Cronquist, 1976). Polytypiska behandlingar av Cannabis fick också anhängare (Schultes et al., 1974; Anderson, 1980) på grundval av morfologiska kriterier som tyder på separation av Cannabis sativa L. Cannabis indica Lam. och Cannabis ruderalis Jan., ett schema som stöds av systematisk kemotaxonomi. Huvudkomponentanalys (PCA) av 157 Cannabis accessioner från hela världen bedömde allozymfrekvenser vid 17 genloci och föreslog en uppdelning (Hillig, 2005b). ”Sativa”-genpooler från östeuropeiska ruderalprover var kopplade till europeiska och centralasiatiska fiber- och fröplantor med smalbladiga blad, medan en ”indica”-gruppering omfattade frö- och fiberplantor från Fjärran Östern och narkotikaplantor med bredbladiga blad från större delen av resten av världen, tillsammans med vilda accessioner från den indiska subkontinenten. Prov från vägkanten i Centralasien (Cannabis ruderalis) ansågs representera en tredje grupp. Studier med gaskromatografi (GC) och stärkelse-gelelektrofores tyder också på artskillnad mellan sativa och indica (Hillig och Mahlberg, 2004).
Agronomiska faktorer i 69 prover tyder på att östlig hampa och narkotikaväxter inkluderas i Cannabis indica (Hillig, 2005a), en indelning som stöds av fragmentlängdspolymorfismer (Datwyler och Weiblen, 2006).
Nyligen tycktes PCA peka på terpenoidinnehållet som de mest övertygande särskiljande kemotaxonomiska markörerna mellan förmodade sativa- och indica-arter (Elzinga et al, 2015). På samma sätt ansågs PCA skilja narkotika Cannabis från hampa (Sawler et al., 2015). I en nyligen genomförd studie påvisades en avgränsning av Cannabis drog från hampaccessioner via genotypning av 13 mikrosatellitloci i hela genomet, inte bara gener som påverkar cannabinoid- eller fiberproduktion (Dufresnes et al., 2017). Professor Giovanni Appendino har rapporterat förekomsten av stereoisomeren cis-Δ9-THC endast i hampaccessioner (Giovanni Appendino, personlig kommunikation). Dessa distinktioner kan dock mycket väl gå förlorade med tanke på den nuvarande trenden att korsa hampa med narkotikasorter för att undvika lagstadgade restriktioner för THC-innehållet.
Kontroversen om Cannabis-arter, Cannabis sativa vs. indica vs. afghanica, har fortsatt med oförminskad styrka ända fram till i dag, med passionerade argument som framförs av protagonisterna (Clarke och Merlin, 2013, 2016; Small, 2015; McPartland och Guy, 2017; Small, 2017). Den här författaren, som har befunnit sig på varje sida av frågan vid en eller annan tidpunkt, har valt att undvika den oförsonliga taxonomiska debatten som en onödig distraktion (Piomelli och Russo, 2016) och snarare betona att endast biokemiska och farmakologiska distinktioner mellan Cannabis-accessioner är relevanta. I sin nyligen publicerade seminala översikt höll McPartland med: ”Att kategorisera Cannabis som antingen ’Sativa’ och ’Indica’ har blivit en övning i meningslöshet. Allestädes närvarande korsning och hybridisering gör deras distinktion meningslös.” (McPartland, 2018) (s. 210).
En ytterligare icke-sinnig nomenklaturkontrovers gäller i allmänt språkbruk Cannabis ”stammar”, en benämning som är lämplig för bakterier och virus, men inte för växter (Bailey och Bailey, 1976; Usher, 1996; Brickell et al., 2009), i synnerhet när det gäller Cannabis där den kemiska sorten, förkortad ”chemovar” är den mest lämpliga benämningen (Lewis et al, 2018).
Cannabisgenomet och alternativ biokemisk produktion av värddjur
2011 var ett milstolpeår för Cannabisgenomik, då Medical Genomics och Nimbus Informatics publicerade en onlinerapport om den kompletta genomsekvensen på 400 miljoner baspar, som kort därefter fick sällskap av ett utkast till genom och transkriptom (van Bakel et al., 2011).
Denna utveckling utlöste framträdande publicitet och kontroverser om vad den kunde förebåda. Medan det mänskliga genomet analyserades cirka 20 år tidigare var konsekvenserna för cannabis föremål för stora spekulationer.
Nyheten katalyserade ett uppsving för ny forskning, men avsevärda framsteg hade redan gjorts inom tillämpad cannabisgenetik. Identifieringen och syntesen av Δ9-tetrahydrocannabinol (THC) genomfördes i Israel 1964 (Gaoni och Mechoulam, 1964), men det dröjde tills långt senare innan man lyckades klona dess biosyntetiska enzym, tetrahydrocannabinolsyra-syntas (THCA-syntas) (Sirikantaramas et al., 2004; figur 1). Enzymkristallisering följde (Shoyama et al., 2005). Cannabidiolsyra-syntas, som katalyserar cannabidiolsyra (CBDA), föregångaren till cannabidiol (CBD), hade tidigare identifierats och producerats i ren form (Taura et al., 1996; figur 1). Denna utveckling stimulerade ytterligare upptäckter, inklusive den arkeologiska fytokemiska upptäckten av THCA-syntas i en 2700 år gammal Cannabis-cache från en grav i Centralasien tillsammans med två tidigare orapporterade singelnukleotidpolymorfismer (SNP) i enzymets gensekvens (Russo et al., 2008).
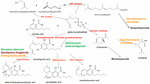
Figur 1. Biosyntetiska vägar och enzymer (röda) hos Cannabis sativa, vilket indikerar den naturliga arten Helichrysum umbraculigerum och alternativa arter (i färg) som har modifierats genetiskt för att producera efterföljande produkter .
För 2011 hade enzymerna för produktion av de viktigaste fytocannabinoiderna identifierats. På samma sätt har selektiv avancerad mendelsk förädling gett cannabissorter som är rika på specifika enskilda komponenter. Således producerades växter med hög THC- och hög CBD-halt för läkemedelsutveckling (de Meijer et al., 2003; de Meijer, 2004), med analog förädling av linjer med hög halt av cannabigerol (CBG) (de Meijer och Hammond, 2005) och cannabichromene (CBC) (de Meijer et al., 2009a). Den selektiva förädlingen utvidgades också till propylfytocannabinoidanaloger, tetrahydrocannabivarin (THCV), cannabidivarin (CBDV), cannabigerivarin (CBGV) och cannabichromivarin (CBCV) (de Meijer, 2004). Tillgången till växter med höga titrar av dessa ”mindre cannabinoider” förebådar intressanta nya farmaceutiska tillämpningar (Russo, 2011; Russo och Marcu, 2017).
Access till cannabismaterialets genom kan förenkla produktionen av THC-knockout-plantor via CRISPR-teknik (clustered regularly-interspaced short palindromic repeats). Även om detta skulle kunna vara attraktivt för industriell hampaförädling har en tidigare generation av växtodling redan gett hampsorter som lätt uppfyller internationella restriktioner som kräver 0,1 % eller mindre THC-halt (Wirtshafter, 1997; McPartland et al., 2000; Small och Marcus, 2003). Faktum är att cannabinoidfri cannabis utan funktionellt cannabigerolsyrasyntas (figur 1) också har producerats konventionellt (de Meijer et al., 2009b). Det är alltså fortfarande oklart om genteknik av cannabis ens är nödvändig för denna växt vars otroliga plasticitet redan uppvisar en riklig biokemisk mångfald. Införandet av genetiskt modifierad organism (GMO) Cannabis skulle väcka betydande kontroverser bland vissa delar av befolkningen, och sannolikt framkalla en flora av rättsliga förvecklingar om patent- och avelsrättigheter.
Det är lätt att föreställa sig ytterligare en rad olika science fiction-scenarier. På 1990-talet spred en bluff på Internet ryktet att en apokryf professor Nanofsky hade infört gener för THC-produktion i apelsiner (Citrus x. sinensis (L.) Osbeck). Även om detta skulle kunna vara tekniskt möjligt, skulle ett sådant försök inte vara mer än en laboratoriekarnevalshandling med tanke på den enorma cannabinoidproduktionen från själva cannabisen. En smygande pepparmynta (Menthax piperita Lamiaceae) med olagliga fytocannabinoider i bladens trikomer skulle kunna vara ett mer logiskt val för sådana underjordiska subversiva dagdrömmar och skicka rhizomer och utlöpare längs vattendrag över hela världen.
Precisa påståenden om produktion av cannabidiol från humle (Humulus lupulus L. Cannabaceae) och lin (Linum usitatissimum L. Linaceae) är ogrundade, men cannabigerolsyra och cannabigerol upptäcktes i sydafrikanska Helichrysum umbraculigerum Less. Asteraceae (Bohlmann och Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; figur 1), men utan hänvisning till dess koncentration. Detta påstående bekräftades nyligen med spårmängder som observerades från torkade prover av luftdelar (Mark Lewis, personlig kommunikation).
Eftersom komplexiteten i den rent de novo biokemiska syntesen av cannabinoider har ansetts vara icke kostnadseffektiv (Carvalho et al., 2017) har alternativa mikrobiella värdar föreslagits (Zirpel et al., 2017). År 2004 uppnåddes cDNA-kloning av THCA-syntas som möjliggör omvandling av cannabigerolsyra (CBGA) till THC (Sirikantaramas et al., 2004), och en 8-procentig THCA-produktion i håriga tobaksrötter (Nicotiana tabacum cv. Xanthi Solanaceae) påvisades vid utfodring med CBGA (figur 1). Enzymet uttrycktes också i insekten Spodoptera frugiperda (J.E. Smith) Noctuidae (höstmask) via ett rekombinant baculovirus. Därefter övergick forskargruppen till jäst, Pichia pastoris (nu Komagataella phaffii Phaff Saccharomycetaceae) (Taura et al., 2007; figur 1), och uppnådde en omvandling av CBGA till THCA på 98 % under 24 timmar, med en avkastning på 32,6 mg/L medium. En rekombinant form av THCA-syntas visade sig vara 4,5 gånger effektivare än i Cannabis och 12 gånger effektivare än i S. frugiperda. Denna process optimerades senare med en 64,5-faldig förbättring av aktiviteten (Zirpel et al., 2018), med en rapporterad produktion i K. phaffii av 3,05 g/L THCA efter 8 timmars inkubation vid 37 °C. En enkel beräkning ger att denna avkastning också skulle kunna uppnås från extraktion av bara 15 g 20 % THCA urbant Cannabis.
Produktion av terpenoider från Cannabis är på samma sätt möjlig i alternativa värdar. Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae mutanter med brist på enzymet farnesyldifosfat-syntas ackumulerar istället geranylpyrofosfat, som överförs till produktion av den medicinskt användbara terpenoiden linalool (Oswald et al., 2007; figur 1). På samma sätt har andra forskare utnyttjat biosynteskapaciteten hos mitokondrier i S. cerevisiae för att öka produktionen av farnesyldifosfat av sesquiterpenoider (Farhi et al., 2011), även om det inte rör sig om sådana som är gemensamma för Cannabis.
För närvarande är de existerande genomsekvenserna för Cannabis inte fullständigt annoterade. Följaktligen kommer det att krävas tillämpad förkunskap och detektivarbete för att få fram praktiska data om genetiska funktioner i Cannabis. Den största potentialen i en sådan undersökning kommer att ligga inom området epigenetik, underliggande ärftliga förändringar i genuttryck eller växtens fenotyp. Den mest framträdande bristen är bristen på kunskap om regleringen av cannabinoidproduktionen. Förståelsen av biosyntetiska vägar och reglering av terpensynteser som producerar cannabisterpenoider har knappt påbörjats (Booth et al., 2017) och förblir mogna mål för ytterligare forskning (Russo, 2011).
Ett ytterligare problem inom cannabishanteringen förblir bristen på verifikationsexemplar (som är förbjudna av US Drug Enforcement Administration utan Schedule I-licens) och formella depositioner av kemovartillgångar i frö- och vävnadsförvaringsanläggningar. Det senare har åstadkommits av GW Pharmaceuticals och oberoende av NaPro Research (Lewis et al., 2018) i National Collection of Industrial, Food and Marine Bacteria (NCIMB) i Skottland. Många privata företag har undvikit att dela med sig av germplasma på grund av juridiska restriktioner och rädsla för förlust av immateriella rättigheter.
Cannabis Synergy
In 1998 hävdade professorerna Raphael Mechoulam och Shimon Ben-Shabat att endocannabinoidsystemet uppvisade en ”entourageeffekt” där en mängd ”inaktiva” metaboliter och närbesläktade molekyler märkbart ökade aktiviteten hos de primära endogena cannabinoiderna, anandamid och 2-arachidonoylglycerol (Ben-Shabat et al, 1998). De postulerade också att detta bidrog till att förklara varför botaniska läkemedel ofta var mer effektiva än deras isolerade komponenter (Mechoulam och Ben-Shabat, 1999). Även om syntesen av en enda molekyl förblir den dominerande modellen för läkemedelsutveckling (Bonn-Miller et al, 2018), har begreppet botanisk synergi utförligt demonstrerats samtidigt, med åberopande av de farmakologiska bidragen från ”mindre cannabinoider” och cannabisterpenoider till växtens övergripande farmakologiska effekt (McPartland och Pruitt, 1999; McPartland och Mediavilla, 2001; McPartland och Russo, 2001, 2014; Russo och McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). Flera relevanta exempel på entourageeffekten inom cannabis är illustrativa:
I en randomiserad kontrollerad studie av oromukosala cannabisbaserade extrakt hos patienter med svårbehandlad smärta trots optimerad opioidbehandling lyckades ett THC-dominerande extrakt inte skilja sig positivt från placebo, medan ett helväxtextrakt (nabiximols, vide infra) med både THC och cannabidiol (CBD) visade sig vara statistiskt signifikant bättre än båda (Johnson et al, 2010), där den enda framträdande skillnaden var förekomsten av CBD i det senare.
I djurstudier av analgesi ger rent CBD en bifasisk dosresponskurva så att mindre doser minskar smärtresponsen tills en topp nås, varefter ytterligare ökningar av dosen är ineffektiva. Intressant nog eliminerar tillämpningen av ett Cannabis-extrakt med fullt spektrum och motsvarande doser CBD det bifasiska svaret till förmån för en linjär dos-responskurva så att det botaniska extraktet är smärtstillande vid alla doser utan någon observerad takteffekt (Gallily et al, 2014).
En nyligen genomförd studie av flera humana bröstcancercellinjer i kultur och implanterade tumörer visade att en behandling med ett cannabisextrakt är överlägsen ren THC, vilket i det förstnämnda verkar bero på förekomsten av små koncentrationer av cannabigerol (CBG) och tetrahydrocannabinolsyra (THCA) (Blasco-Benito et al, 2018).
Antikonvulsiva effekter av cannabidiol noterades hos djur på 1970-talet med de första prövningarna på människor 1980 (Cunha et al., 1980). I ett nyligen genomfört experiment på möss med kramper inducerade av pentylenetetrazol användes fem olika cannabisextrakt med lika höga CBD-koncentrationer (Berman et al., 2018). Även om alla extrakt visade fördelar jämfört med obehandlade kontroller, observerades framträdande skillnader i biokemiska profiler av icke-CBD-cannabinoider, vilket i sin tur ledde till betydande skillnader i antalet möss som utvecklade tonisk-kloniska anfall (21,5-66,7 %) och överlevnadsfrekvenser (85-100 %), vilket belyser relevansen av dessa ”mindre” komponenter. Den här studien belyser behovet av standardisering vid läkemedelsutveckling, och även om den skulle kunna tolkas som ett stöd för den terapeutiska modellen med en enda molekyl (Bonn-Miller et al., 2018), krävs det en betoning på att komplexa botaniska produkter kan uppfylla amerikanska FDA-standarder (Food and Drug Administration, 2015). Specifikt har två cannabisbaserade läkemedel uppnått myndighetsgodkännande, Sativex®(nabiximols, US Adopted Name) i 30 länder och Epidiolex®i USA.
Frågan uppstår då: Kan ett cannabispreparat eller en enskild molekyl vara för ren och därmed minska den synergistiska potentialen? Nya uppgifter stöder detta som en tydlig möjlighet. Anekdotisk information från kliniker som utnyttjar cannabisextrakt med hög CBD-halt för att behandla svår epilepsi, såsom Dravet- och Lennox-Gastaut-syndrom, visade att deras patienter uppvisade en anmärkningsvärd förbättring av anfallsfrekvensen (Goldstein, 2016; Russo, 2017; Sulak et al., 2017) med doser som var mycket lägre än de doser som rapporterades i formella kliniska prövningar av Epidiolex, ett 97 % rent CBD-preparat där THC har tagits bort (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Denna observation har nyligen genomgått en metaanalys av 11 studier med sammanlagt 670 patienter (Pamplona et al., 2018). Dessa resultat visade att 71 % av patienterna förbättrades med CBD-dominanta cannabisextrakt jämfört med 36 % på renad CBD (p < 0,0001). Svarsfrekvensen vid 50 % förbättring av anfallsfrekvensen var inte statistiskt annorlunda i de två grupperna och båda grupperna uppnådde anfallsfri status hos cirka 10 % av patienterna. De genomsnittliga dagliga doserna skiljde sig dock markant åt i grupperna: 27,1 mg/kg/d för renad CBD jämfört med endast 6,1 mg/kg/d för CBD-rika cannabisextrakt, en dos som endast motsvarar 22,5 % av dosen för enbart CBD. Dessutom var förekomsten av milda och allvarliga biverkningar bevisligen högre hos patienter med renat CBD jämfört med patienter med CBD-rika extrakt (p < 0,0001), ett resultat som författarna tillskrev den lägre dosen som användes, vilket enligt deras uppfattning uppnåddes genom de synergistiska bidragen från andra entourageföreningar. Sådana observationer stöder hypotesen om större effektivitet för cannabisextrakt som kombinerar flera antikonvulsiva komponenter, såsom CBD, THC, THCA, THCV, CBDV, linalool och till och med caryofyllen (Lewis et al, 2018).
Dessa studier och andra ger en fast grund för Cannabissynergi och stöd för utveckling av botaniska läkemedel jämfört med utveckling av enskilda komponenter (Bonn-Miller et al., 2018) eller produktion via fermenteringsmetoder i jäst eller andra mikroorganismer. Ett exempel på kraften hos konventionell selektiv förädling illustreras (figur 2), i form av en Cannabis chemovar som kallas CaryodiolTM för sitt ökade innehåll av karyofyllen (0,83 %) som CB2-agonist, tillsammans med ett mycket gynnsamt THC:CBD-förhållande av typ III på 1:39,4. Ett sådant preparat förefaller kunna användas för behandling av många kliniska tillstånd, bland annat: smärta, inflammation, fibrotiska sjukdomar, missbruk, ångest, depression, autoimmuna sjukdomar, dermatologiska tillstånd och cancer (Pacher och Mechoulam, 2011; Russo, 2011; Xi et al., 2011; Russo och Marcu, 2017; Lewis et al., 2018). Att framställa en sådan kombination från mikrobiella källor kan kräva kombinationer av cannabinoider från flera jästarter och skulle därför utgöra en kombinationsprodukt som är föremål för en svår regleringsväg jämfört med cannabispreparat från extrakt från en enda art (t.ex. nabiximoler) som har accepterats som en enhetlig formulering i 30 länder över hela världen (Food and Drug Administration, 2015).
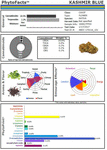
Figur 2. PhytoFactsTM-avbildning av innehållet av cannabinoider och terpenoider i CaryodiolTM, även kallad ”Kashmir Blue”, en typ III-, cannabidiol- och caryofyllenpredominant kemovar. Se (Lewis et al., 2018) för detaljer om PhytoFacts och konventionell förädlingsmetodik. Copyright© 2016 BHC Group, LLC. Alla rättigheter förbehållna. All obehörig användning av detta dokument eller bilderna eller märkena ovan kan bryta mot upphovsrätt, varumärken och andra tillämpliga lagar.
Denna artikel har kortfattat skisserat de nyligen teknologiska försöken att ”återuppfinna fytocannabinoidhjulet”. Starka argument skulle stödja att det kan göras, men bör det göras? De uppgifter som stöder förekomsten av cannabissynergi och den häpnadsväckande plasticiteten hos cannabismaterialets arvsmassa tyder på en verklighet som gör att det inte finns något behov av alternativa värdar, eller till och med av genteknik av Cannabis sativa, och som därmed bevisar att ”växten gör det bättre”.”
Författarens bidrag
Författaren bekräftar att han eller hon är den enda bidragsgivaren till detta arbete och har godkänt det för publicering.
Intressekonfliktutlåtande
Jag är forskningsledare för International Cannabis and Cannabinoids Institute. Vi betjänar kunder som är engagerade i cannabishandel.
Acknowledgments
Författaren uppskattar hjälpen från personalen vid University of Montana Inter-Library Loan Office of Mansfield Library för tillhandahållande av forskningsmaterial.
Anderson, L. C. (1980). Bladvariation bland Cannabis-arter från en kontrollerad trädgård. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: den sovande jätten i Medelhavets örtmedicin. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., and Bailey, E. Z. (1976). Hortus Third: A Concise Dictionary of Plants Cultivated in the United States and Canada. New York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). En entourageeffekt: inaktiva endogena fettsyreglycerolestrar förstärker 2-arachidonoyl-glycerol-cannabinoidaktiviteten. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). En ny ESI-LC/MS-metod för omfattande metabolisk profilering av fytocannabinoider i cannabis. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Bedömning av ”entourageeffekten”: antitumörverkan av en ren cannabinoid jämfört med ett botaniskt läkemedelspreparat i prekliniska modeller av bröstcancer. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., and Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S. och Vandrey, R. (2018). Utveckling av cannabis- och cannabinoidläkemedel: utvärdering av botaniska metoder kontra singelmolekylära metoder. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E. och Bohlmann, J. (2017). Terpen syntaser från Cannabis sativa. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). Internationell kod för nomenklatur för odlade växter. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S. och Stehle, F. (2017). Utformning av mikroorganismer för heterologisk biosyntes av cannabinoider. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., and Merlin, M. D. (2013). Cannabis: Evolution and Ethnobotany. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., and Merlin, M. D. (2016). Cannabis domesticering, avelshistoria, dagens genetiska mångfald och framtidsutsikter. Crit. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Kronisk administrering av cannabidiol till friska frivilliga och epileptiska patienter. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., and Weiblen, G. D. (2006). Genetisk variation i hampa och marijuana (Cannabis sativa L.) enligt amplified fragment length polymorphisms. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). ”The breeding of cannabis cultivars for pharmaceutical end uses”, i Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, and P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M. M., and Hammond, K. M. (2005). Arvet av kemisk fenotyp hos Cannabis sativa L. (II): cannabigeroldominanta växter. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Micheler, M. (2009a). Arvet av kemisk fenotyp hos Cannabis sativa L. (III): variation i andelen cannabichromener. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Sutton, A. (2009b). Arvet av kemisk fenotyp hos Cannabis sativa L. (IV): cannabinoidfria växter. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Försök med cannabidiol för läkemedelsresistenta anfall vid Dravet-syndromet. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol hos patienter med behandlingsresistent epilepsi: en öppen interventionsstudie. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Randomiserad, doseringsbaserad säkerhetsstudie av cannabidiol vid Dravets syndrom. Neurology 90, e1204-e1211. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J. och Fumagalli, L. (2017). Bredskalig genetisk mångfald av Cannabis för rättsmedicinska tillämpningar. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R. och Raber, J. C. (2015). Cannabinoider och terpener som kemotaxonomiska markörer i cannabis. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Utnyttjande av jästsubcellulära kompartment för produktion av växtterpenoider. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Vägledning för industrin om utveckling av botaniska läkemedel, ed. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). The Great Herbal of Leonhart Fuchs: De Historia Stirpium Commentarii Insignes, 1542 (Notable Commentaries on the History of Plants). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., and Hanus, L. (2014). Övervinna det klockformade dos-responset för cannabidiol genom att använda cannabisextrakt som är berikat med cannabidiol. Pharmacol. Pharm. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., and Mechoulam, R. (1964). Isolering, struktur och partiell syntes av en aktiv beståndsdel i hasch. J. Am. Chem. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Cannabis vid behandling av pediatrisk epilepsi. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). En kombinerad analys av agronomiska egenskaper och allozymallelfrekvenser för 69 Cannabis-tillgångar. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Genetiska bevis för artbildning hos Cannabis (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., and Mahlberg, P. G. (2004). En kemotaxonomisk analys av cannabinoidvariation hos Cannabis (Cannabaceae). Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., and Fallon, M. T. (2010). Multicenter, dubbelblind, randomiserad, placebokontrollerad, parallellgruppsstudie av effekten, säkerheten och tolerabiliteten hos THC:CBD-extrakt och THC-extrakt hos patienter med svårhanterlig cancerrelaterad smärta. J. Pain Symptom Manage. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., and Smith, K. M. (2018). Farmakologiska grunder för Cannabis chemovars. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., and Hegman, W. (2018). Cannabis är inhemskt i Europa och odlingen började under koppar- eller bronsåldern: en probabilistisk syntes av fossila pollenstudier. Veg. His. Archaeobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). Cannabis systematik på nivåerna familj, släkte och art. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., and Watson, D. P. (2000). Sjukdomar och skadedjur i hampa: Management and Biological Control. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., and Guy, G. W. (2017). Modeller för taxonomi av cannabis, kulturell bias och konflikter mellan vetenskapliga och folkliga namn. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., and Mediavilla, V. (2001). ”Non-cannabinoids in cannabis”, i Cannabis and Cannabinoids, eds F. Grotenhermen and E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., and Pruitt, P. L. (1999). Biverkningar av läkemedel som inte framkallas av jämförbara växtbaserade läkemedel: fallet med tetrahydrocannabinol och marijuana. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., and Russo, E. B. (2001). Cannabis och cannabisextrakt: större än summan av sina delar? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., and Russo, E. B. (2014). ”Non-phytocannabinoid constituents of cannabis and herbal synergy,” in Handbook of Cannabis, ed. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., and Ben-Shabat, S. (1999). Från gan-zi-gun-nu till anandamid och 2-arachidonoylglycerol: den pågående historien om cannabis. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N. och Karst, F. (2007). Monoterpenoidbiosyntes i Saccharomyces cerevisiae. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P. och Mechoulam, R. (2011). Är lipidsignalering genom cannabinoid 2-receptorer en del av ett skyddssystem? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., and Coan, A. C. (2018). Potentiella kliniska fördelar med CBD-rika cannabisextrakt jämfört med renad CBD vid behandlingsresistent epilepsi: metaanalys av observationsdata. Front. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., and Russo, E. B. (2016). Debatten om Cannabis sativa kontra Cannabis indica: en intervju med Ethan Russo, MD. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). Historien om cannabis och dess preparat i saga, vetenskap och sobriquet. Chem. Biodivers. 4, 1614-1648. doi: 10.1002/cbdv.20079010144
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2011). Att tämja THC: potentiella cannabissynergier och fytocannabinoidterpenoidterpenoida entourageeffekter. Br. J. Pharmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). Bortom cannabis: växter och det endocannabinoida systemet. Trends Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Cannabis och epilepsi: en gammal behandling återvänder till förgrunden. Epilepsy Behav. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Fytokemiska och genetiska analyser av gammal cannabis från Centralasien. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and Marcu, J. (2017). Cannabisfarmakologi: de vanliga misstänkta och några lovande ledtrådar. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and McPartland, J. M. (2003). Cannabis är mer än bara Delta(9)-tetrahydrocannabinol. Psychopharmacology 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). Den genetiska strukturen hos marijuana och hampa. PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., and Lockwood, T. (1974). Cannabis: ett exempel på taxonomisk försummelse. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Kristallisering av Delta1-tetrahydrocannabinolsyra (THCA)-syntas från Cannabis sativa. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). The gene controlling marijuana psychoactivity: molecular cloning and heterologous expression of Delta1-tetrahydrocannabinolic acid synthase from Cannabis sativa L. J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). Evolution och klassificering av Cannabis sativa (marijuana, hampa) i förhållande till människans användning. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: A Complete Guide. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., and Cronquist, A. (1976). En praktisk och naturlig taxonomi för Cannabis. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., and Marcus, D. (2003). Tetrahydrocannabinolnivåer i groddplantor av hampa (Cannabis sativa). Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y. (2001). Furnter evidence for the paraphyly of the Celtidaceae from the chloroplast gene mat K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., and Goldstein, B. (2017). Den nuvarande statusen för hantverksmässig cannabis för behandling av epilepsi i USA. Epilepsy Behav. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y. och Morimoto, S. (2007). Produktion av Delta(1)-tetrahydrocannabinolsyra med biosyntetiskt enzym utsöndrat från transgena Pichia pastoris. Biochem. Biophys. Res. Commun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S. och Shoyama, Y. (1996). Rening och karakterisering av cannabidiolsyra-syntas från Cannabis sativa L. Biokemisk analys av ett nytt enzym som katalyserar oxidocyklitiseringen av cannabigerolsyra till cannabidiolsyra. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol in patients with seizures associated with Lennox-Gastaut syndrome (GWPCARE4): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). The Wordsmith Dictionary of Botany. Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). Utkast till arvsmassa och transkriptom av Cannabis sativa. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J. och Guries, R. P. (1998). Ulmaceae, en familj eller två? Bevis från kartläggning av restriktionsställen i kloroplast-DNA. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Medicinsk cannabis: Är delta9-tetrahydrocannabinol nödvändigt för alla dess effekter? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). ”Nutritional value of hemp seed and hemp seed oil”, i Cannabis in Medical Practice, ed. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Hjärnans cannabinoida CB(2)-receptorer modulerar kokains verkan hos möss. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z. och Yi, T.-S. (2013). Molekylär fylogenetik och karaktärsutveckling hos Cannabaceae. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., and Stehle, F. (2017). Engineering yeasts as platform organisms for cannabinoid biosynthesis. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Optimering av produktion av Delta(9)-tetrahydrocannabinolsyra-syntas i Komagataella phaffii via posttranslationell flaskhalsidentifiering. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text
.