- Introduktion
- Epidemiologi
- Organismen och patofysiologin vid C. difficile-diarré
- Kliniska manifestationer
- Diagnos
- Practical Guidelines for Diagnosis of C. difficile Diarrheal Syndromes
- Endoskopisk diagnos av C. difficile-diarré och kolit
- Behandling
- Hantering av återkommande C. difficile-diarré
- Svår C. difficile-kolit
- Slutsats
Introduktion
Clostridium difficile-associerad diarré (CDAD) har med ökad frekvens uppmärksammats som en orsak till nosokomiala sjukdomar. Frekvensen och incidensen av CDAD varierar kraftigt och påverkas av flera faktorer, bland annat nosokomiala utbrott, mönster för användning av antimikrobiella medel och individuell känslighet. Det finns inga rapporter om prospektiva studier av sjukhus som spårar positivt toxin A eller A/B och resultaten av CDAD och dess komplikationer.
Centers for Disease Control and Prevention (CDC) har analyserat sekulära trender i incidensen av CDAD och rapporterade en stadig ökning från 1987 till 2001 (1). I denna rapport rapporterade 30 % av 440 smittskyddsläkare som deltog i en webbaserad enkät att de ser en högre frekvens av CDAD, allvarligare CDAD och mer recidiverande CDAD än tidigare. Det finns ett allmänt intryck av att andelen fall med allvarliga och dödliga komplikationer har ökat, och att återfallsfrekvensen bland de drabbade patienterna har ökat.
Förutom morbiditet och mortalitet är den ekonomiska bördan av C. difficile-infektion i form av fördröjda utskrivningar och andra sjukhuskostnader avsevärd.
Epidemiologi
Frekvensen och incidensen av CDAD varierar mellan sjukhusen och inom en viss institution över tid. Risken för sjukdom ökar hos patienter med antibiotikaexponering, gastrointestinal kirurgi, ökande vistelsetid på vårdinrättningar, allvarlig underliggande sjukdom, immunsupprimerande tillstånd och hög ålder.
C. difficile utsöndras i avföring. Alla ytor, anordningar eller material (t.ex. toalettstol, badkar och elektronisk rektal termometer) som kontamineras med avföring kan fungera som en reservoar för C. difficile-sporer. Sporer överförs till patienter huvudsakligen via händerna på vårdpersonal som har rört vid en kontaminerad yta eller ett kontaminerat föremål (2-6).
 klicka för stor version
klicka för stor version
Figur 1 . Digital röntgenbild från datortomografi visar nodulär haustal förtjockning i det tvärgående colon.
Organismen och patofysiologin vid C. difficile-diarré
C. difficile är en gram-positiv, anaerob, sporbildande bakterie som är ansvarig för utvecklingen av antibiotika-associerad diarré och kolit. C. difficile beskrevs första gången 1935 som en komponent i den fekala floran hos friska nyfödda barn och ansågs ursprungligen inte vara patogen (7). Bacillen fick namnet difficile eftersom den växer långsamt och är svår att odla. C. difficile är för närvarande ansvarig för nästan alla orsaker till pseudomembranös kolit och så många som 20 % av fallen av antibiotikaassocierad diarré utan kolit. Även om den bara finns i avföringen hos 5 % av befolkningen i allmänhet blir så många som 21 % av vuxna koloniserade med denna organism när de är inlagda på sjukhus (2,6).
En förändring av den normala kolonimikrofloran, vanligen orsakad av antibiotikabehandling, är den viktigaste faktorn som predisponerar för infektion med C. difficile. Nästan alla antibiotika har förknippats med C. difficile-diarré och kolit. De antibiotika som oftast förknippas är klindamycin, cefalosporiner, ampicillin och amoxicillin (tabell 1) (8).
Förutom antibiotikabehandling är högre ålder och svårighetsgraden av den underliggande sjukdomen viktiga riskfaktorer för C. difficile-infektion. Andra riskfaktorer är förekomsten av en nasogastrisk sond, gastrointestinala ingrepp, antisekretoriska läkemedel mot syror, vistelse på intensivvårdsavdelning och längden på sjukhusvistelsen (9).
C. difficile-diarré orsakas i första hand av utarbetandet av toxiner A och B som produceras av bakteriell multiplikation i tarmlumen. Dessa toxiner binder till kolonslemhinnan och utövar sina skadliga effekter på den. Organismen skadar sällan tjocktarmen genom direkt invasion, och diarré orsakas av effekterna av toxiner som produceras i tarmlumen och som fastnar på slemhinnans yta. De flesta toxigena isolat producerar båda toxinerna, och cirka 5-25 % av isolaten producerar varken toxin A eller B och orsakar inte kolit eller diarré (3-5).
Kliniska manifestationer
Infektion med C. difficile kan ge upphov till ett brett spektrum av kliniska manifestationer, inklusive asymtomatisk bärarskap, mild till måttlig diarré och fulminant sjukdom med pseudomembranös kolit (10). Hos patienter som utvecklar CDAD börjar symtomen vanligen snart efter kolonisationen. Kolonisering kan ske under antibiotikabehandling eller upp till flera veckor efter en antibiotikakur. CDAD är vanligtvis förknippad med passage av frekventa, lösa tarmrörelser som överensstämmer med proktokolit. Slem eller ockult blod kan förekomma, men synligt blod är sällsynt.
Diagnos
Diagnosen CDAD baseras på en historia av nyligen avslutad eller pågående antibiotikabehandling, utveckling av diarré eller andra tecken på akut kolit och påvisande av infektion med toxigena C. difficile, vanligen genom påvisande av toxin A eller toxin B i avföringsprov.
 klicka för stor version
klicka för stor version
Figur 1 . Digital röntgenbild från datortomografi visar nodulär haustal förtjockning i colon transversus.
Practical Guidelines for Diagnosis of C. difficile Diarrheal Syndromes
- Diagnosen bör misstänkas hos alla med diarré som fått antibiotika under de senaste 2 månaderna och/eller vars diarré börjar 72 timmar eller mer efter sjukhusvistelse.
- När diagnosen misstänks bör ett enda avföringsprov skickas till laboratoriet för testning för förekomst av C. difficile och/eller dess toxiner.
- När diarrén kvarstår trots ett negativt avföringstoxinresultat kan ett eller två ytterligare prover skickas för testning med samma eller olika tester (4). Endoskopi reserveras för speciella situationer, t.ex. när en snabb diagnos behövs och testresultaten dröjer eller när testet inte är högkänsligt, när patienten har ileus och avföring inte finns tillgänglig, eller när andra kolonsjukdomar också är aktuella.
Det finns ännu inget enkelt, billigt, snabbt, känsligt och specifikt test för att diagnostisera C. difficile-diarré och kolit, och alla tillgängliga tester är inte heller lämpliga att användas av alla laboratorier (tabell 2) (11).
Endoskopisk diagnos av C. difficile-diarré och kolit
Sigmoidoskopi och koloskopi är inte indicerade för de flesta patienter med CDAD (10,12). Endoskopi är dock till hjälp i speciella situationer, till exempel när diagnosen är tveksam eller den kliniska situationen kräver snabb diagnos. Resultaten av den endoskopiska undersökningen kan vara normala hos patienter med mild diarré eller visa ospecifik kolit i måttliga fall. Om man finner pseudomembraner i kolon hos en patient med antibiotikaassocierad diarré är det praktiskt taget patognomoniskt för kolit orsakad av C. difficile. Ett fåtal patienter utan några diagnostiska kännetecken i rectosigmoid har pseudomembraner i de mer proximala delarna av kolon (13). Andra endoskopiska fynd är erytem, ödem, bräcklighet och ospecifik kolit med små ulcerationer eller erosioner.
Behandling
Det första steget i hanteringen av C. difficile-diarré och kolit är att avbryta de utlösande antibiotika om möjligt (10,12). Diarréen försvinner hos cirka 15-25 % av patienterna utan specifik behandling mot C. difficile (14,15). Enbart konservativ behandling kanske dock inte är indicerad hos patienter som är systemiskt sjuka eller har flera medicinska problem, eftersom det är svårt att förutsäga vilka patienter som kommer att förbättras spontant. Om det inte är möjligt att avbryta det utlösande antibiotikumet på grund av andra aktiva infektioner bör patientens antibiotikakur om möjligt ändras så att man använder medel som är mindre benägna att orsaka CDAD (t.ex, aminoglykosider, trimetoprim, rifampin eller kinolon).
Antiperistaltiska medel, t.ex. difenoxylat plus atropin (Lomotil) eller loperamid (Imodium), och narkotiska smärtstillande medel bör undvikas, eftersom de kan fördröja bortförandet av toxiner från tjocktarmen och därmed förvärra den toxininducerade kolonskadan eller påskynda ileus och toxisk dilatation (12,16). Specifik behandling för att utrota C. difficile bör användas hos patienter med initialt allvarliga symtom och hos patienter vars symtom kvarstår trots att antibiotikabehandlingen avbryts. Även om diagnosen C. difficile-kolit helst bör fastställas innan antimikrobiell behandling sätts in, rekommenderar de nuvarande ACG-riktlinjerna att empirisk behandling bör sättas in i mycket suggestiva fall hos svårt sjuka patienter (tabell 3 på sidan 54) (12).
För närvarande betraktas oralt vankomycin eller metronidazol, som används i 7 till 10 dagar, som första linjens behandling av de flesta författare och nuvarande riktlinjer. Metronidazol i en dos på 250 mg 4 gånger dagligen rekommenderas av de flesta författare och ACG:s riktlinjer som förstahandsval för den initiala behandlingen av kolit orsakad av C. difficile (12). Dessa rekommendationer baseras till stor del på effektivitet, lägre kostnader och oro för utvecklingen av vankomycinresistenta stammar. Viktiga nackdelar med metronidazol är bland annat en mindre önskvärd läkemedelsprofil och kontraindikationer hos barn och gravida kvinnor.
Vancomycin, å andra sidan, i en dos på 125 mg 4 gånger dagligen, är säkert och väl tolererat och uppnår avföringsnivåer som är 20 gånger högre än den erforderliga minimala inhiberande koncentrationen för behandling av C. difficile. Nackdelar med användningen av vankomycin är kostnaden och potentiell utveckling av vankomycinresistenta stammar. I de nuvarande ACG-riktlinjerna anses vankomycin vara det bästa läkemedlet för svårt sjuka patienter och i de fall då användning av metronidazol är utesluten.
Kontrollerade kliniska prövningar saknas för patienter med fulminant kolit som kanske inte tolererar oral behandling. Administrering av metronidazol intravenöst eller administrering av vankomycin via nasogastrisk sond eller rektalt lavemang har beskrivits i små fallserier (17-20). Intravenös administrering av vankomycin rekommenderas inte, eftersom läkemedlet inte utsöndras i kolon (17).
Hantering av återkommande C. difficile-diarré
Trots framgångsrik initial behandling av CDAD får 15-20 % av patienterna återkommande diarré i samband med ett positivt avföringstest för C. difficile-toxin. Symptomatisk återkomst beror sällan på misslyckad behandling eller antimikrobiell resistens mot metronidazol eller vankomycin. Tillvägagångssätt för behandling omfattar konservativ behandling (många patienter är dock äldre och skröpliga och kan inte tolerera diarré), behandling med specifika anti-C. difficile-antibiotika, användning av anjonbindande hartser, behandling med mikroorganismer (probiotika) och immunglobulinbehandling.
Den vanligaste behandlingen av recidiverande C. difficile-diarré är en andra kur med samma antibiotikum som användes för att behandla den första episoden (12). I en stor observationsstudie i USA svarade 92 % av patienterna med återkommande CDAD framgångsrikt på en enda upprepad behandling, vanligen med metronidazol eller vankomycin (14). Det finns belägg för att patienter med en historia av recidiv har en hög risk för ytterligare episoder av CDAD efter att antibiotikabehandlingen har avbrutits. Det finns inga uppgifter som tyder på att sekventiella episoder blir progressivt allvarligare eller mer komplicerade (21). Olika behandlingsscheman har föreslagits för patienter med flera återfall av C. difficile-diarré. Ett tillvägagångssätt är att ge en långvarig kur med vankomycin (eller metronidazol) med hjälp av ett avtagande doseringsschema följt av pulsterapi (tabell 4).
Cholestyramin, ett anjonbytesharts som administreras i en dos av 4 gram 3 eller 4 gånger dagligen i 1-2 veckor, binder C. difficile-toxiner och kan användas tillsammans med antibiotika för att behandla upprepade återfall. Eftersom kolestyramin kan binda såväl vancomycin som toxiner bör det tas minst 2-3 timmar från vancomycinet.
Svår C. difficile-kolit
Incidensen av fulminant C. difficile-kolit har rapporterats vara 1,6-3,2 % (22). Även om nya exakta siffror från andra centra saknas, erkänns den som en ökande orsak till komplikationer och dödsfall. Det kliniska syndromet av fulminant C. difficile-kolit kan kännas igen med en ordentlig kunskap om sjukdomspresentationens spektrum.
A. Diarré: Även om diarré är kännetecknande för C. difficile-kolit är den inte alltid närvarande, och avsaknaden av diarré kan leda till diagnostisk förvirring. När diarré saknas verkar detta vara sekundärt till allvarlig dysmotilitet i kolonin. Även när diarré förekommer kan den uppfattas som en mindre komponent i en ospecifik septisk bild.
Figur 1 . Digital röntgenbild från datortomografi visar nodulär förtjockning i tjocktarmen.
Figur 2 . CT-bild av övre delen av buken bekräftar en markerad haustral förtjockning i colon transversum.
 Återges med tillstånd från BUMC Proceedings 1999; 12:249-250
Återges med tillstånd från BUMC Proceedings 1999; 12:249-250
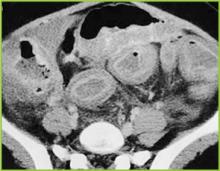
Figur 3 . CT-bild av mellersta buken visar en markant förtjockning av hela tjocktarmen. Milda inflammatoriska förändringar finns i det perikoloniala fettet.
B. Svår sjukdom: Fulminant kolit är en ovanlig form av C. difficile-infektion och förekommer hos endast 3 % av patienterna men står för praktiskt taget alla allvarliga komplikationer. Patienter med svårare former av sjukdomen kan uppträda med eller utan diarré. När patienterna utvecklar kolit som är lokaliserad till cecum och den högra sidan av tjocktarmen kan diarré vara minimal eller utebliven. I avsaknad av diarré kan de enda ledtrådarna till diagnosen vara systemiska tecken på toxicitet (feber, takykardi, leukocytos och/eller volymdepletion).
Ett förhöjt antal vita blodkroppar kan vara en viktig ledtråd till hotande fulminant kolit av C. difficile. Den snabba förhöjningen av det perifera antalet vita blodkroppar (vanligen så högt som 30 000 till 50 000) med ett betydande överskott av band och ibland mer omogna former föregår ofta hemodynamisk instabilitet och utveckling av organdysfunktion. Även hos patienter som är lindrigt symtomatiska under en längre tid kan plötslig och oväntad utveckling till chock inträffa. Det är svårt att förutsäga vilka patienter som inte svarar på medicinsk behandling. Därför kan tidiga varningssignaler, t.ex. en leukemoid reaktion, vara ovärderliga.
Hypotension är ett sent fynd och kan vara resistent mot vasopressorstöd. Abdominella tecken varierar från distension till generaliserad ömhet med bevakning. Kolonperforation åtföljs vanligen av abdominal rigiditet, ofrivillig vaksamhet, reboundömhet och uteblivna tarmljud. Fri luft kan synas på röntgenbilder av buken. Varje misstanke om perforation i denna situation bör föranleda omedelbar kirurgisk konsultation. Döden inträffar i allmänhet innan fri luft och perforering kan uppstå. I en studie, i motsats till den största delen av övrig litteratur, befanns perforation vara sällsynt (22).
Abdominalröntgen kan avslöja en dilaterad kolon (>7 cm i största diameter), vilket stämmer överens med toxisk megakolon. Patienter med megakolon kan ha en associerad tunntarmsileus med dilaterad tunntarm på vanliga bukröntgenbilder, med luft-vätskenivåer som efterliknar tunntarmsobstruktion eller ischemi. CT utan kontrast och endoskopi kan snabbt diagnostisera eller åtminstone starkt antyda fulminant C.difficile-kolit. CT-scanningen visar bl.a. tecken på ascites, förtjockning och/eller dilatation av kolonväggen. Dessa fynd kan vara till hjälp för att kategorisera kolitens svårighetsgrad.
Mer aggressivt ingripande hos medicinskt svarslösa patienter, inklusive snabb identifiering av patienter som inte svarar på medicinsk behandling, är avgörande för ett positivt utfall, och ett tidigt kirurgiskt ingripande bör göras i denna grupp (figur 1-3).
Det är viktigt att alla som är inblandade i patientvården på sjukhus, sjukhem och kvalificerade vårdcentraler får utbildning om organismen och dess epidemiologi, rationella tillvägagångssätt för behandling och vård av patienter med C. difficile-diarré, vikten av att tvätta händerna mellan kontakter med patienter, användning av handskar när man vårdar en patient med C. difficile-diarré och undvikande av onödig användning av antimikrobiella medel.
Slutsats
Under de senaste åren har man oroat sig över den ökande incidensen och de allvarliga komplikationsfrekvenserna av CDAD på nordamerikanska sjukhus (22,23). Tidskriften Canadian Medical Association publicerade 2004 en rapport om ett utbrott av CDAD där flera sjukhus i Montreal var inblandade. Införandet av nya hypervirulenta och mycket smittsamma stammar av C. difficile har postulerats som den möjliga orsaken till utbrottet (24). En försämrad infrastruktur, otillräckliga metoder för infektionskontroll, det ökande antalet försvagade patienter, en åldrande befolkning och hypervirulenta stammar ansågs vara sannolika bidragande orsaker till de senaste utbrotten i Kanada (25).
Två epidemiologiska undersökningar i USA och Kanada (24,26) undersökte oberoende av varandra prover av C. difficile och konstaterade att en muterad version av den ”vilda” stammen var ansvarig för utbrotten i Quebec och för ökade CDAD-frekvenser på sjukhusen i USA nyligen (22,23). Kliniska epidemiologer vid CDC undersökte isolat av C. difficile från sjukhus i USA med nyligen (dvs. 2001-2004) inträffade utbrott av CDAD (22,23). Rapporten visar på uppkomsten av en ny epidemisk stam, ”BI” (som skiljer sig från ”J”-stammen från 1989-1992), som kan vara ansvarig för den senaste tidens ökning av frekvensen och den uppenbara svårighetsgraden av CDAD (26).
CDAD och kolit kan i de flesta fall behandlas genom administrering av metronidazol eller vankomycin. Hos vissa patienter utvecklas allvarlig livshotande toxicitet trots lämplig och snabb medicinsk behandling, och ett kirurgiskt ingrepp är nödvändigt. Systemiska symtom vid infektion med C. difficile rapporteras inte härröra från bakteriemi, kolonperforation eller ischemi, utan från toxininducerade inflammatoriska mediatorer som frigörs från kolon (27-29). Tidigt kirurgiskt ingrepp bör användas i refraktära fall av allvarlig sjukdom. Kirurgiska ingrepp är dock långt ifrån idealiska och medför en mycket hög komplikationsfrekvens och en betydande risk för dödlighet (22). Det framtida kliniska tillvägagångssättet för behandling av nosokomial kolit orsakad av C. difficile kan så småningom inbegripa specifika antitoxinhyperimmunoglobuliner och hämmare av den inflammatoriska kaskaden (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Sekulär utveckling av sjukhusförvärvad Clostridium difficile-sjukdom i USA; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotikaassocierad kolit. In: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 4th ed. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarré: Patogenes, epidemiologi och behandling. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Historien om dess roll som enterisk patogen och det nuvarande kunskapsläget om organismen. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. In: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosokomiskt förvärv av Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: Med en beskrivning av en ny patogen anaerobe, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Behandling av Clostridium difficile-diarré och kolit. In: Wolfe MM, ed. Gastrointestinal farmakoterapi. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Riskfaktorer för Clostridium difficile-infektion. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Clostridium difficile kolit. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Clostridium difficile colitis. In: Lamont JT, ed. Gastrointestinala infektioner: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. American College of Gastroenetrology, Practice Parameters Committee. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Rectal sparing vid antibiotikaassocierad pseudomembranös kolit: En prospektiv studie. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Tio års prospektiv övervakning och behandling av Clostridium difficile-associerad sjukdom vid Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospektiv randomiserad studie av metronidazol jämfört med vankomycin för Clostridium-difficile-associerad diarré och kolit. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Loperamidrelaterad toxisk megakolon vid kolit orsakad av Clostridium difficile. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Adjunctive intracolonic vancomycin for severe Clostridium difficile colitis: case series and review of the literature. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Intravenös metronidazol för behandling av kolit orsakad av Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Återkommande Clostridium difficile-diarré: egenskaper och riskfaktorer hos patienter som deltog i en prospektiv, randomiserad, dubbelblind studie. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Fulminant Clostridium difficile: en underskattad och ökande orsak till dödsfall och komplikationer. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Clostridium difficile colitis: en alltmer aggressiv iatrogen sjukdom? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergence of an epidemic strain of Clostridium difficile in the United States, 2001-4: Potentiell roll för virulensfaktorer och antimikrobiell resistens. Infectious Diseases Society of America 42th Annual Meeting. Boston, MA, 30 september-3 oktober 2004. Abstract # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Cytokinrespons från mänskliga monocyter på Clostridium difficile toxin A och toxin B. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Ökade substans P-reaktioner i dorsalrotsganglier, tarmmakrofager under Clostridium difficile toxin A enterit hos råttor. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimulerar produktion av makrofag-inflammatoriskt protein-2 i tarmepitelceller från råttor. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Överlevnad av antiklostridium difficile immunoglobulinkoncentrat från nötkreatur i den mänskliga mag-tarmkanalen. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Intravenös immunglobulinbehandling vid svår kolit orsakad av Clostridium difficile. Gut. 1997;41:366-70.