- Vad gör en molekyl polär?
- Vis en titt på strukturformeln för koldioxid:
- Varför är vatten polärt?
Vatten är en polär molekyl eftersom dess syre är starkt elektronegativt och som sådant drar elektronparet mot sig själv (bort från de två väteatomerna) och får på så sätt en svagt negativ laddning.
En molekyls polaritet beror inte bara på dess beståndsdelar, utan också på hur de är arrangerade runt den centrala atomen, det vill säga den rumsliga placeringen av dessa atomer. För att förstå detta bättre ska vi diskutera ämnet närmare.
Vad gör en molekyl polär?
En molekyls polaritet är relaterad till förskjutningen av elektroner i en viss riktning. Detta beror i sin tur på polariteten hos de bindningar som finns i molekylen, eftersom dessa bindningar också innehåller elektroner.
I en molekyl har den atom som har större förmåga att dra till sig elektroner (dvs, den är mer elektronegativ än den andra atomen) kommer att få en lätt negativ laddning på sig själv, och bindningen mellan de två atomerna blir polär.
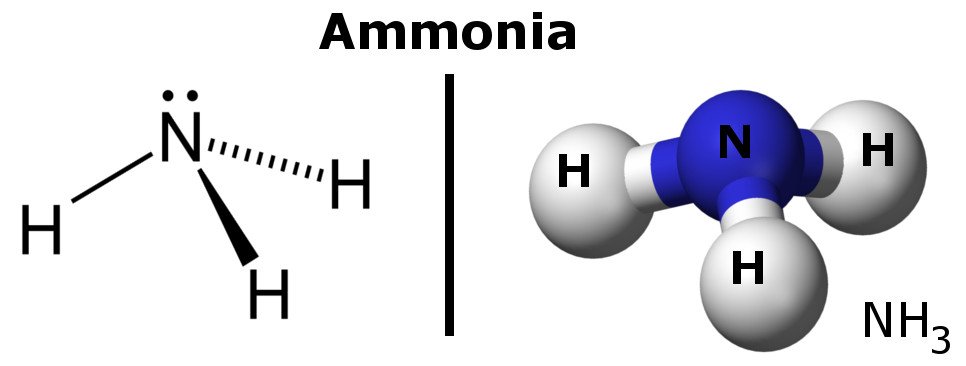
Ammoniak är en polär molekyl eftersom den har områden med lätta negativa och positiva laddningar.
Sammanfattningsvis kan man säga att elektrontätheten i en polär bindning ackumuleras mot den ena änden av bindningen, vilket resulterar i att den änden besitter en svagt negativ laddning, medan den andra änden har en svagt positiv laddning. Detta gör en molekyl polär.
På samma sätt anses en molekyl som opolär om den inte har områden med positiv och negativ laddning.
En intressant sak att notera är dock att ju större skillnaden i elektronegativitet är, desto mer polär blir bindningen inom en molekyl. Karbonylföreningar är polära eftersom karbonylkolet är något positivt. Borde alltså inte koldioxid, som innehåller ett positivt kol och två delvis negativa syreatomer, vara polär?
Nja, koldioxid består av två syreatomer som är bundna till en kolatom. Syreatomer är mycket mer elektronegativa än kolatomer, och som sådana borde de ha en delvis negativ laddning, medan kolatomen borde vara svagt positivt laddad. Intressant nog händer det dock inte.
Ta en titt på strukturformeln för koldioxid:
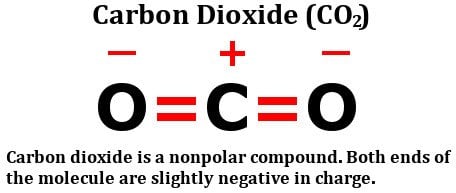
Den består av två lika elektronegativa syreatomer, ja, men titta på hur dessa atomer är arrangerade runt kolatomen. De står båda i perfekta 180 graders vinklar från kolet. Följaktligen drar de elektrontätheten från kolet med lika stor kraft i motsatt riktning. Nettoresultatet är att kolatomens elektrontäthet förblir opåverkad, vilket gör koldioxidmolekylen opolär.
Koldioxid är ett utmärkt exempel på hur en molekyls geometri spelar en avgörande roll när det gäller att avgöra om den är polär eller opolär. Låt oss nu ta en titt på en vattenmolekyl:
Varför är vatten polärt?
Vattens kemiska formel är H20, vilket innebär att det innehåller två väteatomer och en syreatom. Väteatomerna består bara av en elektron i sitt skal, medan syreatomen har 6 valenselektroner.
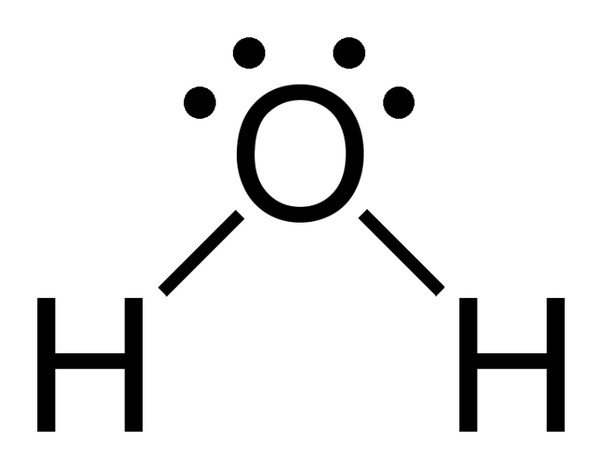
Bemärk de 2 ensamma elektronparen på syreatomen i vatten.
Då syre har 6 elektroner i sitt valensskal, delar den en elektron med varje väteatom. På så sätt har den 4 obundna elektroner kvar i sina 2 banor. Dessa bundna och obundna elektronpar arrangerar sig i en tetraederform runt syre, vilket är anledningen till att de två bindningarna verkar ha en böjd form.
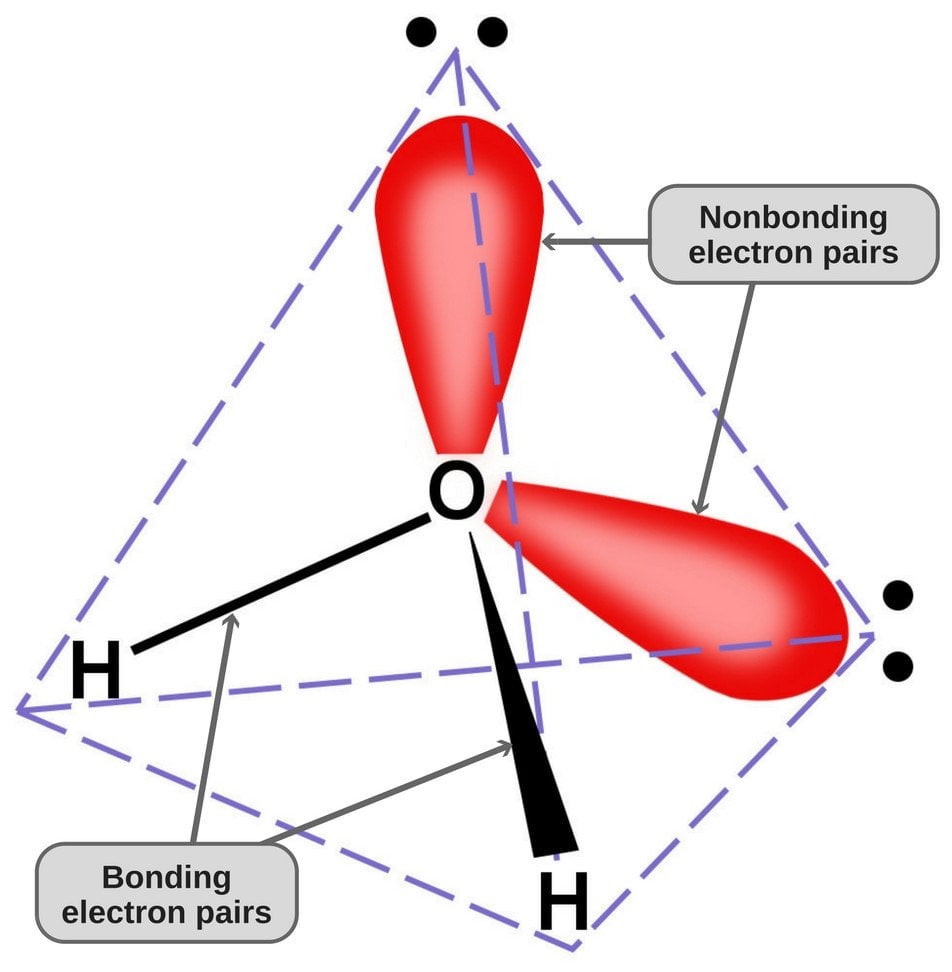
Vattenmolekylens tetraedriska geometri.
Nu har både syre- och väteatomer olika elektronegativitet (väte har en elektronegativitet på 2,1 medan syre har en elektronegativitet på 3,5); därför är båda bindningarna polära. Eftersom syre är mer elektronegativt än väte flyttas elektrontätheten mot syre i båda dessa bindningar, vilket gör området runt syre mer negativt än områdena runt de två väteatomerna.
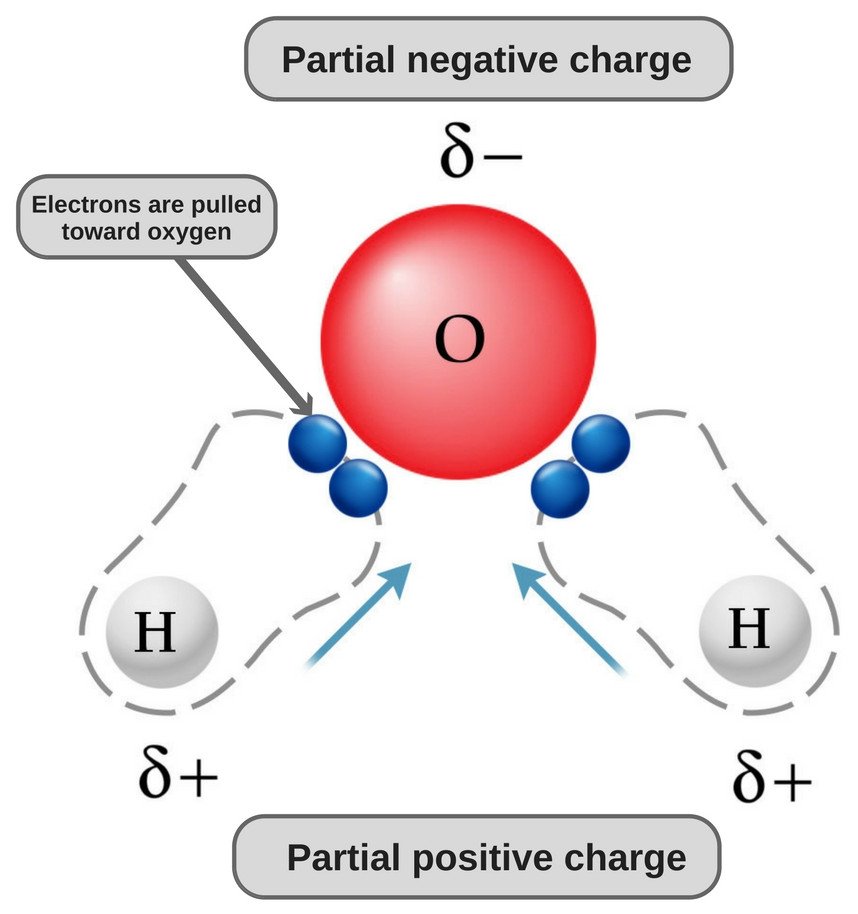
Detta är anledningen till att vattenmolekylen blir polär!