Glicogenul și amidonul, polimeri de glucoză de dimensiuni megadaltonice, reprezintă principalul rezervor de energie și compuși de carbon ușor de obținut în majoritatea organismelor vii. La mamifere, absorbția și utilizarea glucozei se află sub un control strict. Defectele în manipularea normală a glucozei sunt asociate cu o varietate de patologii umane, cum ar fi bolile de stocare a glicogenului și diabetul, în care hiperglicemia persistentă este corelată cu un debut timpuriu și o severitate crescută a bolii. Căile metabolice pentru conversia catalitică a glicogenului implică mai multe enzime, printre care glicogen-sintetaza catalizează alungirea, iar glicogen-fosforilaza descompunerea glucanilor cu legături a(1,4)-legate. În ultimii 30 de ani, în urma studiilor biochimice și structurale ale fosforilazelor glicogenului și maltodextrinei, s-a obținut o mare bogăție de informații privind degradarea glicogenului. Aceste studii au arătat că reglarea glicogen fosforilazei este un exemplu fascinant de alosterism covalent și necovalent, coordonat în mod rafinat de controlul hormonal. În prezent, sunt disponibile informații care descriu structurile terțiare și cuaternare pentru practic toate enzimele direct implicate în procesarea glicogenului. În mod surprinzător, au fost raportate foarte puține informații structurale despre glicogen sintetaza, care catalizează alungirea glicogenului prin adăugarea succesivă de reziduuri de glucoză ![]() -(1,4)-legate la capătul nereducător al polimerului, folosind ADP/UDP-glucoză ca donator de glucoză.
-(1,4)-legate la capătul nereducător al polimerului, folosind ADP/UDP-glucoză ca donator de glucoză.
Am determinat acum structura cristalină a glicogen-sintetazei de la Agrobacterium tumefaciens (AtGS) la o rezoluție de 2,3 Å, atât în forma sa apo, cât și în prezența ADP. Datele au fost colectate pe ID29, iar structura a fost rezolvată cu ajutorul tehnicii SAD (difracție anormală pe o singură lungime de undă), urmată de proceduri de modificare a densității. Proteina se găsește sub formă de dimer în unitatea asimetrică, fiecare monomer fiind alcătuit din două domenii „Rossmann-fold” (Figura 81) care sunt organizate la fel ca în structurile glicogen fosforilazei și ale altor glicozil transferaze din superfamilia GT-B . O fisură adâncă între cele două domenii conține centrul catalitic. O diferență majoră între glicogen-sintetazele mamiferelor (familia GT3) și cele bacteriene (GT5) constă în faptul că numai enzimele GT3 sunt puternic reglementate prin fosforilare și modulare alosterică necovalentă. Conform alinierilor de secvențe multiple bazate pe structură între secvențele GT3, GT5 și glicogen fosforilază, situsurile de fosforilare reglatoare din glicogeninaza umană sunt probabil localizate în inserțiile N-terminale de 25 de resturi și C-terminale de 120 de resturi, în afara nucleului GT-B nereglementat al glicogen sintazelor bacteriene. Studiile de mutageneză au identificat anterior două clustere Arg conservate în enzimele GT3 ca făcând parte din situsul (situsurile) alosteric(e) atât pentru reziduurile fosfo-Ser/Thr, cât și pentru activatorul necovalent Glc-6P. Reziduurile echivalente din AtGS sunt situate la un capăt al domeniului C-terminal, departe de centrul de reacție, ceea ce indică un efect de reglare la distanță.
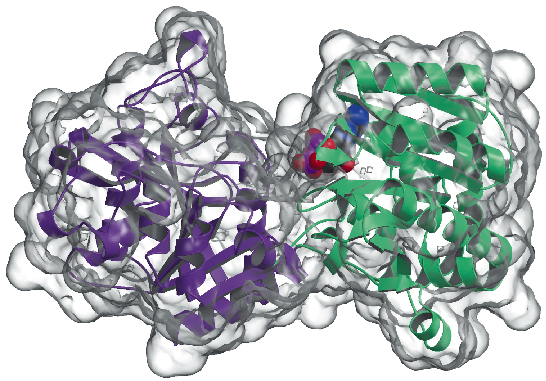
Fig. 81: Structura glicogen sintetazei: suprafața accesibilă solventului este reprezentată în transparent. Se remarcă molecula de ADP legată (desenată sub formă de bile VDW).
Structura AtGS prezintă o asemănare topologică izbitoare cu structurile de bază ale fosforilazelor de glicogen/ maltodextrină (familia GT35) (figura 82a), chiar dacă identitățile de secvență sunt scăzute (~14%). Structura fiecărui domeniu Rossmann-fold al AtGS este semnificativ mai apropiată de cele ale fosforilazelor din familia GT35 decât de orice altă glicozil transferază dependentă de nucleotide. Glicogen-sintetaza și fosforilazele prezintă, de asemenea, o asemănare puternică la situsurile lor catalitice (figura 82b). Riboza ADP și grupările piridoxal se află în poziții echivalente, la fel ca și fosfatul distal al ADP în AtGS și substratul de fosfat anorganic în fosforilaze. În plus, aminoacizii critici care interacționează cu fracțiunile de glucoză ale substraturilor sunt, de asemenea, conservate. Mecanismul catalitic utilizat de glicogen-sintetaze și fosforilaze este, prin urmare, probabil similar, modificările subtile de structură explicând proprietățile lor funcționale diferite în ansamblu.
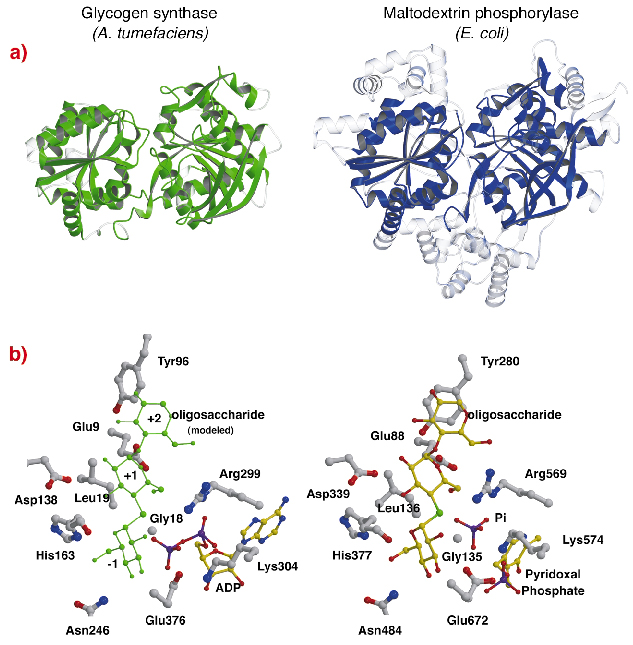
Fig. 82: Omologie cu glicogen-fosforilaza: (a) după alinierea structurală, reziduurile echivalente suprapuse între AtGS și maltodextrina fosforilază MalP din E. coli, sunt reprezentate în material solid (regiunile nealiniate, în transparent); (b) situsurile catalitice ale AtGS și MalP.
Sugestia inițială că sinteza glicogenului reprezenta pur și simplu o inversare a fosforolizei sale degradative s-a dovedit a fi eronată, deoarece Leloir a arătat că UDP-Glc și glicogen-sintetaza, nu Glc-1-P și glicogen-fosforilaza, erau responsabile pentru alungirea polizaharidelor . Cu toate acestea, lucrările noastre demonstrează acum că reacțiile independente opuse în interconversia glucoză-glicogen sunt catalizate de enzime omologe foarte apropiate.