Imunofluorescența (IF) este o abordare morfologică comună utilizată pentru a determina distribuția componentelor subcelulare. Anticorpii care se conjugă cu coloranți fluorescenți sunt necesari în testul IF. Anticorpul recunoaște în mod specific antigenul prin legarea la epitopul țintei, iar fluoroforul va fi detectat sub un microscop fluorescent. Prin urmare, componentele subcelulare pot fi vizualizate pe un fond întunecat. IF poate fi, de asemenea, utilizată ca o metodă alternativă de analiză semicantitativă pentru monitorizarea expresiei de interes.
Există trei tipuri de IF: IF directă, IF indirectă și IF combinată.
IF directă utilizează un singur anticorp primar care este conjugat cu un colorant fluorescent.
Indirect IF utilizează doi anticorpi pentru colorare: un anticorp primar care se leagă în mod specific de epitop și un anticorp secundar corespunzător, conjugat cu un colorant fluorescent.
Inf combinată este o combinație de colorare IF directă și indirectă.
Tabelul 1. Comparație între IF directă, indirectă și combinată.
| Tipul de IF | Directă | Indirectă | Combinată | |
|---|---|---|---|---|
| Schemă schematică | 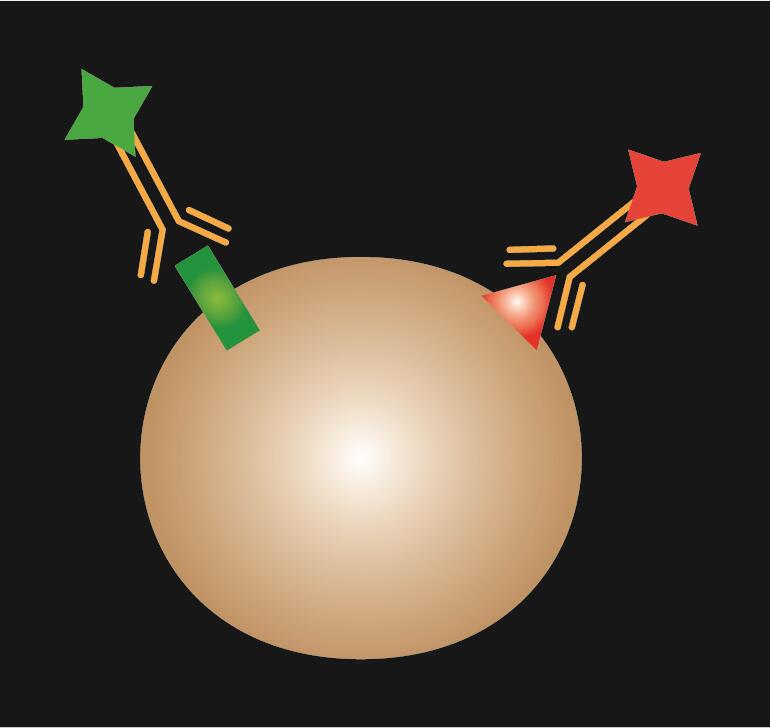 |
. 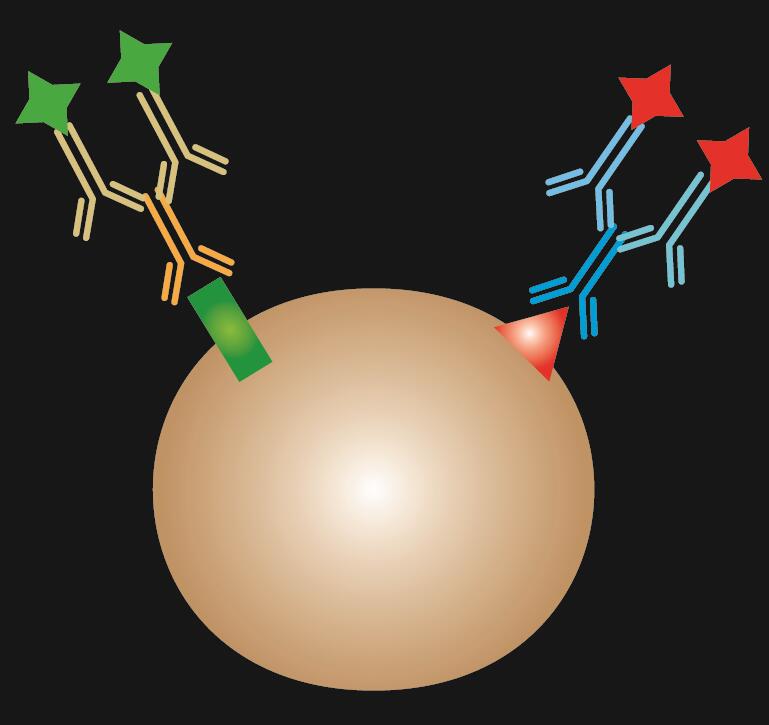 |
Ghid de imunofluorescență | |
| Avantaje |
|
. |
|
|
| Dezavantaje |
|
|
|
Printre cele trei tipuri de IF, metoda IF indirectă este cea mai populară.
Abordarea IF poate fi utilizată pe secțiuni de țesut, linii celulare cultivate și celule individuale. Procesul de IF este similar cu cel al imunohistochimiei (IHC).
- Colectarea și fixarea probelor
Eșantioanele trebuie fixate rapid după îndepărtarea țesutului și este mai bine să se efectueze prefixarea prin infuzie cardiacă cu formaldehidă 4% sau paraformaldehidă la animale mici, cum ar fi rozătoarele. Se recomandă ca țesuturile să nu fie mai groase de 10 mm, iar volumul fixatorului să fie de cel puțin 15-20 de ori mai mare decât volumul țesutului. Fixarea este foarte importantă pentru păstrarea morfologiei și structurii celulelor, precum și a integrității antigenului. Astfel, soluțiile de fixare trebuie să fie alese cu atenție în funcție de diferite antigene și probe de țesut.
Tabelul 2. Strategia de fixare pentru antigene parțiale.
| Antigen | Soluție de fixare | Condiție de fixare |
|---|---|---|
| Principala proteină | 95~100%. alcool 4% paraformaldehidă |
3~10 min la 37℃ 4~24 ore la 4℃ |
| Enzime | Acetonă | 15 min la RT |
| Hormona | 95% alcool plus 1~5% acid acetic glacial | 30 min la 4℃ |
| Globulină imunitară | 95% alcool Carbon. tetraclorură de carbon |
10 min la 37℃ apoi 15 min la 4℃ |
| Proteine fibroase | 95% alcool plus 1~5% acid acetic glacial | 10 min la 37℃ apoi 15 min la 4℃ |
| Virus | Acetonă Tetraclorură de carbon Alcool |
5~10 min la RT apoi 30~60 min la 4℃ |
| Polizaharide și bacterii | Acetonă 10% formaldehidă Metanol |
3~10 min la RT apoi 30~60 min la 4℃ |
| Lipoid | 10% formaldehidă | 3~10 min la RT |
| Celule cultivate | Celule încălzite cu paraformaldehidă 4% | 15~20 min. la RT |
- Deshidratare și încorporare
Deshidratarea este necesară la prepararea secțiunilor de țesut din următoarele motive:
1. Secțiunea de parafină: Parafina este imiscibilă cu apa.
2. Secțiunea congelată: Cristalele de gheață înghețate-dezghețate ar distruge morfologia celulelor.
Deshidratarea se realizează întotdeauna prin scufundarea țesutului într-o soluție serioasă de etanol cu gradient crescător de gradient sau într-o soluție de zaharoză.
Subiectiv, probele de țesut pot fi încorporate prin adăugarea de parafină topită pentru secțiuni de parafină, în timp ce pentru secțiunile congelate se adaugă compus OCT. Această etapă asigură o duritate adecvată pentru probele de țesut moale și permite ca țesutul să fie tăiat cu ușurință.
- Secțiune și colorare
Tesuturile înglobate pot fi secționate în felii subțiri cu microtomul sau microtomul de congelare. Grosimea feliilor trebuie decisă în funcție de diametrul celular și de scopul testului IF. Se sugerează ca feliile mai subțiri (≤10 μm) să se monteze direct pe lamele adezive înainte de colorare, deoarece acestea sunt ușor de împânzit în etapele multiple de spălare. Felii mai groase (10~30 μm) vor obține imagini mai bune prin utilizarea metodei de plutire liberă, deoarece anticorpul primar poate pătrunde prin ambele părți ale feliei. Iar secțiunile care plutesc liber sunt montate pe lame după colorare. Secțiunile plutitoare libere ale țesuturilor mici, cum ar fi rădăcina ganglionilor dorsali de șoarece (DRG), sunt dificil de realizat și este ușor de pierdut proba. Astfel, se recomandă metoda secțiunii de tip „stick” pentru unele probe de țesut de dimensiuni mici. Etapele de colorare trebuie efectuate la întuneric atunci când este implicat un anticorp conjugat cu un colorant fluorescent.
Întoarceți-vă la protocoale IF:
- Secțiune stick
- Secțiune flotantă liberă
- Celule cultivate
- Imagistică și analiză
Semnalizarea pozitivă este virtualizată la un microscop fluorescent pe fond întunecat. Locația de interes este determinată de obicei prin colorația în comun a unei proteine a cărei localizare a fost cunoscută. Alternativ, se poate măsura cantitatea de celule pozitive sau intensitatea fluorescenței semnalizării pozitive pentru o analiză cantitativă. De exemplu, intensitatea mai mare a fluorescenței se referă la o expresie relativ ridicată a proteinei țintă.
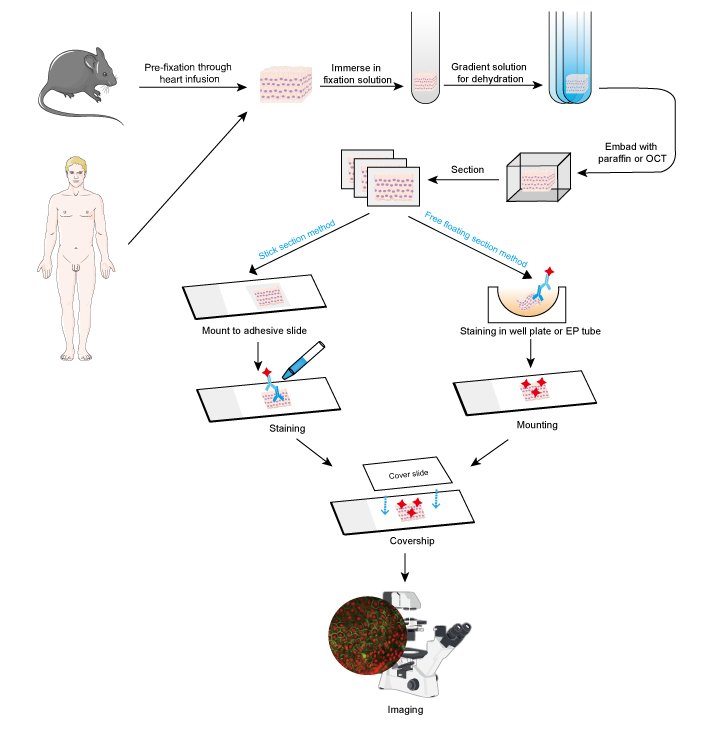
Figura 1. Fluxul de lucru al IF pe secțiuni tisulare.
Atât IF cât și IHC sunt abordări puternice pentru analiza morfologică cu aplicații importante de diagnostic și prognostic. Câteva diferențe trebuie să fie preocupate în cercetarea dumneavoastră:
Tabel 3. Comparație între IHC și IF
| IHC | IF | ||
|---|---|---|---|
| Metoda de marcare | Cromogenă | Fluorescentă | |
| Etapa de procesare | Mai mult ca substrat necesar | Mai puțin | |
| Imagine |
|
|
|
| Microscop | Microscop luminos | Microscop fluorescent | |
| Stabilitate | Stabil pentru ani | Mai puțin stabilă din cauza fotobleachingului | |
| Exemplu (hipocampus de șoarece) |
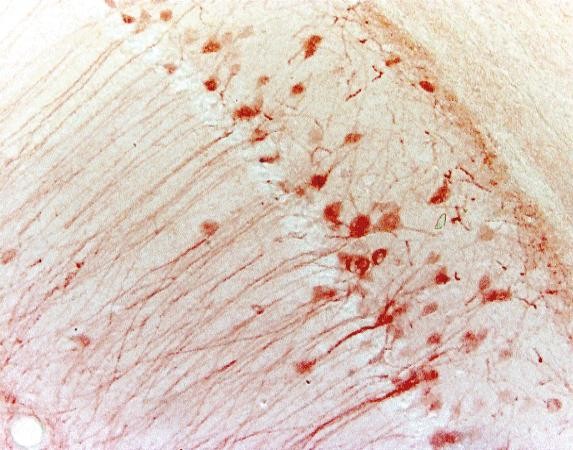 |
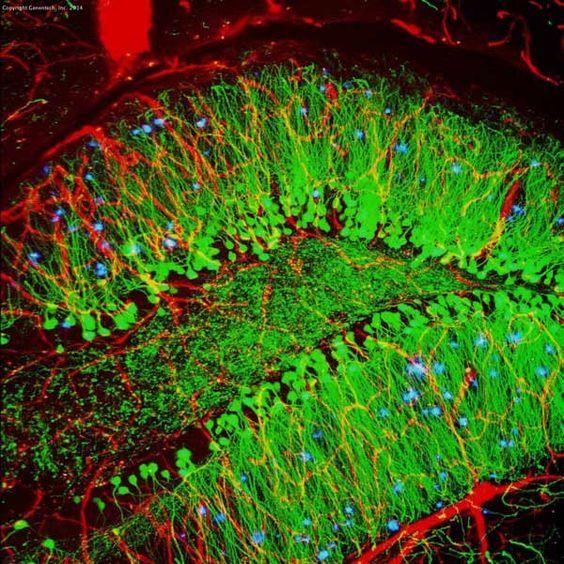 |
.