Pacient cu o leziune subepitelială gastrică
Martín Gómez Zuleta, MD (1)
(1) Unitatea de Gastroenterologie, Departamentul de Medicină Internă, Universitatea Națională din Columbia. Spitalul Tunal. Bogotá, Columbia.
Recepție: 05-10-10-10 Acceptat: 25-11-10
Abstract
Deși leziunile subepiteliale sunt rar întâlnite în tractul gastrointestinal superior, ele pot cauza incertitudine în abordarea diagnostică și în management. Sunt descrise constatările endosonografice și sunt revizuite recomandările actuale în lumina unui caz, pentru a permite o abordare rațională a acestor leziuni.
Cuvintele cheie
Tumori submucoase, ecografie endoscopică, GIST.
Caz clinic
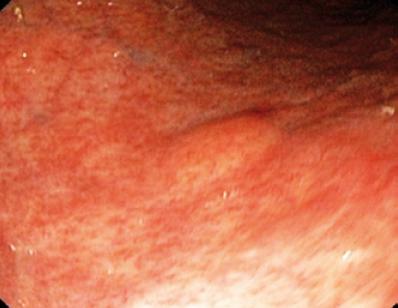
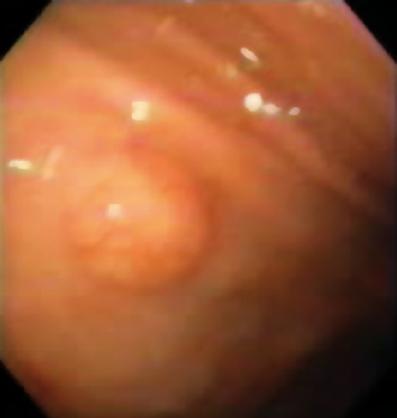
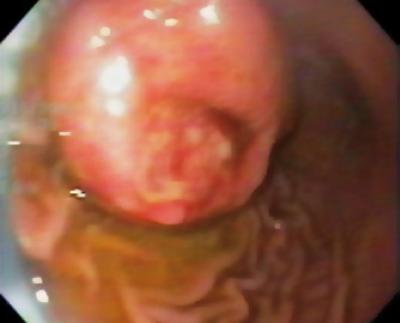
Un bărbat în vârstă de 50 de ani cu dispepsie a fost trimis pentru o endoscopie superioară care a găsit o leziune subepitelială de 9 mm în corpul gastric (figura 1). Biopsia mucoasei suprapuse a fost normală. Pacientul nu avea antecedente medicale, iar examenul fizic a fost normal.
Figura 1. Leziune subepitelială gastrică.
Abordare inițială: Ce am putea face atunci?
O masă sau o protuberanță în lumenul unui organ acoperit de epiteliu normal se numește leziune subepitelială. Acestea sunt leziuni neobișnuite, care se așteaptă să fie prezente în 1 din 300 de endoscopii (1, 2). Cauzele pot fi leziuni benigne sau maligne intrinseci ale peretelui tractului gastrointestinal sau compresia extrinsecă cauzată de structurile adiacente normale sau patologice (3).
Aceste leziuni sunt de obicei descoperite întâmplător și adesea nu au nicio legătură cu simptomele, așa cum a fost cazul pacientului nostru. Acest lucru îl poate determina pe medic să se îndoiască dacă ar trebui să urmeze cu investigații mai specifice și să efectueze investigații suplimentare (4). În opinia noastră, toate aceste leziuni ar trebui să fie evaluate pentru a le clarifica originea. Ar trebui să luăm întotdeauna o biopsie a mucoasei suprapuse (cu excepția cazului în care suspectăm o origine vasculară sau chistică), deoarece multe dintre aceste leziuni pot avea o origine în lamina proprie sau în musculatura mucoasei. În aceste cazuri, ele pot fi atinse cu forcepsul și se poate face un diagnostic precis. Dacă biopsiile sunt normale, aici trebuie să definim dacă trebuie să oprim sau să continuăm studiul.
După ce a fost efectuată endoscopia și a fost detectată o leziune subepitelială, putem imediat să o evaluăm. Inițial trebuie să îi descriem dimensiunea, forma, culoarea și mobilitatea, precum și dacă este sau nu pulsatilă. În cele din urmă, îi putem evalua consistența cu ajutorul unei pense de biopsie închise, ceea ce ne permite să detectăm dacă este chistică, solidă sau moale, depresibilă și asemănătoare unei perne (o leziune care se reface lent). Leziunile de tip pernă cu halouri galbene sunt foarte sugestive pentru lipoame. În cazul în care leziunea este o ușoară neregularitate a mucoasei și are o depresiune centrală, este sugestivă pentru un pancreas ectopic. De obicei, chisturile sau varicele au o mucoasă netedă, simetrică. GIST-urile (tumori stromale gastrointestinale) pot fi ușor ulcerate, dar sunt ferme și mobile (9). De asemenea, este utilă schimbarea poziției pacientului pentru a exclude posibilitatea unei leziuni extrinseci, al cărei aspect endoscopic se va modifica dacă pacientul își schimbă poziția, inspiră sau dacă stomacul pacientului este umplut cu aer (10-12).
Care este diagnosticul diferențial?
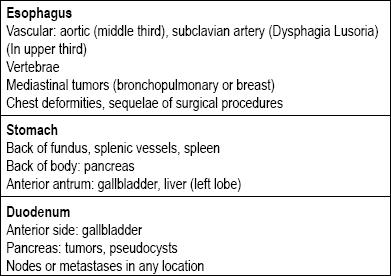
Există multe tipuri de leziuni în tractul gastrointestinal care pot fi clasificate ca fiind subepiteliale. Cauzele lor depind de obicei de faptul dacă leziunea este localizată în esofag, stomac, duoden sau rect. Următorul punct de luat în considerare este dacă este cu adevărat o leziune a peretelui sau dacă este vorba de o compresie extrinsecă, deoarece există structuri de jur împrejurul întregului tract gastrointestinal care pot duce la compresie (tabelul 1) (5-8).
Tabel 1. Cauzele primare ale compresiilor extraluminale ale tractului digestiv superior.
Ar trebui ca toate leziunile să fie evaluate cu ecografie endoscopică (EUS)?
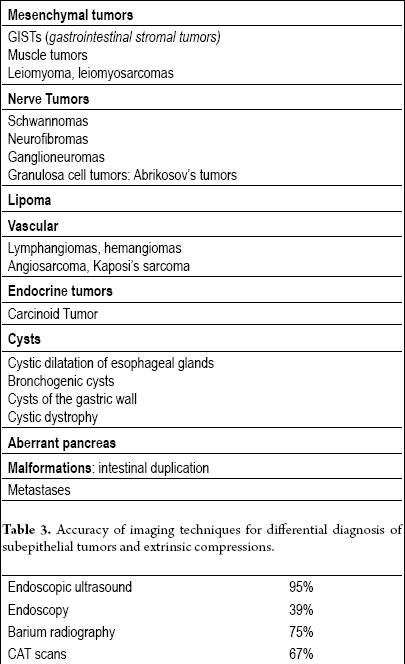
De fapt, toate leziunile subepiteliale (tabelul 2) trebuie evaluate cu tehnici imagistice suplimentare, dar dacă leziunea are un diametru mai mic de un centimetru (mai ales dacă este galbenă), nu este necesară o evaluare, deoarece există o mare probabilitate ca aceasta să fie un lipom.
Tabelul 2. Tumori subepiteliale ale tractului gastrointestinal.
Ecografia endoluminală sau endoscopică (EUS) este tehnica de elecție (13, 14). Acuratețea EUS pentru diferențierea compresiei extraluminale de o tumoră subepitelială este de peste 95%. Aceasta este mult mai bună decât alte tehnici imagistice, cum ar fi ecografia convențională sau tomografia computerizată (15-17) (Tabelul 3).
Tabel 3. Precizia tehnicilor imagistice pentru diagnosticul diferențial al tumorilor subepiteliale și al compresiilor extrinseci.
După ce am stabilit că leziunea este intrinsecă peretelui și nu este o compresie extrinsecă, trebuie să evaluăm cărui strat al peretelui îi corespunde. În mod normal, peretele stomacului este împărțit în mucoasă, submucoasă, musculoasă proprie și seroasă. Stratul mucos se împarte în epiteliu, membrană bazală, lamina propria și mucoasa musculară. Cu EUS și cu ajutorul echipamentului radio, peretele poate fi împărțit în 5 straturi (18):
Primul strat hiperecoic corespunde părții celei mai superficiale a mucoasei gastrice.
Secundul strat hipoecogen corespunde părții celei mai profunde a mucoasei care poate fi corelată cu mucoasa musculară.
Cel de-al treilea strat hiperecoic corespunde stratului submucos.
Cel de-al patrulea strat hipoecogen corespunde mușchiului propriu-zis.
Cel de-al cincilea strat hiperecoic corespunde seroasei sau adventiei.
În mod normal, nu există leziuni în straturile unu și cinci (19), astfel încât acestea sunt limitate la trei straturi. Ele sunt de obicei hipoecoice, anecoice sau hiperecoice.
Diagnostic cu ajutorul ecografiei endoscopice
Vom descrie fiecare prezentare în funcție de stratul său.
Stratul ecografic doi
Correspunde părții cele mai profunde a mucoasei sau laminei proprii și musculaturii mucoasei. Leziunile care apar în acest strat sunt rare și sunt de obicei hipoecogene.
Leziuni hipoecogene: Majoritatea tumorilor care apar în acest strat sunt musculare, de obicei leiomioame. Ele pot avea calcificări, iar cele mari pot fi eterogene și prezintă noduli, spre deosebire de leziunile mici care sunt omogene. (20).
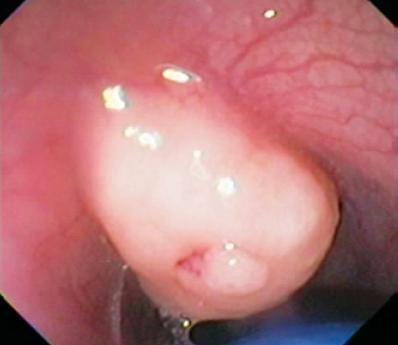
În acest strat găsim și tumori Abrikosovs sau celule granulare. Acestea sunt de obicei mici și, spre deosebire de leiomiom, deformează bila endoscopului din cauza durității lor (figurile 2 și 3). Carcinoidele pot proveni, de asemenea, din acest strat, de obicei în fundus sau în rect (figura 4).
Figura 2. Leziune subepitelială de culoare galbenă în esofagul distal.
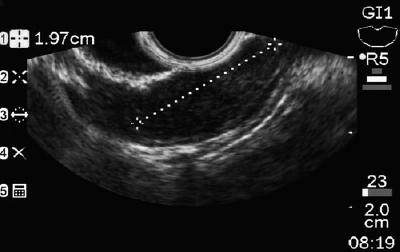
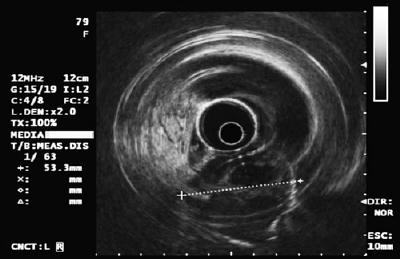
Figura 3. EUS arată o leziune izoecogenă în al treilea strat de ecou care deformează bila, sugerând o tumoră cu celule granulare de 2 cm
Figura 4. Leziune subepitelială cu un model reticular în centru, sugerând o tumoră neuroendocrină.
Lesiuni anecoice: De obicei putem vedea că chisturile de incluziune sau de retenție pot proveni din acest strat.
Stratul ecografic trei
Este o bandă de țesut care pare hiperecoică în EUS. Numeroase tumori își pot avea originea în acest strat.
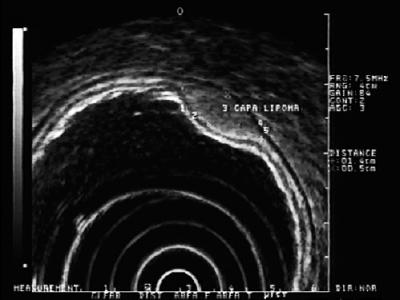
Lesiuni hiperechoice: Leziunile cel mai frecvent întâlnite în acest strat sunt lipomii. Acestea sunt caracterizate ca leziuni hiperechoice omogene. De obicei, acestea au aspect de pernă atunci când sunt împinse cu forcepsul endoscopic (figura 5) (9).
Figura 5. EUS: leziune hiperechoică în stratul submucos 3, compatibilă cu lipomul.
Neurofibroamele tind să fie hiperechoice. Ele își au originea în submucoasă sau în musculatura proprie.
Leziunile hipoecogene din acest strat pot corespunde unor pancreasuri ectopice sau aberante. Aceste leziuni sunt de obicei eterogene și ocazional pot fi observate în centru structuri ductale anecoice care pot corespunde unor canale. La o endoscopie se observă o leziune cu un centru deprimat (21).
Leziunile hipoecogene pot corespunde, de asemenea, tumorilor carcinoide. Deși nu sunt tumori subepiteliale, deoarece sunt mai degrabă neuroendocrine decât mezenchimale, ele pot fi localizate în peretele digestiv și dau naștere la același tip de noduli. De obicei, sunt mici (mai puțin de un cm), hipoecogene (dar mai mult ecogene decât musculare) și se instalează în mucoasă. Studiul histologic este de obicei posibil în urma unei biopsii (22, 23).
Limfoamele gastrice pot fi, de asemenea, prezente sub forma unor leziuni hipoecogene sau hiperecoice ale submucoasei (24).
Leziunile anecoice observate în acest strat sunt susceptibile de a fi structuri vasculare sau chisturi (25).
Stratul ecografic patru
Correspunde stratului muscular. Prin urmare, majoritatea tumorilor din acest strat sunt de origine musculară.
Leziunile hiperecoice sunt foarte rare, dar pot fi legate de limfoame, tumori neurogene sau metastaze (26).
Leziuni hipoecogene: Majoritatea tumorilor din acest strat sunt hipoecogene, mai ales tumorile stromale (GIST) atunci când sunt situate în stomac. Cu toate acestea, dacă sunt localizate în esofag, ele se numesc de obicei leiomioame. Alte leziuni care pot avea acest aspect sunt metastazele care provin din plămâni sau sâni și tumora glomerulară (27). Limfoamele pot, de asemenea, să compromită acest strat, dar în general sunt însoțite de compromiterea straturilor superioare.
GIST (gastrointestinal stromal tumor) este numele unei leziuni despre care cunoștințele noastre s-au îmbunătățit mult în ultimii ani (28-30). Aceste tumori par să își aibă originea în celulele totipotențiale care sunt, de asemenea, punctele de origine ale așa-numitelor celule interstițiale ale lui Cajal. Ele pot fi diferențiate în grupuri: predominant musculare, predominant neuronale sau o combinație a celor două. Diagnosticul se face prin identificarea imunohistochimică a proteinei CD-117 (cunoscută și sub numele de proteina c-kit) care este un receptor membranar cu activitate tirozin kinazică (31).
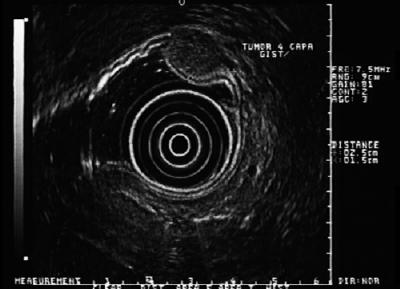
Importanța acestor leziuni constă în faptul că 30% pot avea un comportament malign și pot da naștere la metastaze. Numai în Statele Unite sunt raportate între 5.000 și 6.000 de cazuri în fiecare an (32). Distribuția lor în tractul gastrointestinal este: stomac (40-70%), intestin subțire (20-40%), colon și rect (5-15%) și esofag (<5%) (33). Acest lucru înseamnă că, dacă avem o leziune hipoecogenă de al patrulea strat în esofag, este probabil un leiomiom, dar dacă este în stomac, este de obicei un GIST (figura 6, 7 y 8). Majoritatea pacienților se află în al cincilea sau al șaselea deceniu de viață. De obicei, aceștia au o leziune localizată în stratul al patrulea sau în musculatura proprie, deși ar putea fi localizată și în musculatura mucoasei (34). Majoritatea pacienților sunt asimptomatici până când tumora devine suficient de mare încât să ulcereze, să sângereze sau să facă metastaze.
Figura 6. EUS arată o leziune hipoecogenă a celui de-al patrulea strat, compatibilă cu GIST.
Figura 7. Leziune ulcerată sugestivă de GIST.
Figura 8. EUS din figura 7 prezintă o leziune hipoecogenă a celui de-al patrulea strat ecografic extrem de sugestivă pentru un GIST, mai mare de 5 cm.
Din acest motiv, dacă identificăm un GIST mai mare de 3 cm este o indicație pentru intervenție chirurgicală chiar dacă este asimptomatic (alți autori sugerează o limită de 4 cm). (35). Cu toate acestea, leziunile de mai puțin de 3 cm reprezintă provocări pentru management, deoarece majoritatea sunt benigne. Cu toate acestea, trebuie clarificat faptul că toate GIST-urile sunt potențial maligne și au fost raportate GIST-uri mici care au făcut metastaze, în special în tractul gastrointestinal inferior. În prezent, nu suntem în măsură să prezicem cu ajutorul ultrasunetelor endoscopice potențialul malign al unui GIST. Cu toate acestea, știm că leziunile care sunt mai mari de 4 cm, au margini neregulate și/sau spații chistice în interiorul lor sau prezintă focare ecogene au probabilități ridicate de a fi maligne (36).
Pe de altă parte, aspirația endoscopică cu ac fin ghidată ecografic (EUS-FNA) poate diagnostica GIST nu numai prin identificarea CD-117, ci și prin prezența proteinei Ki-67, care indică proliferarea și sugerează un comportament malign (37). Este foarte important să subliniem faptul că leziunile GIST sunt foarte periculoase. Trebuie să le urmărim în permanență, evaluând dimensiunea tumorii și rata de proliferare în funcție de riscurile stabilite. Chiar și după rezecția completă, aceste leziuni pot recidiva, în special la locul de origine, dar și în peritoneu sau în ficat. Între 40% și 90% dintre leziuni recidivează în ciuda rezecției complete. 50% dintre recidive implică ficatul. GIST-urile au un risc de recurență de 4 ori mai mare atunci când sediul primar este intestinul decât atunci când este în stomac (38).
Care este acuratețea ecografiei endoscopice?
Multe studii au arătat că EUS este foarte precisă pentru a determina dacă o leziune se află sau nu pe perete și pentru a stabili din ce strat al peretelui provine leziunea. Acest lucru ne permite să alegem cea mai bună abordare diagnostică. Un studiu a determinat că stratul sursă la 48 din 50 de pacienți (96%) cu confirmare chirurgicală (39). Acordul interobservator este foarte bun, în special atunci când se identifică leziuni precum leiomioamele și leziunile vasculare. Este important de remarcat faptul că aspectul ecografic al leziunilor nu ne permite să determinăm cauzele acestora cu o certitudine de 100%. Un studiu realizat de Karaca et al. (40) pe 22 de pacienți supuși EUS urmat de mucosectomie a arătat că acuratețea EUS a fost de numai 45%. Cu toate acestea, leziunile erau în cea mai mare parte mai mici de 20 mm, iar precizia ultrasunetelor a crescut la 66% pentru diferențierea tumorilor maligne de cele benigne. Deoarece criteriile ecografice pot fi imprecise, pare rezonabil să încercăm, dacă este posibil, să obținem un diagnostic specific. Acest lucru poate fi obținut prin EUS-FNA sau prin rezecția mucoasei leziunii, așa cum s-a demonstrat în această lucrare. Mekky et al. au studiat 141 de pacienți supuși unui EUS-FNA verificat chirurgical. Ei au constatat o acuratețe de 95,6% pentru rezultatele lor finale (41).
Monitorizare, biopsie prin puncție sau rezecție?
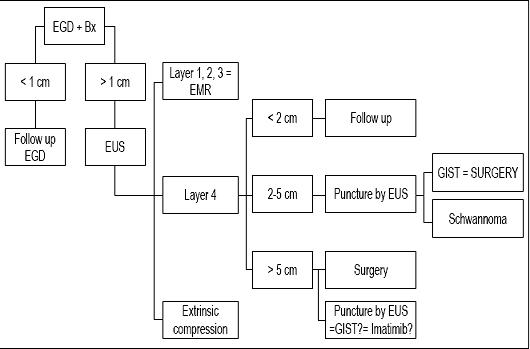
Decizia de a monitoriza, de a utiliza sau de a efectua o rezecție depinde de mai mulți factori, inclusiv de dimensiunea leziunii, de aspectul endoscopic al acesteia, de stratul de origine și de caracteristicile sale ecogene. Dacă ne confruntăm cu o leziune subepitelială de mai puțin de 1 cm, nu se justifică mai multe teste, dar trebuie efectuată o endoscopie de control. În cazul în care leziunea este mai mare de 1 cm, EUS este obligatorie. Dacă leziunea este mică și depinde de primul, al doilea sau al treilea strat ecografic, se poate efectua o rezecție diagnostică a mucoasei, care este și terapeutică. Cu toate acestea, dacă leziunea se află în al patrulea strat și are mai puțin de 2cm, se recomandă monitorizarea doar cu endoscopie. Dacă măsoară între 2 cm și 5 cm, EUS-FNA este ideal. Dacă se stabilește că este vorba de o leziune benignă, se poate efectua o examinare de control după 6 luni. Dacă nu a crescut, nu este necesară o monitorizare suplimentară. Dacă este malignă, are potențial malign sau este mai mare de 5 cm, se recomandă tratament (42).
În concluzie, deoarece pacientul nostru a avut o leziune mai mică de 1 cm, credem că leziunea sa a meritat doar o endoscopie de urmărire (vezi algoritmul, figura 9). S-a propus o nouă examinare de urmărire peste un an. Dacă leziunea nu a crescut, se vor programa controale suplimentare de urmărire la fiecare 2 sau 3 ani, dar dacă va crește, vom propune EUS-FNA și un studiu imunohistochimic.
Figura 9. Algoritm de tratament în leziunile subepiteliale. EGD: endoscopie superioară. Bx: Biopsie. EUS: ecografie endoscopică. RME: rezecție endoscopică a mucoasei.
1. Polkowski M, Butruk E. Leziuni submucoase. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS în tumorile submucoase. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopie 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Revizuirea tehnică a institutului asociației gastroenterologice americane privind managementul maselor subepiteliale gastrice. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Precizia ultrasonografiei endoscopice în leziunile submucoase gastrointestinale superioare: un studiu prospectiv multicentric. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonographic features of gastric ectopic pancreases distinguishedable from mesenchymal tumors. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Caracteristicile endosonografice ale tumorilor cu celule granulare esofagiene. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Rolul ecografiei endoscopice în managementul tumorilor submucoase din esofag și stomac. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia prin aspirație cu ac fin a chisturilor de dublare gastrică cu ghidaj endoscopic cu ultrasunete. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Rezecția endoscopică a mucoasei pentru neoplaziile gastrice. Tehnici în endoscopie gastrointestinală 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestivă. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Studiu asupra tumorilor miogenice ale tractului gastrointestinal superior prin ultrasonografie endoscopică, cu referire specială la diagnosticul diferențial al leziunilor benigne și maligne. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluarea leziunilor submucoase ale tractului gastrointestinal superior prin ecografie endoscopică. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Ultrasonografia endoscopică în diagnosticul tumorii submucoase gastrice. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Corelații histologice ale imaginilor cu ultrasunete gastrointestinale. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Evaluarea prospectivă a unei sonde US cu cateter over-the-wire. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultrasonografia endoscopică pentru evaluarea tumorilor musculare netede din tractul gastrointestinal superior: o experiență cu 42 de cazuri. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ultrasonografie endoscopică. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imagistica gastrointestinală: ecografia endoscopică. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Smith PP, Faigel DO. Randamentul prelevării de țesuturi pentru leziunile submucoase evaluate prin EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ultrasonografia endoscopică pentru stadializarea inițială și urmărirea pacienților cu limfom gastric de grad scăzut al țesutului limfoid asociat mucoasei tratat medical. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, Wang KK, DiMagno EP. Diagnosticul chisturilor de dublare a foregutului prin ultrasonografie endoscopică. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferențierea endosonografică a tumorilor benigne și maligne ale celulelor stromale. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Caracteristici endosonografice predictive ale tumorilor benigne și maligne ale celulelor stromale gastrointestinale. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologia și criteriile de diagnosticare a tumorilor stromale gastrointestinale (GIST): O revizuire. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Eficacitatea și siguranța mesilatului de imatinib în tumorile stromale gastrointestinale avansate. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Tumorile stromale gastrointestinale și alte leziuni mezenchimale ale intestinului. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumori stromale gastrointestinale: De la o abordare chirurgicală la una moleculară. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Managementul tumorilor stromale gastrointestinale maligne. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumori stromale gastrointestinale. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Măsurarea leziunilor prin endoscopie: o prezentare generală. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Prezentarea clinică a tumorilor stromale gastrointestinale și tratamentul bolii operabile. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Un studiu asupra tumorilor miogenice ale tractului gastrointestinal superior prin ultrasonografie endoscopică, cu referire specială la diagnosticul diferențial al leziunilor benigne și maligne. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Evaluarea prognostică a tumorii stromale gastrointestinale. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumori stromale gastrice. Un studiu clinicopatologic a 77 de cazuri cu corelarea caracteristicilor cu comportamente clinice neagresive și agresive. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Tumorile submucoase și pliurile gastrice groase. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Precizia EUS în evaluarea leziunilor subepiteliale gastrice mici. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilitatea diagnostică a FNA ghidată de EUS la pacienții cu tumori gastrice submucoase. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Leziuni submucoase. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS în tumorile submucoase. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine needle aspiration for the diagnosis of malignant submucosal tumors. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Revizuirea tehnică a institutului asociației gastroenterologice americane privind managementul maselor subepiteliale gastrice. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Precizia ultrasonografiei endoscopice în leziunile submucoase gastrointestinale superioare: un studiu prospectiv multicentric. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Caracteristicile endosonografice ale pancreasurilor gastrice ectopice care se disting de tumorile mezenchimale. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Endosonographic features of esophageal granular cell tumors. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Rolul ecografiei endoscopice în managementul tumorilor submucoase din esofag și stomac. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biopsia prin aspirație cu ac fin a chisturilor de dublare gastrică cu ghidaj endoscopic cu ultrasunete. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Rezecția endoscopică a mucoasei pentru neoplaziile gastrice. Tehnici în endoscopie gastrointestinală 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestivă. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Studiu asupra tumorilor miogenice ale tractului gastrointestinal superior prin ultrasonografie endoscopică, cu referire specială la diagnosticul diferențial al leziunilor benigne și maligne. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Evaluarea leziunilor submucoase ale tractului gastrointestinal superior prin ecografie endoscopică. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Ultrasonografia endoscopică în diagnosticul tumorii submucoase gastrice. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Corelații histologice ale imaginilor cu ultrasunete gastrointestinale. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Evaluarea prospectivă a unei sonde US cu cateter over-the-wire. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultrasonografia endoscopică pentru evaluarea tumorilor musculare netede din tractul gastrointestinal superior: o experiență cu 42 de cazuri. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ultrasonografie endoscopică. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Imagistica gastrointestinală: ecografia endoscopică. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Smith PP, Faigel DO. Randamentul prelevării de țesuturi pentru leziunile submucoase evaluate prin EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ultrasonografia endoscopică pentru stadializarea inițială și urmărirea pacienților cu limfom gastric de grad scăzut al țesutului limfoid asociat mucoasei tratat medical. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, Wang KK, DiMagno EP. Diagnosticul chisturilor de dublare a foregutului prin ultrasonografie endoscopică. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferențierea endosonografică a tumorilor benigne și maligne ale celulelor stromale. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Caracteristici endosonografice predictive ale tumorilor benigne și maligne ale celulelor stromale gastrointestinale. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologia și criteriile de diagnosticare a tumorilor stromale gastrointestinale (GIST): O revizuire. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Eficacitatea și siguranța mesilatului de imatinib în tumorile stromale gastrointestinale avansate. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. Tumorile stromale gastrointestinale și alte leziuni mezenchimale ale intestinului. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumori stromale gastrointestinale: De la o abordare chirurgicală la una moleculară. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Managementul tumorilor stromale gastrointestinale maligne. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumori stromale gastrointestinale. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Măsurarea leziunilor prin endoscopie: o prezentare generală. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Prezentarea clinică a tumorilor stromale gastrointestinale și tratamentul bolii operabile. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Un studiu asupra tumorilor miogenice ale tractului gastrointestinal superior prin ultrasonografie endoscopică, cu referire specială la diagnosticul diferențial al leziunilor benigne și maligne. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Evaluarea prognostică a tumorii stromale gastrointestinale. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumori stromale gastrice. Un studiu clinicopatologic a 77 de cazuri cu corelarea caracteristicilor cu comportamente clinice neagresive și agresive. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Tumorile submucoase și pliurile gastrice groase. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Precizia EUS în evaluarea leziunilor subepiteliale gastrice mici. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilitatea diagnostică a FNA ghidată de EUS la pacienții cu tumori gastrice submucoase. Gastrointest Endosc 2010; 71: 913-9.