Introducere
Boala cronică de rinichi (CKD) este asociată cu o mortalitate ridicată, în special de origine cardiovasculară. Cu toate acestea, asocierea limitată dintre mortalitate și factorii de risc cardiovascular tradiționali la acești pacienți este paradoxală. Doar unii markeri legați de inflamație sau de nutriție (de exemplu, proteina C reactivă și albumina serică) s-au dovedit a fi predictori constanți ai mortalității în IRC.1
În ultimii ani, unele studii observaționale au arătat o asociere între concentrațiile serice ridicate ale fosfatazei alcaline totale (ALP) și mortalitatea la pacienții cu IRC2-5; cu toate acestea, semnificația biologică și clinică a acestei constatări rămâne necunoscută.
Gamma-glutamil transferaza (GGT) este o enzimă prezentă în ser și pe suprafața exterioară a celulelor din diferite organe, cum ar fi ficatul, pancreasul, intestinul, plămânii și rinichii.6 GGT serică nu este doar un marker tradițional al consumului de alcool și al bolilor hepatobiliare, dar mai multe studii au arătat, de asemenea, o asociere între nivelurile serice crescute de GGT și bolile cardiovasculare, diabetul zaharat, hipertensiunea arterială și sindromul metabolic.7
Nivelurile de GGT reprezintă un factor de predicție a mortalității în populația generală; de fapt, această enzimă a fost recent inclusă ca fiind unul dintre parametrii biochimici care prezic mortalitatea.8 Mai mult, nivelurile serice de GGT ar putea ajuta la interpretarea valorilor ridicate ale ALP de origine neclară.
Există doar câteva studii care au analizat semnificația clinică și prognostică a GGT serice în IRC.9,10 Scopul acestui studiu a fost de a investiga caracteristicile clinice ale pacienților cu IRC cu niveluri serice anormal de ridicate ale GGT și interacțiunea acestora cu ALP, precum și de a determina valoarea acestui parametru ca factor de predicție a mortalității.
Materiale și metode
Este un studiu retrospectiv, observațional, efectuat pe o cohortă de pacienți adulți urmăriți în ambulatoriul de pacienți cu clearance scăzut (CKD avansată) din cadrul departamentului de nefrologie al Spitalului Infanta Cristina, Badajoz, Spania, din ianuarie 2002 până în octombrie 2013. Studiul a inclus toți pacienții în predializă cu vârsta >18 ani cu o rată de filtrare glomerulară estimată (eGFR)
mL/min/1,73m2. Pacienții cu IRC datorată disfuncției de transplant renal nu au fost incluși.
Datele demografice și parametrii clinici, cum ar fi vârsta, sexul, indicele de masă corporală (IMC), comorbiditățile și medicația au fost înregistrate la includere.
Comorbiditatea a fost evaluată cu ajutorul scorului Davies,11 iar pacienții au fost clasificați în funcție de cumulul diferitelor comorbidități: fără comorbidități, ușoară-moderată (1 sau 2 procese comorbide) sau severă (3 sau mai multe procese comorbide). Principalele comorbidități înregistrate au fost: diabetul zaharat, insuficiența cardiacă, boala coronariană, boala cerebrovasculară sau vasculară periferică, boala pulmonară obstructivă cronică, cancerul și procesele inflamatorii cronice.
În studiul de față, termenul de „boală hepatică” a inclus nu numai pacienții diagnosticați cu boli hepatice cronice, ciroză sau transplant hepatic, ci și pacienții cu alcoolism activ, sau infecție activă cu virusul hepatotropic (B sau C). Steatohepatita non-alcoolică (boala ficatului gras) a fost o constatare ecografică frecventă în rândul acestor pacienți, deși această boală nu a fost inclusă în lista bolilor hepatice.
Pacienții au fost urmăriți în mod regulat din momentul includerii în studiu până la decesul lor, transplant renal, pierderea urmăririi sau până la sfârșitul perioadei de colectare a datelor (31 decembrie 2014).
Datorită concepției retrospective a studiului, nu a fost obținut consimțământul informat individual.
Măsurătorile biochimice
Începând din ianuarie 2002, GGT serică și ALP totală au fost adăugate la măsurătorile de rutină ale parametrilor biochimici la pacienții din clinica noastră de CKD avansată.
Nivelurile de GGT au fost determinate cu ajutorul unui autoanalizator (Advia Chemistry, Siemens Healthcare Diagnostics, New York, SUA) prin metoda colorimetrică cinetică cu gama-glutamil-3-carboxi-4-nitroanilidă și glicilglicină. Coeficientul de variație este mai mic de 4,5%, iar intervalul de referință 0-36U/L.
Nivelurile de ALP serice au fost, de asemenea, măsurate prin autoanalizator (Advia Chemistry), cu metoda ALPI, care cuantifică activitatea fosfatazei alcaline prin măsurarea transfosforilării p-nitrofenilfosfatului în p-nitrofenol în prezența 2-amino-2-metil-1-propanolului. Coeficientul de variație a fost mai mic de 4%, iar intervalul de referință a fost de 45-120U/L.
Pentru a caracteriza pacienții cu GGT sau ALP serice anormal de crescute, în studiu au fost incluși și parametrii hematologici și biochimici de bază (prezentați în tabelul 1). Parametrii biochimici au fost determinați prin metode convenționale de laborator (Advia Chemistry, New York, SUA). Nivelurile de hormon paratiroidian (molecula 7-84) (PTH) au fost determinate prin imunoanaliză chemiluminiscentă automatizată (DiaSorin, Italia), concentrațiile de albumină serică prin metoda cu verde de bromocresol, iar proteina C reactivă de înaltă sensibilitate prin imunoanaliză enzimatică chemiluminiscentă în fază solidă (autoanalizator Immulite, Diagnostic Product Corporation, New York, SUA).
Caracteristicile clinice și biochimice ale setului de pacienți și subgrupurile în funcție de valorile anormal de ridicate ale GGT sau ALP.
| Total | Normal GGT și ALP | Înalt GGT | ALP ridicată | Simultan GGT și ALP ridicate | P* | ||||
|---|---|---|---|---|---|---|---|---|---|
| N pacienți | 909 | 596 | 141 | 104 | 68 | ||||
| . Vârsta (ani) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 66 (14) | 0.234 | ||
| Sex, masculin/feminin | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 | |||
| Indice de comorbiditate % | |||||||||
| Nici unul | 31 | 37 | 21 | 29 | 9 | ||||
| Mild-…moderată | 52 | 48 | 63 | 59 | 54 | ||||
| Severă | 17 | 15 | 16 | 12 | 37 | ||||
| Fumători activi, % | 15 | 14 | 21 | 10 | 25 | 0.011 | |||
| Diabet zaharat, % | 39 | 35 | 46 | 41 | 50 | 0.013 | |||
| Boală hepatică, % | 3 | 2 | 6 | 2 | 10 | ||||
| Boală cardiacă ischemică, % | 16 | 14 | 10 | 16 | 38 | ||||
| Ischemia SNC sau periferică, % | 21 | 19 | 18 | 23 | 34 | 0.031 | |||
| Insuficiență cardiacă, % | 18 | 16 | 21 | 14 | 37 | ||||
| IMC, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5,9) | 0,176 | |||
| eGFR, ml/min/1,73 m2 | 14,7 (5,1) | 14,8 (5,1) | 14.6 (4,6) | 14,1 (4,4) | 15,6 (6,2) | 0,234 | |||
| Hemoglobina (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 | |||
| Acid uric seric, mg/dL | 7,6 (1,9) | 7,5 (1,9) | 7,9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | ||||
| Colesterolul total, mg/dL | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 | |||
| Trigliceride, mg/dL | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 | |||
| Albumină serică, g/dl | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 | |||
| Calciu total seric, mg/dL | 9,1 (0,8) | 9,2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 | |||
| Fosfor seric, mg/dL | 4,7 (1,1) | 4,7 (1) | 4,7 (0,9) | 4,6 (1.2) | 4,6 (1,2) | 0,851 | |||
| Bicarbonat seric, mEq/L | 21,4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 | |||
| PTH, pg/mL | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | ||||
| ALT, UI/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | ||||
| GGT, UI/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | ||||
| ALP, UI/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | ||||
| Feritină serică, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | ||||
| Proteina C-reactivă, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | ||||
| Proteinurie, mg/g creatinină | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 | |||
| Inhibitori de renină-angiotensină, % | 79 | 80 | 78 | 78 | 72 | 0.502 | |||
| Beta-blocante, % | 26 | 25 | 30 | 22 | 35 | 0.140 | |||
| Diuretice, % | 60 | 59 | 62 | 60 | 65 | 0.829 | |||
| Statine, % | 53 | 54 | 53 | 55 | 47 | 0.762 | |||
| Alopurinol, % | 22 | 22 | 25 | 26 | 13 | 0.200 | |||
| Analogi ai vitaminei D, % | 10 | 10 | 7 | 15 | 9 | 0.201 | |||
| Agenți antiplachetarieni, % | 34 | 33 | 28 | 41 | 38 | 0.124 | |||
Datele sunt prezentate ca medie (deviație standard), dacă nu se specifică altfel.
ANOVA sau χ2 între grupuri.
P0.05 GGT-ALP ridicat vs. GGT-ALP normal sau ALP ridicat, test Scheffé.
P0,05 GGT ridicat vs. GGT-ALP normal, test Scheffé.
P0,0001 ALP ridicat vs. ALP normal, test Scheffé. fiecare dintre celelalte subgrupuri, testul Scheffé.
P0,0001 GGT ridicat sau GGT-ALP ridicat vs. GGT-ALP normal sau ALP ridicat, testul Scheffé.
P0,0001 ALP ridicat sau GGT-ALP ridicat vs. GGT-ALP normal vs. GGT-ALP ridicat. GGT-ALP normal sau GGT ridicat, test Scheffé.
P0,001 GGT ridicat sau GGT-ALP ridicat vs. GGT-ALP normal sau GGT-ALP ridicat, test Scheffé.
Date disponibile la 845 de pacienți.
Formula MDRD-4 a fost utilizată pentru a estima rata de filtrare glomerulară (eGFR).12
Feritina serică a fost singurul parametru cu valori lipsă. Media valorilor disponibile a fost inclusă în analiza descriptivă, dar valorile lipsă nu au fost calculate, iar această variabilă nu a fost inclusă ca o covariabilă în analiza de supraviețuire.
Variabilă de rezultat
Variabila de rezultat a fost decesul din orice cauză. Cauzele de deces au fost clasificate în 5 grupe: moarte subită, cardiovasculară, infecțioasă, malignă și alte cauze.
Analiză statistică
Pentru compararea descriptivă a variabilelor continue, în funcție de caracteristicile lor, au fost utilizate teste parametrice sau neparametrice; iar pentru variabilele categorice a fost utilizat testul Chi-pătrat. Testul Pearson a fost utilizat pentru analiza corelațiilor bivariate.
Diferențele de supraviețuire între pacienți în funcție de cuartilele GGT sau ALP au fost analizate cu ajutorul curbelor Kaplan-Meier și comparate cu ajutorul testului log-rank Mantel-Haenszel.
Modelurile de hazard proporțional Cox multivariate au fost utilizate pentru a analiza efectul valorilor inițiale ale GGT și ALP asupra timpului până la mortalitatea din toate cauzele.
Din moment ce nivelurile inițiale ale GGT și ALP au prezentat o distribuție cu bias pozitiv, valorile au fost transformate logaritmic pentru a fi incluse ca o variabilă continuă.
Pentru a lua în considerare diferitele perioade de recrutare, modelele multivariate au fost, de asemenea, ajustate în conformitate cu o variabilă categorică corespunzătoare perioadelor de recrutare (2002-2005, 2006-2009, 2010-2014).
GGT și ALP au fost analizate ca variabile continue (transformare logaritmică) și ca variabile categorice: quartila superioară și valori anormal de ridicate (GGT>36IU/L și ALP>120IU/L).
Au fost incluse următoarele modele de regresie: (1) Univariate. (2). Ajustat pentru vârstă, sex, scor de comorbiditate, diabet, boală hepatică, fumător activ, IMC, eGFR inițial și perioada de recrutare. (3) Ajustat pentru aceleași variabile ca în modelul 2, plus nivelurile totale ale calciului seric, fosforului, PTH, albuminei, proteinei C reactive, trigliceridelor, acidului uric și alanin aminotransferazei (ALT). (4) Cel mai bun model de potrivire folosind procesul de eliminare pas cu pas condiționată inversă.
Ipoteza hazardurilor proporționale a fost testată folosind curbe log-minus-log și reziduuri Schöenfeld pentru fiecare variabilă. Pacienții au fost cenzurați în momentul decesului, al pierderii urmăririi, al transplantului renal sau la sfârșitul urmăririi (31 decembrie 2014), oricare dintre acestea a avut loc mai întâi.
Datele descriptive sunt prezentate sub formă de medie și abatere standard sau de mediană și interval interquartil pentru variabilele continue și valori absolute și procente pentru variabilele categorice. O valoare p
RezultateCaracteristicile pacienților
Grupul de studiu a inclus 909 pacienți în stadiul 4 sau 5 de IRC, predializă (eGFR mediu 14,7±5,1mL/min/1,73m2). Vârsta medie (±SD) a fost de 65±15 ani, iar 53% dintre pacienți au fost bărbați. Toți erau caucazieni. Caracteristicile clinice și biochimice de bază sunt prezentate în tabelul 1.
Pentru a analiza caracteristicile clinice și biochimice ale pacienților în funcție de prezența unor niveluri anormal de ridicate de GGT sau ALP, pacienții au fost împărțiți în patru subgrupuri (tabelul 1): niveluri normale de GGT și ALP (66% dintre pacienți), GGT ridicată, dar ALP normală (16%), GGT normală, dar ALP ridicată (11%) și GGT și ALP ridicate simultan (7%).
Astfel, 209 (23%) și 172 (19%) pacienți au avut niveluri inițiale anormal de ridicate de GGT și, respectiv, ALP. Valoarea cuartilului superior pentru GGT și ALP a fost de 34IU/L și, respectiv, 112IU/L.
Nu au existat diferențe semnificative în ceea ce privește distribuția medie a vârstei și a sexului între subgrupuri. Scorul de comorbiditate și procentul de fumători activi a fost considerabil mai mare la pacienții cu GGT ridicată, în special în grupul cu GGT și ALP ridicate simultan (tabelul 1).
Bolile hepatice au fost comorbidități rare în acest set de pacienți. Cu toate acestea, aproximativ 8% dintre pacienții cu niveluri ridicate de GGT fuseseră diagnosticați cu boli hepatice.
Prevalența bolilor cardiovasculare la pacienții cu GGT sau ALP ridicate a fost similară cu cea a pacienților cu valori normale de GGT și ALP, însă această prevalență a bolilor cardiovasculare a fost semnificativ crescută la pacienții cu GGT și ALP ridicate simultan.
Au fost observate diferențe semnificative în ceea ce privește parametrii biochimici între subgrupuri (tabelul 1). Pacienții cu GGT ridicată au avut concentrații serice mai mari de acid uric, trigliceride, ALT, feritină și CRP decât pacienții cu niveluri normale de GGT și ALP, sau doar cu ALP ridicată. Subgrupul de pacienți cu ALP ridicată doar a avut niveluri mai ridicate de PTH. Valorile medii inițiale ale albuminei au fost similare între subgrupuri.
Aceste modele biochimice asociate cu GGT sau ALP au fost confirmate prin analiza de corelație bivariată (tabelul 2).
Coeficienți de corelație între parametrii biochimici.
| Log GGTa | Log ALPb | Haemoglobina | Acidul uric | Trigliceride | ALT | Fosfor | Calciu | Feritină | Albumin | PTH | C-reactive protein | eGFR | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | ||||||||||||||||||
| Log ALPb | 0.337** | |||||||||||||||||
| Hemoglobina | -0.001 | 0.029 | ||||||||||||||||
| Acidul uric | 0.162** | 0.051 | 0.068* | |||||||||||||||
| Trigliceride | 0,164** | 0.011 | 0,063 | 0,083* | ||||||||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | |||||||||||||
| Fosfor | -0,013 | 0,024 | -0.092* | 0,075* | 0,020 | 0,026 | ||||||||||||
| Calciu | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0,014 | -0,178** | |||||||||||
| Feritină | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | ||||||||||
| Albumina | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0,112** | |||||||||
| PTH | -0,055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0,072* | ||||||||
| Proteina C-reactivă | 0,197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0,077* | |||||||
| eGFR | 0,080* | -0,028 | 0,163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0,054 | ||||||
| Proteinurie | 0,098* | 0,131** | -0,055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0.01.
Log-transformat gamma-glutamil-transferaza.
Fosfataza alcalină log-transformată.
Mortalitate și alte evenimente de interes
Un total de 365 de pacienți (40%) au decedat în timpul perioadei de studiu, cu o supraviețuire mediană pentru setul de pacienți de 74 de luni (Tabelul 3). Așa cum era de așteptat, cele mai frecvente cauze de deces au fost cardiovasculare și infecții, fără diferențe semnificative între subgrupuri (tabelul 3).
Mortalitatea și alte variabile de interes ale rezultatelor în cadrul grupului în ansamblu și în subgrupuri în funcție de GGT și fosfataza alcalină (ALP).
| Total | Normal GGT și ALP | GGT ridicat | ALP ridicată | Simultan GGT și ALP ridicate | |||
|---|---|---|---|---|---|---|---|
| Durata mediană de supraviețuire , luni | 74 | 86 | 61 | 82 | 38 | ||
| Decese, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) | ||
| Cauza decesului, N (%): | |||||||
| Bruscă | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) | ||
| Cardiovasculară | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) | ||
| Infecțioase | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) | ||
| Malignitate | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) | ||
| Altele | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) | ||
| Dializă, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) | ||
| Transplant renal, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) | ||
| Pierdut la urmărire, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) | ||
În timpul perioadei de urmărire, 58% dintre pacienți au trebuit să înceapă dializa, iar 15% au primit un transplant renal (nu au existat transplanturi preventive). Nu au fost observate diferențe nici între subgrupuri în ceea ce privește procentul de pacienți care au început dializa, au fost supuși transplantului sau au fost pierduți la urmărire (tabelul 3).
Gamma-glutamil transferaza și fosfataza alcalină ca factori determinanți ai supraviețuirii
Figurile 1 și 2 prezintă curbele de supraviețuire Kaplan-Meier în funcție de cuartilele de distribuție a frecvenței valorilor GGT și, respectiv, ALP. Pacienții cu niveluri ridicate de GGT sau ALP (cuartile superioare) au avut o supraviețuire mai slabă.
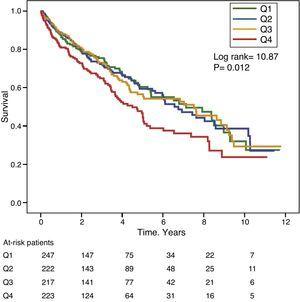
Curbe de supraviețuire Kaplan-Meier în funcție de cuartilele de distribuție a frecvenței nivelurilor serice de GGT (Q, cuartile).
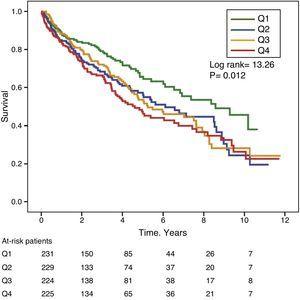
Curbe de supraviețuire Kaplan-Meier în funcție de cuartilele de distribuție a frecvenței nivelurilor ALP serice. (Q=quartile).
Utilizând modelele de regresie Cox, GGT ca variabilă continuă sau categorică (cuartila superioară sau valoarea serică >36IU/L) a fost asociată semnificativ cu creșterea mortalității în modelele analizate (tabelul 4). ALP a fost, de asemenea, asociată în mod semnificativ și independent cu o creștere a mortalității în toate modelele analizate, cu excepția cazului în care ALP a fost inclusă în modelul cel mai bine adaptat ca variabilă categorială definită ca valoare a cuartilei superioare. În acest model, gradul de asociere a ALP cu mortalitatea nu a atins semnificația statistică (P=0,052) (Tabelul 4).
Modelurile de regresie Cox de asociere cu mortalitatea.
| Variabila | Univariate HR (95% CI) | Modelul multivariat 1a HR (95% CI) | Modelul multivariat 2b HR (95% CI) | Modelul multivariat 3c HR (95% CI) | ||
|---|---|---|---|---|---|---|
| Log-transformată GGT | 1.310 (1.154-1.489) P0.0001 |
1.260 (1.095-1.449) P0.0001 |
1.174 (1.005-1.371) P=0.042 |
1.166 (1.010-1.347) P=0.036 |
||
| GGGT cuartila superioară | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.829) P=0.001 |
1.415 (1.119-1.788) P=0.004 |
1.329 (1.036-1.705) P=0.025 |
1.315 (1.064-1.714) P=0.013 |
|
| GGT>36IU/L | 1.513 (1.202-1.905) P0.0001 |
1.509 (1.185-1.923) P=0.001 |
1.393 (1.078-1.800) P=0.011 |
1.390 (1.089-1.779) P=0.011 |
1.390 (1.089-1.779) P=0.009 |
|
| Log-transformed ALP | 1.635 (1.278–2.093) P0.0001 |
1.479 (1.149–1.904) P=0.002 |
1.395 (1.061–1.833) P=0.017 |
1.327 (1.008–1.746) P=0.044 |
||
| ALP upper quartile | 1.332 (1.062–1.670) P=0.013 |
1.288 (1.023–1.621) P=0.031 |
1.277 (1.001–1.630) P=0.049 |
1.261 (0.998–1.594) P=0.052 |
||
| ALP>120IU/L | 1.527 (1.197–1.947) P=0.001 |
1.419 (1.109–1.815) P=0.005 |
1.362 (1.048–1.770) P=0.021 |
1.305 (1.015–1.678) P=0.038 |
Adjusted for age, sex, comorbidity index, diabetes, smoking, liver disease, BMI, eGFR and study periods.
Ajustat pentru toate covariabilele din modelul 1 plus calciu, fosfor, PTH, acid uric, trigliceride, ALT, albumină și proteina C reactivă.
Modelul cel mai bine adaptat care include toate variabilele din modelele 1 și 2 plus GGT sau ALP, cu proces automat de selecție a variabilelor.
Raportul de risc (HR) pentru mortalitate la pacienții cu niveluri ridicate de GGT (>36IU/L) (HR=1,39) a fost similar cu cel observat la pacienții cu nivel ridicat de ALP (>120IU/L) (HR=1,31) în modelul complet ajustat (tabelul 4). Fig. 3 prezintă curbele de supraviețuire Kaplan-Meier care ilustrează această asociere, precum și efectul aditiv asupra supraviețuirii reduse al GGT și ALP ridicate simultan.
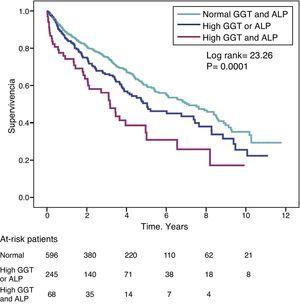
Curbe de supraviețuire Kaplan-Meier la pacienții din studiu în funcție de nivelurile normale de GGT și ALP, niveluri anormal de ridicate de GGT sau ALP (una sau alta) și simultan GGT și ALP ridicate.
Pentru a evalua posibilul efect de confuzie al comorbidității hepatice asupra asocierii dintre GGT și ALP cu mortalitatea, a fost construit un model de regresie Cox, excluzând 27 de pacienți diagnosticați anterior cu boală hepatică. În acest model ajustat, GGT ridicată (>36IU/L) a menținut o asociere semnificativă din punct de vedere statistic cu mortalitatea (HR=1,316; 95% CI: 1,016-1,705; P=0,03), în timp ce un nivel ridicat de ALP (>120IU/L) a prezentat o asociere la limita semnificației statistice (HR=1,296; 95% CI: 0,999-1,680; P=0,05).
Discuție
Rezultatele studiului de față arată că GGT sau ALP serice ridicate sunt asociate independent cu o mortalitate mai mare la pacienții cu insuficiență renală cronică. De asemenea, acest studiu relevă pentru prima dată că ridicarea simultană a ambilor parametri are un efect aditiv asupra predicției mortalității, chiar și la pacienții fără afecțiuni hepatice.
În acest studiu, pacienții cu CKD și niveluri ridicate de GGT au avut o comorbiditate mai mare, în special diabet și insuficiență cardiacă, și un profil biochimic similar cu cel observat în sindromul metabolic, deși IMC în acest subgrup nu a fost diferit de cel al restului pacienților din studiu.
Datorită naturii omniprezente a ALP în organism, nivelurile serice ridicate ale acestei enzime pot fi expresia unor procese patologice diferite. În acest sens, determinarea izoenzimelor specifice ale ALP poate fi utilă pentru a distinge originea acestora în cazurile în care creșterile izolate nu pot fi atribuite remodelării osoase crescute.
Excesul de mortalitate raportat la pacienții cu IRC și niveluri ridicate de ALP a fost atribuit, în mod controversat, unor potențiale efecte adverse cardiovasculare ca urmare a lipsei foarte severe de control asupra metabolismului osos-mineral.2,3,13,14 Au fost propuse mai multe mecanisme patogene pentru a explica această asociere, inclusiv calcifierea vasculară crescută prin hidroliza pirofosfatului în peretele arterial,15 inflamația sistemică16,17 și deficitul de vitamina D.18 Cu toate acestea, absența unei asocieri semnificative între nivelurile serice ale izoenzimei ALP de origine osoasă (ALP specifică osului) și mortalitatea la pacienții cu IRC19 ridică îndoieli serioase cu privire la ipoteza privind o legătură patogenică cu metabolismul osos-mineral.
În acest studiu, 11% dintre pacienți au avut niveluri crescute de ALP cu niveluri normale de GGT, iar principala caracteristică a acestui subgrup a fost nivelul mediu ridicat de PTH, sugerând că osul ar putea fi originea acestei creșteri a ALP. Cu toate acestea, ALP și GGT ridicate simultan au caracterizat un subgrup de pacienți cu un grad mai mare de comorbiditate, în principal boli cardiovasculare, și un profil biochimic mai asemănător cu cel al pacienților cu GGT ridicată doar decât cu cel al pacienților cu ALP ridicată doar. Astfel, se pot distinge două profiluri de risc la pacienții cu IRC și ALP ridicată în funcție de prezența sau absența unor niveluri ridicate de GGT. În timp ce ALP ridicată singură a fost asociată cu un risc moderat de mortalitate, creșterea simultană a ambelor enzime a fost asociată cu un risc mai mare de mortalitate.
GGT este enzima responsabilă de hidroliza glutationului redus extracelular (GSH), unul dintre principalii antioxidanți intracelulari la mamifere, permițând aminoacizilor precursori să fie utilizați ulterior pentru o nouă sinteză intracelulară de GSH.6 Astfel, creșterea GGT este o expresie a epuizării GSH intracelulare și, prin urmare, GGT ar putea fi considerată ca un marker al stresului oxidativ.6
Serul GGT s-a dovedit a fi un biomarker cardiometabolic în populația generală. Diferite studii au constatat o asociere semnificativă și independentă între nivelurile de GGT și mortalitatea cardiovasculară și mortalitatea din toate cauzele.20-22 S-a demonstrat că nivelurile ridicate de GGT sunt asociate cu un prognostic mai slab în cazul bolii coronariene și al insuficienței cardiace.23,24 S-a observat, de asemenea, o posibilă implicare patogenică a GGT în formarea plăcii aterosclerotice, în eroziunea acesteia și în ruperea ulterioară,25 ceea ce ar putea ajuta la explicarea relației sale cu morbiditatea și mortalitatea cardiovasculară din punct de vedere biologic.
Valoarea predictivă a GGT la pacienții cu IRC a fost puțin studiată. Postorino și colab.9 au observat o asociere puternică și independentă între nivelurile ridicate de GGT și mortalitatea totală și cardiovasculară la 584 de pacienți cu CKD aflați sub dializă. Cu toate acestea, concentrațiile serice de ALP nu au fost determinate în acest studiu.
Într-un alt studiu, nivelurile ridicate de GGT au fost asociate cu o disfuncție endotelială marcată la pacienții cu IRC, ceea ce sugerează o legătură între nivelurile ridicate ale acestui marker și riscul de boli cardiovasculare.10
În plus față de posibilul efect pro-oxidativ sistemic, alte ipoteze ar putea contribui la explicarea asocierii dintre nivelurile ridicate de GGT și mortalitatea la pacienții cu IRC. Astfel, un nivel ridicat de GGT ar putea indica pur și simplu un abuz de alcool sau boli hepatice, comorbidități care ar justifica mortalitatea excesivă. Cu toate acestea, în acest studiu, GGT a menținut o asociere semnificativă cu mortalitatea după excluderea pacienților cu alcoolism cronic, boli hepatice cronice sau infecții cu virusuri hepatotrope, excluzând astfel rolul exclusiv al bolilor hepatice în această asociere.
Cu toate acestea, boala hepatică grasă și boala hepatică congestivă sunt două afecțiuni hepatice subclinice care pot cauza niveluri ridicate de GGT.26,27 Boala hepatică grasă este o constatare relativ frecventă la pacienții cu IRC și este mai strâns legată de factorii de risc cardiovascular decât de apariția complicațiilor hepatice.27 Caracteristicile clinice și biochimice asociate cu boala hepatică grasă sunt similare cu cele observate în subgrupul de pacienți din studiul nostru cu GGT ridicată. Cu toate acestea, în acest studiu, diagnosticul de boală hepatică grasă nu a fost studiat în mod adecvat la majoritatea pacienților și, prin urmare, nu se poate garanta că GGT ridicată s-a datorat în principal acestei boli.
Boala hepatică congestivă se referă la un spectru de anomalii hepatice atribuite congestiei pasive secundare insuficienței cardiace drepte sau oricărei cauze care crește presiunea venoasă centrală, inclusiv supraîncărcarea de volum, hipertensiunea pulmonară severă sau valvulopatiile.28 GGT sau ALP serice crescute sunt anomalii biochimice caracteristice la pacienții cu IRC cu disfuncție diastolică ventriculară stângă, în special dacă sunt asociate cu congestia pulmonară,29 care este, de asemenea, un factor de risc recunoscut pentru mortalitate la acești pacienți.30
GGT crescută poate reflecta, de asemenea, inducerea enzimelor microsomale.31 În plus față de consumul de alcool, multe medicamente pot induce enzime hepatice. În acest studiu, niciunul dintre medicamentele cel mai frecvent prescrise la pacienții cu IRC nu a fost asociat în mod semnificativ cu niveluri ridicate de GGT sau ALP, deși nu poate fi exclus efectul potențial al medicamentelor eliberate fără prescripție medicală (în special analgezicele) asupra nivelurilor ridicate de GGT la pacienții noștri.
Acest studiu are o serie de limitări. Având în vedere designul său retrospectiv, nu au putut fi stabilite relații de cauzalitate. Studiul a fost efectuat într-un singur loc, iar cohorta studiată, deși reprezentativă pentru populația locală, a fost omogenă din punct de vedere etnic (caucaziană). GGT și ALP nu au fost analizate ca și covariate care variază în timp și, prin urmare, este probabil ca semnificația prognostică a creșterilor tranzitorii ale GGT să fie diferită de creșterile menținute în timp. Cu toate acestea, în acest studiu, detectarea unui nivel ridicat de GGT în analiza transversală într-un anumit stadiu al IRC a fost asociată cu un fenotip clinic de mare interes datorită relației sale cu comorbiditatea și mortalitatea cardiovasculară. În cele din urmă, nu au fost măsurate ALP specifice osului și alți parametri legați mai specific de remodelarea osoasă.
În concluzie, un nivel anormal de ridicat al GGT este o constatare frecventă la pacienții cu IRC, care se observă mai frecvent la pacienții cu comorbiditate mai mare, în special boli cardiovasculare, și este asociat în mod independent cu mortalitatea. GGT și ALP serice crescute simultan cresc riscul de mortalitate. Prin urmare, măsurarea combinată a GGT serice cu ALP ar putea oferi informații predictive suplimentare la pacienții cu CKD.
Conflicte de interese
Autorii declară că nu există conflicte de interese.
.