Isocitratul dehidrogenază catalizează reacțiile chimice:
Isocitrat + NAD+ ⇌ {\displaystyle \rightleftharpoons }

2-oxoglutarat + CO2 + NADH + H+ Isocitrat + NADP+ ⇌ {\displaystyle \rightleftharpoons }

2-oxoglutarat + CO2 + NADPH + H+
Energia liberă globală pentru această reacție este de -8,4 kJ/mol.
EtapeEdit
În cadrul ciclului acidului citric, izocitratul, produs din izomerizarea citratului, suferă atât oxidare cât și decarboxilare. Cu ajutorul enzimei isocitrat dehidrogenază (IDH), izocitratul este reținut în situsul său activ de către aminoacizii arginină, tirozină, asparagină, serină, treonină și acid aspartic din jur. Prima casetă prezintă reacția generală a izocitratului dehidrogenazei. Reactivii necesari pentru ca acest mecanism enzimatic să funcționeze sunt izocitratul, NAD+/NADP+ și Mn2+ sau Mg2+. Produsele reacției sunt alfa-cetoglutaratul, dioxidul de carbon și NADH + H+/NADPH + H+. Moleculele de apă sunt folosite pentru a ajuta la deprotonarea oxigenelor (O3) ale izocitratului.
Căsuța a doua este etapa 1, care este oxidarea alfa-C (C#2). Oxidarea este prima etapă prin care trece izocitratul. În acest proces, gruparea alcoolică de pe carbonul alfa (C#2) este deprotonată, iar electronii trec la alfa-C, formând o grupare cetonă și eliminând o hidridă de pe C#2, folosind NAD+/NADP+ ca și cofactor acceptor de electroni. Oxidarea alfa-C permite o poziție în care electronii (în etapa următoare) vor coborî de la gruparea carboxil și vor împinge electronii (formând oxigenul cu dublă legătură) înapoi pe oxigen sau vor lua un proton de la un aminoacid lizină din apropiere.
A treia casetă este etapa 2, care este decarboxilarea oxalosuccinatului. În această etapă, oxigenul grupului carboxil este deprotonat de un aminoacid tirozină din apropiere și acei electroni coboară spre carbonul 2. Dioxidul de carbon părăsește carbonul beta al izocitratului ca grup de plecare, iar electronii se deplasează către oxigenul cetonic de pe alfa-C, plasând o sarcină negativă pe oxigenul din alfa-C și formând o dublă legătură nesaturată alfa-beta între carbonii 2 și 3. Perechea solitară de pe oxigenul alfa-C preia un proton de la un aminoacid lizină din apropiere.
Căsuța a patra este etapa 3, care reprezintă saturarea dublei legături alfa-beta nesaturate între carbonații 2 și 3. În această etapă a reacției, Lizina deprotonează oxigenul de pe carbonul alfa, iar perechea de electroni singuratici de pe oxigenul carbonului alfa coboară reformând dubla legătură cetonică și împingând perechea singuratică (care formează dubla legătură dintre carbonul alfa și beta) în afară, preluând un proton de la aminoacidul tirozină din apropiere. Această reacție are ca rezultat formarea de alfa-cetoglutarat, NADH + H+/NADPH + H+ și CO2.
Mecanism detaliatEdit
Două resturi de aminoacizi aspartat (mai jos în stânga) interacționează cu două molecule de apă adiacente (w6 și w8) în complexul IDH porcin de izocitrat Mn2+ pentru a deprotona alcoolul de pe atomul de carbon alfa. Oxidarea alfa-C are loc, de asemenea, în această imagine în care NAD+ acceptă o hidrură, rezultând oxalosuccinat. Împreună cu schimbarea stereochimică de la sp3 la sp2 în jurul alfa-C, se formează o grupare cetonă din gruparea alcoolică. Formarea acestei duble legături cetonice permite ca rezonanța să aibă loc pe măsură ce electronii care coboară de la grupul carboxilat care pleacă se deplasează spre cetonă.
Decarboxilarea oxalosuccinatului (mai jos în centru) este o etapă cheie în formarea alfa-cetoglutaratului. În această reacție, perechea singuratică de pe hidroxilul adiacent tirozinei absoarbe protonul de pe grupul carboxil. Această grupare carboxilică este, de asemenea, denumită subunitatea beta în molecula de izocitrat. Deprotonarea grupului carboxil face ca perechea singuratică de electroni să se deplaseze în jos, făcând dioxid de carbon și separându-se de oxalosuccinat. Electronii continuă să se deplaseze spre carbonul alfa împingând electronii dublei legături (formând cetona) în sus pentru a extrage un proton de pe un reziduu de lizină adiacent. Rezultă o legătură dublă alfa-beta nesaturată între carbonul 2 și 3. După cum puteți vedea în imagine, ionul verde reprezintă fie Mg2+, fie Mn2+, care este un cofactor necesar pentru ca această reacție să aibă loc. Ionul metalic formează un mic complex prin interacțiuni ionice cu atomii de oxigen de pe al patrulea și al cincilea carbon (cunoscut și ca subunitatea gamma a izocitratului).
După ce dioxidul de carbon este desprins din oxalosuccinat în etapa de decarboxilare (mai jos în dreapta), enolul se va tautomeriza în ceto din. Formarea dublei legături cetonice este inițiată de deprotonarea acelui oxigen de pe carbonul alfa (C#2) de către aceeași lizină care a protonat oxigenul în primul rând. Perechea singuratică de electroni se deplasează în jos, înlăturând perechile singuratice care formau dubla legătură. Această pereche solitară de electroni absoarbe un proton de la tirozina care a deprotonat grupul carboxil în etapa de decarboxilare. Motivul pentru care putem spune că reziduurile Lys și Tyr vor fi aceleași de la etapa anterioară este acela că ele ajută la menținerea moleculei de izocitrat în situsul activ al enzimei. Aceste două reziduuri vor fi capabile să formeze legături de hidrogen înainte și înapoi atâta timp cât sunt suficient de aproape de substrat.
 Etapa de oxidoreductază în care NAD+ este folosit pentru a accepta o hidrură.
|
 Decarboxilarea oxalosuccinatului.
|
 Saturarea dublei legături alfa-beta nesaturate.
|
Enzima izocitrat dehidrogenază, așa cum a fost menționată mai sus, produce alfa-cetoglutarat, dioxid de carbon și NADH + H+/NADPH + H+. Există trei modificări care au avut loc pe parcursul reacției. Oxidarea carbonului 2, decarboxilarea (pierderea dioxidului de carbon) de la carbonul 3 și formarea unei grupări cetonice cu o schimbare stereochimică de la sp3 la sp2.
 |
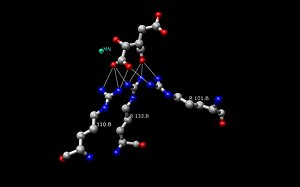
 Mitochondrială porcină NADP+-dependentă de izocitrat dehidrogenază complexată cu Mn2+ și izocitrat. Vedere de suprafață a buzunarului situsului activ în care izocitratul este legat de aminoacizi polari.
|
 Isocitrat-dehidrogenază mitocondrială porcină dependentă de NADP+ complexată cu Mn2+ și izocitrat.
|
 Complex enzimatic porcin; izocitrat în situsul activ și A.A. adiacent.
|
Situl activEdit
Structura enzimei Isocitrat Dehidrogenază (IDH) din Escherichia coli a fost prima structură care a fost elucidată și înțeleasă. De atunci, structura IDH din Escherichia coli a fost folosită de majoritatea cercetătorilor pentru a face comparații cu alte enzime isocitrat dehidrogenază. Există multe cunoștințe detaliate despre această enzimă bacteriană și s-a constatat că majoritatea izocitrat dehidrogenazelor sunt similare în structură și, prin urmare, și în funcție. Această similitudine de structură și funcție oferă un motiv pentru a crede că structurile sunt conservate, la fel ca și aminoacizii. Prin urmare, situsurile active ale majorității enzimelor procariote izocitrat dehidrogenazei ar trebui să fie, de asemenea, conservate, ceea ce se observă în multe studii efectuate asupra enzimelor procariote. Pe de altă parte, enzimele izocitrat dehidrogenazei eucariote, pe de altă parte, nu au fost încă descoperite pe deplin.Fiecare dimer al IDH are două situsuri active. Fiecare situs activ leagă o moleculă de NAD+/NADP+ și un ion metalic divalent (Mg2+,Mn2+). În general, fiecare situs activ are o secvență conservată de aminoacizi pentru fiecare situs de legare specific. La Desulfotalea psychrophila (DpIDH) și la porcină (PcIDH) există trei substraturi legate de situsul activ.
- Isocitratul se leagă în cadrul situsului activ de o secvență conservată de aproximativ opt aminoacizi prin legături de hidrogen. Acești acizi includ (pot varia în reziduuri, dar cu proprietăți similare) tirozina, serina, asparagina, arginina, arginina, arginina, arginina, tirozina și lizina. Pozițiile lor pe coloana vertebrală variază, dar toate se află într-un interval apropiat (de exemplu, Arg131 DpIDH și Arg133 PcIDH, Tyr138 DpIDH și Tyr140 PcIDH).
- Ionul metalic (Mg2+, Mn2+) se leagă de trei aminoacizi conservați prin legături de hidrogen. Acești aminoacizi includ trei resturi de Aspartat.
- NAD+ și NADP+ se leagă în situsul activ în cadrul a patru regiuni cu proprietăți similare între enzimele IDH. Aceste regiuni variază, dar sunt în jur de , , , și . Din nou, regiunile variază, dar apropierea regiunilor este conservată.