Interleukina 12 (IL-12) este o citokină pro-inflamatorie cu o greutate moleculară de 70 kDa compusă din două subunități, IL-12p35 (35 kDa) și IL-12p40 (40 kDa). Structura heterodimerică unică este împărtășită cu trei membri ai familiei, și anume IL-23 (p19/p40), IL-27 (p28/Ebi3) și IL-35 (p35/Ebi3).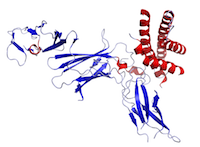
IL-12, denumită și IL-12p70, a fost descoperită independent în 1989 de Kobayashi M. et al. (denumită factor de stimulare a celulelor ucigașe naturale) și în 1990 de Stern A.S. et al. (denumit factor de maturare a limfocitelor citotoxice).
Figura Aceasta este o structură a IL-12 creată folosind datele din Protein Data Bank (PDB: 1F45) și redată folosind PyMOL.
IL-12 induce diferențierea celulelor T CD4+ naive în celule Th1 și activează celulele NK. În urma activării, celulele NK produc IFN-γ și IL-2, dar și IL-12, ceea ce indică un mecanism de feedback pozitiv. IL-12 protejează celulele CD4+ Th1 de moartea apoptotică indusă de antigen și s-a constatat că are efecte sinergice cu IL-18 în dezvoltarea celulelor Th1. În plus, IL-12 joacă un rol în traficul și migrația celulelor T prin inducerea moleculelor de adeziune funcționale, cum ar fi expresia ligandului de P- și E-selectină pe celulele Th1, dar nu și pe celulele Th2. Prin urmare, celulele Th1 sunt recrutate în mod selectiv în locurile care promovează un răspuns imunitar Th1. Din punct de vedere funcțional, aceste celule contribuie la eliminarea agenților patogeni intracelulari, spre deosebire de celulele Th2, care sunt responsabile de imunitatea umorală care protejează împotriva invadatorilor extracelulari. Echilibrul dintre IL-12, care favorizează răspunsurile Th1, și IL-4, care favorizează răspunsurile Th2, determină preferința timpurie exprimată în răspunsul imunitar.
IL-12p35 împărtășesc o omologie de secvență substanțială cu citokina IL-6, în timp ce lanțul p40 este structural omolog cu domeniul extracelular al lanțului α al receptorului IL-6 (IL-6R). Acest lucru sugerează că structura IL-12 a evoluat de la o citokină primordială din familia IL-6 și de la unul dintre receptorii acesteia. Deși transcripții IL-12p35 se găsesc în multe tipuri de celule, IL-12p35 liberă nu este secretată fără subunitatea IL-12p40. Această din urmă subunitate este produsă predominant de către monocitele activate, macrofagele, neutrofilele și celulele dendritice. Activitățile biologice ale IL-12p70 sunt mediate prin legarea la un complex receptor membranar (IL-12R) compus din două subunități: IL-12R-β1 și IL-12R-β2. În timp ce subunitatea IL-12R-β1 este exprimată în mod constitutiv, expresia IL-12R-β2 pe celulele Th1 este crescută de IFN-γ și este corelată cu capacitatea de răspuns la IL-12. La legarea IL-12, calea de semnalizare JAK-STAT este activată, STAT4 fiind mediatorul predominant al răspunsului celulelor T.
.