- Contenit
- Funcție
- Mecanism pentru acțiunea de inhibiție a transferului de șir
- HIV și SIDA
- Impactul structurii
- PFV Intasome Crystallization
- Tehnica de cristalizare
- Statistici cristalografice și de rafinare
- Arhitectura generală & Componente
- Structură
- Integrasa și interacțiunile ADN
- Situl activ
- Inhibitori de integrază
Contenit
- 1 Funcție
- 2 Mecanism pentru strand-transfer de inhibiție a acțiunii de inhibiție a transferului de șir
- 3 HIV și SIDA
- 4 Impactul structurii
- 5 Cristalizarea PFV Intasome
- 5.1 Tehnica de cristalizare
- 5.2 Statistici cristalografice și de rafinare
- 6 Arhitectura generală & Componente
- 6.1 Structura
- 6.2 Interacțiuni între integrază și ADN
- 6.3 Situl activ
- 7 Inhibitori de integrază
- 7.1 Resurse suplimentare
- 8 Structuri 3D ale integrazei retrovirale
Funcție
Integraza retrovirală este o enzimă retrovirală esențială care se leagă de ADN-ul viral și îl inserează într-un cromozom al celulei gazdă. ADNc transcris în sens invers al virusului imunodeficienței umane de tip 1 (HIV-1) este inserat în genomul celulei gazdă pentru a crește fitness-ul și virulența agentului patogen. Integroraza este produsă de o clasă de retrovirusuri (precum HIV) și este utilizată de virus pentru a-și încorpora materialul genetic în ADN-ul celulei gazdă. Mașinăria celulară gazdă produce apoi ARNm și apoi proteine din materialul genetic încorporat, replicând astfel virusul. Deși au fost studiate mai multe medicamente care inhibă integraza, mecanismul responsabil de acțiunea de inhibare a transferului de catenă nu a fost încă elucidat . Cu toate acestea, Hare el al (2010) a determinat constituenții structurali ai integrării retrovirale. Elucidarea în continuare a structurii complete a integrazei retrovirale și aplicarea acesteia pentru a regla activitățile funcționale și enzimatice ar putea permite cercetătorilor să întârzie progresia bolilor retrovirale. În plus, studiul integrării HIV-1 ar putea conduce la o nouă țintă promițătoare și ar putea contribui la generarea de modele farmacofore pentru terapia antivirală.
Inhibitori de integrază HIV: Raltegravir, comercializat sub denumirea Isentress, este aprobat în prezent ca inhibitor terapeutic al integrazei HIV. A fost aprobat la 12 octombrie 2007.Pentru integraza fagică, a se vedea Integraza fagică.
Mecanism pentru acțiunea de inhibiție a transferului de șir
Capitol
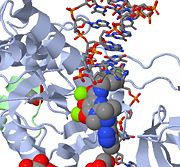
Acesta este o imagine JMOL a MK-0518 care blochează capătul 3′ al ADN-ului viral de la legarea situsului activ. Observați atomii de oxigen care chelează metalul din MK-0518 care interacționează cu cationii de magneziu care se găsesc în situsul activ.
HIV integraza de tip 1 este o țintă relativ nouă și inedită pentru inhibitori. În 2007, primul inhibitor de integrază HIV-1, Raltegravir, a fost aprobat de FDA pentru utilizarea în HIV-1 ca terapie combinată . Inhibitorii de transfer de catenă acționează prin împiedicarea integrării concertate a ADN-ului viral în cromozomul gazdei. După intrarea virusului în celula gazdă, transcriptaza inversă transformă ARNSS viral în ADNdb. În acest moment, integraza formează un complex cu ADN-ul viral, creând complexul de preintegrare (intasom). Complexul de preintegrare este apoi însoțit în nucleu, unde două nucleotide sunt extirpate de la capătul 3′. Apoi, ADN-ul este integrat covalent în ADN-ul gazdei. Inhibitorii de transfer de catenă întrerup acest proces, împiedicând integrarea ADN-ului viral în cromozomul gazdei. Inhibitorii de transfer de șiruri acționează prin angajarea cofactorilor de ioni metalici care se găsesc în situsul activ al integrazei retrovirale. Atomii de oxigen care chelează metalul găsiți în inhibitori interacționează direct cu cofactorii metalici, în timp ce grupul halobenzil se potrivește în buzunarul creat de ADN-ul viral 3′ deplasat în situsul activ.
HIV și SIDA

În 2010, mai mult de 25 de milioane de oameni au murit de SIDA și se estimează că aproximativ 33 de milioane de oameni trăiesc cu HIV.
Până în prezent, mai mult de 25 de milioane de oameni au murit de SIDA și se estimează că aproximativ 33 de milioane de oameni trăiesc cu HIV în prezent. Pentru inhibitorii de integrază retrovirală, a se vedea Raltegravir și Farmacocinetica inhibitorilor de integrază retrovirală.
Impactul structurii
Din analizele cristalografice cu raze X au apărut structuri tridimensionale pentru anumite proteine ale celulei gazdă esențiale pentru înțelegerea mecanismului de infectare și virulență a HIV. Structurile proteazei și integrazei HIV se numără printre structurile de cel mai înalt rang care au contribuit la salvarea multor vieți și au adăugat la calitatea vieții multor persoane afectate de HIV. Este pusă în aplicare în proiectarea medicamentelor bazată pe structură pentru a dezvolta inhibitori de protează și inhibitori de integrază și este utilizată ca o componentă semnificativă a terapiei antiretrovirale foarte active (HAART).
În timp ce agenții antiretrovirali existenți îmbunătățesc calitatea vieții, precum și prelungirea vieții multor pacienți, nu reușesc să eradicheze boala. Studiile privind inhibitorii de integrază arată că asocierea cu alte medicamente antiretrovirale diminuează adaptările virale și pot avea potențialul de a fi utilizate pentru terapia de salvare pentru pacienții care au dobândit rezistență la alte medicamente. Pentru mai multe informații, vă rugăm să consultați
- SIDA înainte de inhibitorii de protează & Inhibitori de protează HIV: A Breakthrough
- Treatments:Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
Pentru a imita capetele ADN-ului viral al HIV-1, Hare et al. (2010) au utilizat preparate solubile și complet funcționale de intasome ale prototipului virusului foamy (PFV), obținute cu ajutorul integrazei PFV recombinante și a oligonucleotidelor bicatenare.
Stabilitatea remarcabilă a complexelor integrază-ADN au fost determinate prin observarea reacțiilor de transfer de catenă in vitro, care au fost clasificate în trei moduri de migrare a deproteinei: (1) evenimente concertate unice: plasmidă țintă liniarizată; (2) evenimente concertate multiple: smear; (3) evenimente pe jumătate de situs: ADN circular deschis. Caracterizarea suplimentară a intasomului PFV a evidențiat, de asemenea, o substanțialitate structurală care implică interacțiuni puternice proteină-proteină și proteină-ADN în ciuda incubării prelungite în condiții de forță ionică ridicată. Testele complete de cristalizare au realizat o configurație cristalină viabilă care a difractat raze X la o rezoluție de 2,9 angstromi. În cele din urmă a fost determinată o structură tridimensională. Unitatea asimetrică conținea un singur dimer de integrază cu o moleculă de ADN viral legată în mod stabil și o pereche de dimeri de integrază consociați cu simetrie, care formau un tetramer alungit. Interfața dimerului este stabilizată prin interacțiuni intermoleculare ale domeniilor amino terminale și ale nucleului catalitic (subunitate internă-subunitate externă). Forma generală a tetramerului alungit este unică, deși prezintă asemănări cu complexele de integrază HIV-1 raportate anterior.
Tehnica de cristalizare
Complecșii proteină-ADN au fost formați folosind IN PFV de tip sălbatic, de lungime completă, și ADNd sintetic care a modelat capătul viral.
Intasomul a fost cristalizat utilizând tehnica de difuzie suspendată prin picurare cu vapori. Soluția rezervor a constat în 1,35 M sulfat de amoniu, 25% (v/v) glicerol, 4,8% (v/v) 1,6-hexanediol și 50mM acid 2-(N-morfolino) etanesulfonic (MES) la pH 6,5. Cristalele de proteină-ADN au fost, de asemenea, înmuiate în prezența de MK0518, GS9137, Mg(II) și/sau Mn(II). Structura cristalină a fost rezolvată cu ajutorul înlocuirii moleculare.
Statistici cristalografice și de rafinare
Hare et al. (2010) au publicat date privind șapte structuri cristaline. Aceste date includ complexul PFV IN (forma apo) și șase structuri suplimentare, inclusiv complexul legat de Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137 și Mn/GS9137. Toate cele șapte structuri aparțin grupului spațial P41212. Acestea au fost rafinate la o rezoluție cuprinsă între 2,85 și 3,25 Å.
Arhitectura generală & Componente
Structură
Structura generală a intasomului PFV asamblat este un model de tetramer bazat pe două structuri de domenii cu o interfață dimer-dimer. Modelele anterioare ale intasomului descriu o structură similară, dar mai flexibilă, în timp ce intasomul PFV s-a dovedit a fi foarte constrâns. Utilizând modelarea omologiei, Hare et al. (2010) propun că legăturile mai scurte între domenii pot fi un factor de flexibilitate, în special în cazul integrasei HIV-1. Subunitățile interioare ale tetramerului sunt implicate în tetramerizarea generală și în legarea ADN-ului viral. Domeniile centrale catalitice ale subunităților exterioare pot acționa ca suporturi, dar, deoarece domeniile amino- și carboxi-terminale nu sunt nerezolvate în hărțile de densitate electronică, funcția lor rămâne neconcludentă. Domeniul miezului catalitic și linkerul domeniului carboxi-terminal adoptă o conformație extinsă pe cea mai mare parte a lungimii sale și sunt situate în paralel cu domeniul amino-terminal și linkerul domeniului miezului catalitic al subunității interne. Legătorii interdomeniu Legătorii interdomeniu (CCD-CTD și NTD-CCD) unesc cele două jumătăți ale intasomului, iar structura este stabilizată și mai mult de o pereche de domenii carboxi-terminale care interacționează cu ambele domenii interne ale nucleului catalitic.
Integrasa și interacțiunile ADN
Interacțiunile puternice proteină-ADN sunt localizate în cele șase nucleotide terminale. Fiecare domeniu carboxi terminal interacționează cu coloana vertebrală fosfodiesterică a ambelor molecule de ADN viral. Mai mult, domeniul de extensie a domeniului amino-terminal și domeniul amino-terminal interacționează cu ADN-ul viral la nivelul situsului activ al domeniului de nucleu catalitic opus.
Situl activ
Carboxilații situsului activ sunt lanțuri laterale de Asp 128, Asp 185, Glu 221.
Un atom de zinc fiecare este localizat în apropierea situsurilor active.
- .
- .
Inhibitori de integrază
| Denumire | Marca | Compania | Brevet | Note | |
| Raltegravir | Isentress | Merck & Co. | – | – | cunoscut și sub numele de MK-0518. Izopropilul și metil-oxadiazolul din MK-0518 sunt implicați în interacțiuni hidrofobe și de stivuire cu lanțurile laterale Pro 214 și Tyr 212 pentru a stabiliza acest medicament în cadrul situsului activ al intasomului PFV. Acest mod de interacțiune de legare a medicamentului determină deplasarea capătului reactiv 3′ al ADN viral din situsul activ al intasomului PFV. După legarea MK-0518 la situsul activ, grupul hidroxil reactiv 3′ se îndepărtează de situsul activ al intasomului PFV cu mai mult de 6 angstromi. Raltegravir a fost aprobat de FDA la 12 octombrie 2007, pentru utilizare împreună cu alți agenți anti-HIV în tratamentul infecției cu HIV la adulți. Este primul inhibitor de integrază aprobat de FDA. |
| Elvitegravir | – | Gilead Science | – | GS-9137 interacționează cu Pro 214 a intasomului PFV prin intermediul bazei sale chinolonice și a grupului izopropil. În stadii experimentale; împărtășește structura de bază a antibioticelor chinolone. S-au finalizat studiile de fază II ale elvitegravirului la persoanele cu experiență de tratament. Studiile de fază III la pacienții cu experiență de tratament sunt în curs de desfășurare. Este în curs de desfășurare un studiu de fază II al elvitegravirului la persoanele care nu au urmat niciodată tratament antiretroviral. În acest studiu va fi evaluat, de asemenea, un agent de amplificare în locul Norvir, denumit în prezent GS9350. Elvitegravir este promițător pentru pacienții seropozitivi care au luat în trecut alte medicamente anti-HIV. | |
| MK-2048 | – | Merck & Co. | – | O a doua generație de inhibitori de integrază, destinat a fi utilizat împotriva infecției cu HIV. Este superior primului inhibitor de integrază disponibil, raltegravir, prin faptul că inhibă de 4 ori mai mult timp enzima HIV integrază. Este în curs de investigare pentru a fi utilizat ca parte a profilaxiei pre-expunere (PrEP). |
Vezi și Farmacocinetica inhibitorilor de integriază retrovirală.