Este important să cunoaștem structura Lewis a unei molecule pentru a înțelege proprietățile sale fizice, hibridizarea și forma moleculei. Astăzi vom trece în revistă structura Lewis a I3- sau cunoscut și sub numele de ion triodură, deoarece are o sarcină negativă pe el. Există trei molecule de iod în această moleculă și, prin urmare, numele compusului este Triodură. Pentru a înțelege structura Lewis a moleculei, trebuie să cunoaștem electronii de valență ai moleculei de iod.
Structura Lewis
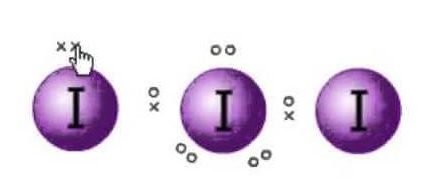
Structura Lewis este reprezentarea electronilor din molecule. Există perechi solitare și electroni de valență care ajută la determinarea hibridizării și a formei moleculei. Deoarece există molecule de iod, o moleculă de iod se va afla în centru. De asemenea, iodul se află în grupa a șaptea a tabelului periodic și are șapte electroni de valență pe orbita sa exterioară.

Avem aici trei molecule de iod care împreună cu un electron în plus care îi conferă o sarcină negativă. Deci numărul total de electroni de valență este de : 7×3 + 1= 22.
Există în total 22 de electroni de valență în această moleculă. Acum există o regulă a octetului pe care o respectă fiecare atom. Conform acestei reguli, fiecare atom ar trebui să aibă opt electroni pe orbita exterioară. Dacă există 8 electroni în orbita exterioară a atomului central, există alți doi atomi care trebuie să își completeze octetul. Deoarece toți atomii vor avea nevoie de opt electroni în învelișul lor exterior pentru a completa octetul, un electron al atomului central de iod va fi luat de ambii atomi de iod vecini. Asta înseamnă că 8-1-1=6.
Acum electronii vor fi luați de ambii atomi.
Acum electronii de valență de pe atomul central de iod vor fi șase. Acești șase electroni vor forma perechile solitare de electroni care nu se leagă. Deoarece acum formează perechea de electroni, vor exista trei perechi solitare și două perechi de electroni de legătură, deoarece fiecare atom de iod are o legătură cu atomul central care împarte câte un electron, în total există 3 perechi solitare și 2 perechi de legătură pe atomul central.
Hibridizare
Pentru a cunoaște hibridizarea oricărei molecule, există o formulă simplă care poate fi folosită. Această formulă este utilizată pentru aflarea numărului de hibridizare care ajută la cunoașterea hibridizării moleculei.
Numele de hibridizare și hibridizarea pe care o determină se enunță astfel:
- 2: hibridizare sp
- 3: hibridizare sp2
- 4: hibridizare sp3
- 5: hibridizare
Formula pentru aflarea numărului este,
Numărul de hibridizare: Numărul de electroni de valență + monovalent + (sarcină negativă) – (sarcină pozitivă)/2
Electronii de valență ai atomilor de iod sunt 7, deoarece există șapte electroni în învelișul cel mai exterior. Numărul atomilor monovalenți este 2, deoarece doi din trei ioduri sunt monovalenți. Acum, când ajungem la sarcina ionului I3-, acesta are o sarcină negativă, astfel încât valoarea acestei sarcini negative va fi 1.
Acum plasați toate valorile conform formulei,
7+1+2/2
=10/2
=5
Acum, numărul de hibridizare este 5, ceea ce înseamnă că hibridizarea este sp3d.
O altă modalitate de a afla gradul de hibridizare a unei anumite molecule este cu ajutorul perechilor solitare și al electronilor de valență. Numărul perechilor singuratice în această moleculă este 3, iar numărul de atomi care împart electroni de valență este 2.
În consecință, 3+2=5 ceea ce determină, de asemenea, hibridizarea sp3d.
Forma ionului I3-

Forma moleculei I3- este liniară. Există trei atomi de iod din care unul are o sarcină negativă suplimentară. Datorită acestui electron în plus există 3 perechi de electroni solitari și 2 perechi de legături, ceea ce face ca numărul său steric să fie 5. Deoarece există trei perechi solitare pe atomul central de iodură, aceste perechi încearcă să se respingă reciproc cât mai mult posibil. Astfel, pentru a se îndepărta la o distanță mai mare, perechile iau poziții ecuatoriale, iar ceilalți doi atomi de iod se află la 180 de grade unul față de celălalt. Astfel, forma generală a ionului I3- este liniară.
Polaritate
Iată care este partea complicată în legătură cu acest ion, în primul rând ca și cum ar avea o sarcină pe el, îl putem numi ion poliatomic în loc să îl numim moleculă. Ionii sunt sarcinile pe care le vedem pe molecule. Cum I3- are un electron, acest ion are o sarcină globală negativă. Moleculele au polaritate deoarece au ambele sarcini care sunt un capăt parțial încărcat pozitiv și cel parțial încărcat negativ. Există un moment dipolar pe molecule în funcție de separarea sarcinilor de pe moleculă. Dacă distanța dintre cele două sarcini este mai mare, momentul dipolar va fi, de asemenea, mai mare.
Dar când vorbim despre ionul I3- acesta este un ion cu sarcină negativă. Chiar și atunci când desenăm, structura lui Lewis, nu vedem nici un moment de dipol sau legături polare în ea, deoarece sarcina totală în sine este negativă pe ion. Așadar, nu este nici polar, nici nepolar. Cu toate acestea, dacă trebuie să descrieți ionul, puteți folosi expresia ” ca o moleculă polară” deoarece I3- este solubil în apă.
În concluzie, pentru a rezuma, întregul articol, I3- este un ion poliatomic care are 22 de electroni de valență, 3 perechi solitare, 2 perechi de legături și hibridizare sp3d. Are o formă liniară și nu are polaritate.
.