Introducere: Definirea termenilor
Datele anterioare privind taxonomia Cannabis au fost analizate anterior (Russo, 2007), care vor fi rezumate și completate în prezentul document. Cannabis este o plantă anuală dioică din familia Cannabaceae, care include în mod tradițional hameiul, Humulus spp. Alternativ, Cannabis a fost, de asemenea, atribuit la Moraceae, Urticaceae sau chiar în familiile Celtidaceae pe baza hărților sitelor de restricție ale cloroplastelor (Weigreffe et al., 1998) și a secvențelor genei mat K din cloroplast (Song et al., 2001). Mai recent, Cannabaceae au subsumat opt genuri: Celetis, Pteroceltis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema și Parasponia, cuprinzând 170 de specii ciudate (McPartland, 2018), o constatare susținută de analiza genetică a patru loci plastidici (Yang et al., 2013). Cercetările actuale privind eșantioanele de polen fosil asociate cu asociațiile ecologice ale Cannabis cu specii însoțitoare de stepă (Poaceae, Artemisia, Chenopodiaceae) și Humulus (hamei) cu genuri de pădure (Alnus, Salix, Populus), au stabilit că, deși Cannabis pare să își aibă originea în platoul tibetan cu cel puțin 19,6 milioane de ani în urmă, a fost, de asemenea, indigenă în Europa de cel puțin un milion de ani (McPartland et al, 2018), și a respins înțelepciunea convențională conform căreia acest „urmăritor de tabără” a fost adus acolo de către om.
Asemnarea speciei Cannabis în sine este plină de mari dezbateri. Cannabis sativa, însemnând „Cannabis cultivat”, a fost numit astfel de Fuchs, printre alții, în 1542 (Fuchs, 1999), o atribuire cu 211 ani înainte de sistematizarea binomului botanic Linnaeus în lucrarea sa Species Plantarum (Linnaeus, 1753). Lamarck a sugerat ulterior Cannabis indica, o plantă indiană intoxicantă mai mică din India, ca specie separată (Lamarck, 1783). Problema a rămas nerezolvată în secolele următoare, existând două filosofii opuse. Ernest Small a susținut conceptul de specie unică (Small și Cronquist, 1976). Tratamentele politropice ale Cannabis au câștigat, de asemenea, adepți (Schultes et al., 1974; Anderson, 1980) pe criterii morfologice care sugerează separarea dintre Cannabis sativa L. Cannabis indica Lam. și Cannabis ruderalis Jan. și Cannabis ruderalis Jan., o schemă susținută de chimiotaxonomia sistematică. Analiza componentelor principale (PCA) a 157 de accesiuni de Cannabis din întreaga lume, evaluând frecvențele alozomiale la 17 loci genetici, a sugerat o separare (Hillig, 2005b). Grupurile genetice „Sativa” din eșantioanele ruderale din Europa de Est au fost legate de plantele de semințe și fibre cu frunze înguste din Europa și Asia Centrală, în timp ce o grupare „indica” a cuprins plantele de semințe și fibre din Orientul Îndepărtat și plantele de droguri cu frunze largi din cea mai mare parte a restului lumii, împreună cu accesiuni sălbatice din subcontinentul indian. S-a considerat că eșantioanele de pe marginea drumurilor din Asia Centrală (Cannabis ruderalis) reprezintă un al treilea grup. Studiile de cromatografie în fază gazoasă (GC) și de electroforeză pe gel de amidon au sugerat, de asemenea, separarea speciilor sativa și indica (Hillig și Mahlberg, 2004).
Factorii agronomici din 69 de eșantioane au sugerat includerea cânepei orientale și a plantelor de droguri în Cannabis indica (Hillig, 2005a), o diviziune susținută de polimorfismele de lungime a fragmentelor (Datwyler și Weiblen, 2006).
Mai recent, PCA a părut să indice conținutul de terpenoizi ca fiind cei mai convingători markeri chemotaxonomici distinctivi între speciile putative sativa și indica (Elzinga et al., 2015). În mod similar, s-a considerat că PCA separă drogul Cannabis de cânepă (Sawler et al., 2015). Un studiu recent a demonstrat demarcarea accesiunilor de canabis de droguri de cele de cânepă prin intermediul genotipării a 13 loci microsateliți din întregul genom, nu doar a genelor care afectează producția de canabinoizi sau de fibre (Dufresnes et al., 2017). Profesorul Giovanni Appendino a raportat prezența stereo-izomerului cis-Δ9-THC doar în accesiunile de cânepă (Giovanni Appendino, comunicare personală). Cu toate acestea, este foarte posibil ca aceste distincții să treacă neobservate, având în vedere tendința actuală de încrucișare a cânepei cu soiuri de droguri pentru a evita restricțiile legislative privind conținutul de THC.
Controversa privind speciile de Cannabis, Cannabis sativa vs. indica vs. afghanica, a continuat nestingherită până în prezent, cu argumente pasionate avansate de protagoniști (Clarke și Merlin, 2013, 2016; Small, 2015; McPartland și Guy, 2017; Small, 2017). Acest autor, după ce a fost de fiecare parte a problemei la un moment dat, a ales să evite dezbaterea taxonomică ireconciliabilă ca pe o distragere inutilă a atenției (Piomelli și Russo, 2016) și să sublinieze mai degrabă că doar distincțiile biochimice și farmacologice dintre accesiunile de Cannabis sunt relevante. În recenta sa recenzie seminală, McPartland a fost de acord: „Categorizarea Cannabis fie ca „Sativa”, fie ca „Indica” a devenit un exercițiu inutil. Înmulțirea și hibridizarea omniprezente fac ca distincția lor să fie lipsită de sens”. (McPartland, 2018) (p. 210).
O controversă suplimentară de nomenclatură lipsită de sens se referă, în limbajul comun, la „tulpinile” de Cannabis, o denumire care este potrivită pentru bacterii și viruși, dar nu și pentru plante (Bailey și Bailey, 1976; Usher, 1996; Brickell et al., 2009), mai ales în cazul Cannabisului, unde varietatea chimică, abreviată „chemovar”, este cea mai potrivită denumire (Lewis et al., 2018).
Genomul Canabisului și producția biochimică a gazdei alternative
2011 a fost un an de referință pentru genomica Canabisului, deoarece Medical Genomics și Nimbus Informatics au publicat un raport online privind secvența genomică completă de 400 de milioane de perechi de baze, căreia i s-a alăturat la scurt timp un proiect de genom și transcriptom (van Bakel et al., 2011).
Această evoluție a stârnit o publicitate proeminentă și controverse cu privire la ceea ce ar putea prevesti. În timp ce, genomul uman a fost analizat cu aproximativ 20 de ani mai devreme, implicațiile pentru Cannabis au făcut obiectul unor mari speculații.
Veștile au catalizat o avalanșă de noi cercetări, dar se realizaseră deja progrese considerabile în genetica aplicată a Cannabisului. Identificarea și sinteza Δ9-tetrahidrocannabinolului (THC) a fost realizată în Israel 1964 (Gaoni și Mechoulam, 1964), dar abia mult mai târziu s-a reușit clonarea cu succes a enzimei sale biosintetice, sinteza acidului tetrahidrocannabinolic (sinteza THCA) (Sirikantaramas et al., 2004; Figura 1). A urmat cristalizarea enzimei (Shoyama et al., 2005). Sinteza acidului canabidiolic, care catalizează acidul canabidiolic (CBDA), precursorul canabidiolului (CBD), a fost identificată anterior și produsă în formă pură (Taura et al., 1996; figura 1). Aceste evoluții au stimulat descoperiri suplimentare, inclusiv descoperirea arheologică fitochimică a THCA-sintetazei într-o ascunzătoare de canabis veche de 2700 de ani dintr-un mormânt din Asia Centrală, împreună cu două polimorfisme nucleotidice unice (SNP) neraportate anterior în secvența genetică a enzimei (Russo et al., 2008).
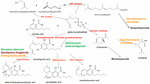
Figura 1. Căile de biosinteză și enzimele (roșu) de la Cannabis sativa, cu indicarea speciei naturale Helichrysum umbraculigerum și a speciilor alternative (în culori) care au fost modificate genetic pentru a produce produse ulterioare .
Până în 2011, au fost identificate enzimele de producere a principalelor fitocanabinoide. În mod similar, reproducerea selectivă avansată mendeliană a dat soiuri de Cannabis bogate în componente unice specifice. Astfel, au fost produse plante cu conținut ridicat de THC și CBD pentru dezvoltarea farmaceutică (de Meijer et al., 2003; de Meijer, 2004), cu o reproducere analogă de linii cu conținut ridicat de canabigerol (CBG) (de Meijer și Hammond, 2005) și canabichromene (CBC) (de Meijer et al., 2009a). Reproducerea selectivă s-a extins, de asemenea, la analogii de propil fitocannabinoizi, tetrahidrocannabivarină (THCV), cannabidivarină (CBDV), cannabigerivarină (CBGV) și canabichromivarină (CBCV) (de Meijer, 2004). Disponibilitatea plantelor cu titruri ridicate ale acestor „canabinoizi minori” lasă să se întrevadă noi aplicații farmaceutice interesante (Russo, 2011; Russo și Marcu, 2017).
Accesul la genomul Cannabis ar putea simplifica producția de plante THC-knockout prin intermediul tehnologiei CRISPR (clustered regularly-interspaced short palindromic repeats). În timp ce acest lucru ar putea fi atractiv pentru reproducerea industrială a cânepei, o generație anterioară de cultivare a plantelor a produs deja soiuri de cânepă care îndeplinesc cu ușurință restricțiile internaționale care necesită un conținut de 0,1% sau mai puțin de THC (Wirtshafter, 1997; McPartland et al., 2000; Small și Marcus, 2003). De fapt, canabisul fără canabinoizi și fără sintetază funcțională a acidului canabigerolic (figura 1) a fost, de asemenea, produs în mod convențional (de Meijer et al., 2009b). Astfel, rămâne neclar dacă ingineria genetică a Cannabisului este chiar necesară pentru această plantă a cărei plasticitate incredibilă prezintă deja o diversitate biochimică generoasă. Introducerea canabisului modificat genetic (OMG) ar stârni controverse considerabile în rândul anumitor segmente ale populației și ar provoca probabil o avalanșă de încurcături juridice cu privire la drepturile de brevet și de reproducere.
Se poate imagina cu ușurință o varietate de scenarii științifico-fantastice suplimentare. În anii 1990, o farsă pe internet a răspândit zvonul că un profesor apocrif Nanofsky ar fi introdus gene pentru producerea de THC în portocale (Citrus x. sinensis (L.) Osbeck). Deși acest lucru ar putea fi realizabil din punct de vedere tehnologic, un astfel de efort nu ar fi mai mult decât un număr de carnaval de laborator, având în vedere producția prodigioasă de canabinoizi din Cannabis însuși. Un chemovar invizibil de mentă piperată (Menthax piperita Lamiaceae) cu fitocanabinoizi ilicit în tricomii glandulari ai frunzelor sale ar putea fi o alegere mai logică pentru astfel de vise subversive subterane și ar putea trimite rizomi și stoloni de-a lungul cursurilor de apă din întreaga lume.
Pretențiile anterioare privind producția de canabidiol din hamei (Humulus lupulus L. Cannabaceae) și in (Linum usitatissimum L. Linaceae) nu sunt dovedite, dar acidul canabigerolic și canabigerolul au fost detectate în Helichrysum umbraculigerum Less. din Africa de Sud. Asteraceae (Bohlmann și Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; Figura 1), dar fără a se face referire la concentrația acestuia. Această afirmație a fost confirmată recent cu urme observate din probe uscate de părți aeriene (Mark Lewis, comunicare personală).
Pentru că complexitatea sintezei biochimice pur de novo a canabinoizilor a fost considerată nerentabilă din punct de vedere al costurilor (Carvalho et al., 2017), au fost sugerate gazde microbiene alternative (Zirpel et al., 2017). În 2004, s-a realizat clonarea ADNc a THCA-sintetazei THCA, care permite conversia acidului canabigerolic (CBGA) în THC (Sirikantaramas et al., 2004), iar o producție de 8% de THCA în rădăcinile păroase de tutun (Nicotiana tabacum cv.Xanthi Solanaceae) a fost demonstrată la hrănirea cu CBGA (Figura 1). Enzima a fost, de asemenea, exprimată în insecta Spodoptera frugiperda (J.E. Smith) Noctuidae (viermele militar de toamnă) prin intermediul unui baculovirus recombinant. Ulterior, acest grup de cercetare s-a orientat către drojdii, Pichia pastoris (în prezent Komagataella phaffii Phaff Saccharomycetaceae) (Taura et al., 2007; figura 1), și a obținut o conversie a CBGA în THCA de 98 % în 24 de ore, cu un randament de 32,6 mg/L de mediu. O formă recombinantă de THCA-sintetază s-a dovedit a fi de 4,5 ori mai eficientă decât în Cannabis și de 12 ori mai eficientă decât în S. frugiperda. Acest proces a fost ulterior optimizat cu o îmbunătățire de 64,5 ori a activității (Zirpel et al., 2018), cu o producție raportată în K. phaffii de 3,05 g/L de THCA după 8 h de incubare la 37°C. Un calcul simplu prevede că acest randament ar putea fi obținut, de asemenea, din extracția a doar 15 g de 20 % THCA din plante de Cannabis.
Producția terpenoidelor din Cannabis este la fel de posibilă în gazde alternative. Mutanții Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae cu deficiență în enzima farnesil difosfat sintetază acumulează în schimb geranil pirofosfat, care este redirecționat spre producția de terpenoid util din punct de vedere medical, linalool (Oswald et al., 2007; Figura 1). În mod similar, alți cercetători au exploatat capacitățile biosintetice ale mitocondriilor din S. cerevisiae pentru a crește producția de sesquiterpenoizi din farnesil difosfat (Farhi et al., 2011), deși nu sunt cei comuni cu Cannabis.
În prezent, secvențele genomice existente ale Cannabis nu sunt complet adnotate. În consecință, vor fi necesare cunoștințe aplicate și muncă de detectiv pentru a dobândi date practice privind funcția genetică la Cannabis. Cel mai mare potențial într-o astfel de investigație se va afla în domeniul epigeneticii, care stă la baza modificărilor ereditare ale expresiei genice sau ale fenotipului plantei. Cea mai evidentă deficiență este lipsa de cunoștințe în ceea ce privește reglarea producției de canabinoizi. Înțelegerea căilor de biosinteză și a reglării terpenosintetazelor care produc terpenoidele din Cannabis abia a fost inițiată (Booth et al., 2017) și rămân ținte coapte ale unor cercetări suplimentare (Russo, 2011).
O problemă suplimentară în cultivarea Cannabisului rămâne lipsa exemplarelor voucher (care sunt interzise de către US Drug Enforcement Administration fără licență Schedule I) și a depozitelor oficiale de accesiuni chemovar în depozitele de semințe și țesuturi. Aceasta din urmă a fost realizată de GW Pharmaceuticals și, în mod independent, de NaPro Research (Lewis et al., 2018) în Colecția Națională de Bacterii Industriale, Alimentare și Marine (NCIMB) din Scoția. Multe companii private au evitat să împărtășească germoplasma din cauza restricțiilor legale și a fricii de pierderea proprietății intelectuale.
Sinergia canabisului
În 1998, profesorii Raphael Mechoulam și Shimon Ben-Shabat au emis ipoteza că sistemul endocanabinoid a demonstrat un „efect de anturaj”, în care o varietate de metaboliți „inactivi” și molecule strâns înrudite au crescut în mod semnificativ activitatea canabinoizilor endogeni primari, anandamida și 2-arachidonoilglicerolul (Ben-Shabat et al., 1998). Aceștia au postulat, de asemenea, că acest lucru a ajutat la explicarea modului în care medicamentele botanice erau adesea mai eficiente decât componentele lor izolate (Mechoulam și Ben-Shabat, 1999). Deși sinteza cu o singură moleculă rămâne modelul dominant pentru dezvoltarea farmaceutică (Bonn-Miller et al., 2018), conceptul de sinergie botanică a fost amplu demonstrat în contemporaneitate, invocându-se contribuțiile farmacologice ale „canabinoizilor minori” și ale terpenoizilor din Cannabis la efectul farmacologic general al plantei (McPartland și Pruitt, 1999; McPartland și Mediavilla, 2001; McPartland și Russo, 2001, 2014; Russo și McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). Câteva exemple pertinente ale efectului de anturaj în Cannabis sunt ilustrative:
Într-un studiu randomizat și controlat al extractelor oromucoase pe bază de Cannabis la pacienții cu durere intratabilă în ciuda tratamentului optimizat cu opioide, un extract cu preponderență de THC nu a reușit să se delimiteze favorabil de placebo, în timp ce un extract din întreaga plantă (nabiximols, vide infra) cu atât THC cât și canabidiol (CBD) s-a dovedit a fi semnificativ mai bun din punct de vedere statistic decât ambele (Johnson et al., 2010), singura diferență notabilă fiind prezența CBD în acesta din urmă.
În studiile de analgezie pe animale, CBD-ul pur produce o curbă bifazică doză-răspuns, astfel încât doze mai mici reduc răspunsurile la durere până când se atinge un vârf, după care creșterile ulterioare ale dozei sunt ineficiente. În mod interesant, aplicarea unui extract de Cannabis cu spectru complet, cu doze echivalente de CBD, elimină răspunsul bifazic în favoarea unei curbe doză-răspuns liniare, astfel încât extractul botanic este analgezic la orice doză, fără a se observa un efect de plafonare (Gallily et al., 2014).
Un studiu recent efectuat pe mai multe linii celulare umane de cancer de sân în cultură și pe tumori implantate a demonstrat superioritatea unui tratament cu extract de Cannabis față de THC pur, aparent atribuibilă în cazul primului la prezența unor concentrații mici de cannabigerol (CBG) și acid tetrahidrocannabinolic (THCA) (Blasco-Benito et al., 2018).
Efectele anticonvulsivante ale canabidiolului au fost observate la animale în anii 1970, primele teste la om fiind efectuate în 1980 (Cunha et al., 1980). Un experiment recent la șoareci cu convulsii induse de pentilenetetrazol a utilizat cinci extracte diferite de canabis cu concentrații egale de CBD (Berman et al., 2018). Deși toate extractele au prezentat beneficii în comparație cu martorii netratați, au fost observate diferențe notabile în profilurile biochimice ale canabinoizilor non-CBD, care, la rândul lor, au dus la diferențe semnificative în ceea ce privește numărul de șoareci care au dezvoltat crize tonico-clonice (21,5-66,7 %) și ratele de supraviețuire (85-100 %), subliniind relevanța acestor componente „minore”. Acest studiu evidențiază necesitatea standardizării în dezvoltarea farmaceutică și, deși ar putea fi interpretat în sprijinul modelului terapeutic cu o singură moleculă (Bonn-Miller et al., 2018), este necesar să se sublinieze faptul că plantele botanice complexe pot îndeplini standardele americane ale FDA (Food and Drug Administration, 2015). În mod specific, două medicamente pe bază de canabis au obținut aprobarea de reglementare, Sativex®(nabiximoli, denumirea adoptată în SUA) în 30 de țări și Epidiolex®în Statele Unite.
Se pune atunci întrebarea: Poate fi un preparat de Cannabis sau o singură moleculă prea pură, reducând astfel potențialul sinergic? Datele recente susțin că aceasta este o posibilitate distinctă. Informațiile anecdotice de la clinicienii care utilizează extracte de Cannabis cu conținut ridicat de CBD pentru a trata epilepsia severă, cum ar fi sindroamele Dravet și Lennox-Gastaut, au arătat că pacienții lor au demonstrat o îmbunătățire notabilă a frecvenței crizelor (Goldstein, 2016; Russo, 2017; Sulak et al., 2017) cu doze mult mai mici decât cele raportate în studiile clinice oficiale ale Epidiolex, un preparat de CBD pur în proporție de 97 % cu THC eliminat (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Această observație a fost recent supusă unei meta-analize a 11 studii cu un total de 670 de pacienți (Pamplona et al., 2018). Aceste rezultate au arătat că 71% dintre pacienți s-au ameliorat cu extracte de canabis cu dominantă CBD vs. 36% cu CBD purificat (p < 0,0001). Rata de răspuns la o îmbunătățire de 50% în ceea ce privește frecvența crizelor nu a fost diferită din punct de vedere statistic în cele două grupuri și ambele grupuri au atins statutul fără crize la aproximativ 10% dintre pacienți. Cu toate acestea, dozele medii zilnice au fost net divergente în cele două grupuri: 27,1 mg/kg/zi pentru CBD purificat față de numai 6,1 mg/kg/zi pentru extractele de Cannabis bogate în CBD, o doză de numai 22,5% din cea pentru CBD singur. În plus, incidența evenimentelor adverse ușoare și severe a fost în mod demonstrabil mai mare la pacienții cu CBD purificat față de cei cu extracte bogate în CBD (p < 0,0001), un rezultat pe care autorii l-au atribuit dozei mai mici utilizate, care a fost obținută, în opinia lor, prin contribuțiile sinergice ale altor compuși din anturaj. Astfel de observații susțin ipoteza unei eficacități mai mari pentru extractele de Cannabis care combină mai multe componente anticonvulsivante, cum ar fi CBD, THC, THCA, THCV, CBDV, linalool și chiar cariofilen (Lewis et al., 2018).
Aceste studii și altele oferă o bază solidă pentru sinergia Cannabisului și un sprijin pentru dezvoltarea de medicamente botanice față de cea a unor componente unice (Bonn-Miller et al., 2018) sau producerea prin metode de fermentare în drojdie sau alte microorganisme. Un exemplu al puterii reproducerii selective convenționale este ilustrat (Figura 2), sub forma unui chemovar de Cannabis denumit CaryodiolTM pentru conținutul său sporit de cariofilen (0,83%) ca agonist CB2, împreună cu un raport THC:CBD de tip III foarte favorabil de 1:39,4. Un astfel de preparat se prefigurează a fi aplicabil în tratamentul a numeroase afecțiuni clinice, inclusiv: durere, inflamație, tulburări fibrotice, dependență, anxietate, depresie, boli autoimune, afecțiuni dermatologice și cancer (Pacher și Mechoulam, 2011; Russo, 2011; Xi și colab., 2011; Russo și Marcu, 2017; Lewis și colab., 2018). Producerea unei astfel de combinații din surse microbiene ar putea necesita combinații de canabinoizi din mai multe specii de drojdii și, prin urmare, ar reprezenta un produs combinat supus unei căi de reglementare dificile în comparație cu preparatele de canabis din extractele unei singure specii (de exemplu, nabiximol) care a fost acceptat ca formulă unitară în 30 de țări din întreaga lume (Food and Drug Administration, 2015).
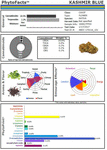
Figura 2. Reprezentarea PhytoFactsTM a conținutului de canabinoizi și terpenoizi din CaryodiolTM, cunoscut și sub numele de „Kashmir Blue”, un chemovar de tip III, cu preponderență de canabidiol și cariofilen. A se vedea (Lewis et al., 2018) pentru detalii despre PhytoFacts și metodologia de reproducere convențională. Copyright© 2016 BHC Group, LLC. Toate drepturile rezervate. Orice utilizare neautorizată a acestui document sau a imaginilor sau mărcilor de mai sus poate încălca legile privind drepturile de autor, mărcile comerciale și alte legi aplicabile.
Acest articol a prezentat pe scurt încercările tehnologice recente de „reinventare a roții fitocanabinoidelor”. Argumente convingătoare ar susține că se poate face acest lucru, dar ar trebui să se facă? Datele care susțin existența sinergiei canabisului și plasticitatea uimitoare a genomului canabisului sugerează o realitate care elimină necesitatea unor gazde alternative sau chiar a ingineriei genetice a Cannabis sativa, dovedind astfel că: „Planta o face mai bine”.”
Contribuții ale autorului
Autorul confirmă că este singurul contribuitor la această lucrare și a aprobat-o pentru publicare.
Declarație privind conflictul de interese
Sunt director de cercetare pentru Institutul Internațional de Canabis și Canabinoizi. Servim clienți implicați în comerțul cu canabis.
Recunoștințe
Autorul a apreciat asistența personalului Biroului de împrumut interbibliotecar al Universității Montana din cadrul Bibliotecii Mansfield pentru furnizarea de materiale de cercetare.
Anderson, L. C. (1980). Variația frunzelor între speciile de Cannabis dintr-o grădină controlată. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: gigantul adormit al fitoterapiei mediteraneene. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., și Bailey, E. Z. (1976). Hortus Third: A Concise Dictionary of Plants Cultivated in the United States and Canada (Hortus Third: Dicționar concis de plante cultivate în Statele Unite și Canada). New York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). Un efect de anturaj: esterii glicerolici ai acizilor grași endogeni inactivi sporesc activitatea canabinoidă a 2-arachidonoil-glicerolului. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | Full CrossRef Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). O nouă abordare ESI-LC/MS pentru profilarea metabolică cuprinzătoare a fitocanabinoizilor din Cannabis. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Aprecierea „efectului de anturaj”: acțiunea antitumorală a unui canabinoid pur față de un preparat medicamentos botanic în modele preclinice de cancer de sân. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | Full CrossRef Text | Google Scholar
Bohlmann, F., și Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., și Vandrey, R. (2018). Dezvoltarea medicamentelor pe bază de canabis și canabinoide: evaluarea abordărilor botanice versus abordări cu o singură moleculă. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., și Bohlmann, J. (2017). Terpene sintetaze din Cannabis sativa. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). Codul internațional de nomenclatură pentru plantele cultivate. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., și Stehle, F. (2017). Proiectarea microorganismelor pentru biosinteza heterologă a canabinoizilor. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., și Merlin, M. D. (2013). Cannabis: Evoluție și etnobotanică. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., și Merlin, M. D. (2016). Domesticirea canabisului, istoria reproducerii, diversitatea genetică actuală și perspectivele viitoare. Crit. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Administrarea cronică de canabidiol la voluntari sănătoși și pacienți epileptici. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | Full CrossRef Text | Google Scholar
Datwyler, S. L., and Weiblen, G. D. (2006). Variația genetică la cânepă și marijuana (Cannabis sativa L.) în funcție de polimorfismele de lungime a fragmentelor amplificate. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). „The breeding of cannabis cultivars for pharmaceutical end uses,” în Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, and P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M. M., and Hammond, K. M. (2005). Moștenirea fenotipului chimic în Cannabis sativa L. (II): plantele predominante de cannabigerol. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M. M., Hammond, K. M., and Micheler, M. (2009a). Moștenirea fenotipului chimic la Cannabis sativa L. (III): variația proporției de canabichromene. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M. M., Hammond, K. M., și Sutton, A. (2009b). Moștenirea fenotipului chimic la Cannabis sativa L. (IV): plante fără canabinoizi. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Trial of cannabidiol for drug-resistant seizures in the dravet syndrome. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol la pacienții cu epilepsie rezistentă la tratament: un studiu intervențional deschis. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Patel, A. D., Thiele, E. A. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Studiu de siguranță randomizat, în funcție de doză, al canabidiolului în sindromul Dravet. Neurology 90, e1204-e1211. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J., și Fumagalli, L. (2017). Diversitatea genetică la scară largă a Cannabis-ului pentru aplicații criminalistice. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R., și Raber, J. C. (2015). Canabinoidele și terpenele ca markeri chemotaxonomici în canabis. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Exploatarea compartimentelor subcelulare ale drojdiei pentru producerea de terpenoizi din plante. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | Textul integral | Google Scholar
Food and Drug Administration (2015). Botanical Drug Development Guidance for Industry, Ed. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). The Great Herbal of Leonhart Fuchs: De Historia Stirpium Commentarii Insignes, 1542 (Comentarii notabile asupra istoriei plantelor). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., and Hanus, L., și Hanus, L.. (2014). Depășirea răspunsului dozei în formă de clopot a canabidiolului prin utilizarea extractului de canabis îmbogățit în canabidiol. Pharmacol. Pharm. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., și Mechoulam, R. (1964). Izolarea, structura și sinteza parțială a unui constituent activ al hașișului. J. Am. Chem. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Canabisul în tratamentul epilepsiei pediatrice. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). O analiză combinată a trăsăturilor agronomice și a frecvențelor alelelor alozomiale pentru 69 de accesiuni de Cannabis. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Dovezi genetice pentru speciație la Cannabis (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., and Mahlberg, P. G. (2004). A chemotaxonomic analysis of cannabinoid variation in Cannabis (Cannabaceae). Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | Red Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., and Fallon, M. T. (2010). Studiu multicentric, dublu-orb, randomizat, controlat cu placebo, cu grupuri paralele, privind eficacitatea, siguranța și tolerabilitatea extractului de THC:CBD și a extractului de THC la pacienții cu dureri intratabile legate de cancer. J. Pain Symptom Manage. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., și Smith, K. M. (2018). Bazele farmacologice ale chemovarilor de Cannabis. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | Full CrossRef Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., și Hegman, W. (2018). Canabisul este indigen în Europa și cultivarea a început în epoca cuprului sau a bronzului: o sinteză probabilistică a studiilor de polen fosil. Veg. His. Archaeobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). Sistematica canabisului la nivel de familie, gen și specie. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., și Watson, D. P. (2000). Hemp Diseases and Pests: Management and Biological Control. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., și Guy, G. W. (2017). Modele de taxonomie a canabisului, prejudecăți culturale și conflicte între denumirile științifice și vernaculare. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., and Mediavilla, V. (2001). „Non-cannabinoizi în canabis,” în Canabis și canabinoizi, eds F. Grotenhermen și E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., și Pruitt, P. L. (1999). Efecte secundare ale produselor farmaceutice care nu sunt provocate de medicamente pe bază de plante comparabile: cazul tetrahidrocannabinolului și al marijuanei. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., și Russo, E. B. (2001). Canabisul și extractele de canabis: mai mari decât suma părților lor? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., și Russo, E. B. (2014). „Non-phytocannabinoid constituents of cannabis and herbal synergy”, în Handbook of Cannabis, Ed. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., și Ben-Shabat, S. (1999). From gan-zi-gun-nu to anandamide and 2-arachidonoylglycerol: the ongoing story of cannabis. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | Text integral | Google Scholar
Oswald, M., Fischer, M., Dirninger, N., și Karst, F. (2007). Biosinteza monoterpenoidelor în Saccharomyces cerevisiae. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., and Mechoulam, R. (2011). Este semnalizarea lipidică prin intermediul receptorilor canabinoizi 2 parte a unui sistem de protecție? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., și Coan, A. C. (2018). Beneficiile clinice potențiale ale extractelor de Cannabis bogate în CBD față de CBD purificat în epilepsia rezistentă la tratament: meta-analiză de date observaționale. Front. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., și Russo, E. B. (2016). Dezbaterea Cannabis sativa versus Cannabis indica: un interviu cu Ethan Russo, MD. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | Ref Full Text | Google Scholar
Russo, E. B. (2007). Istoria canabisului și a preparatelor sale în saga, știință și sobrietate. Chem. Biodivers. 4, 1614-1648. doi: 10.1002/cbdv.20079010144
PubMed Abstract | Full CrossRef Text | Google Scholar
Russo, E. B. (2011). Îmblânzirea THC: sinergia potențială a canabisului și efectele anturajului de fitocanabinoide-terpenoide. Br. J. Pharmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). Dincolo de Cannabis: plantele și sistemul endocannabinoid. Trends Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | Cross Full Text | Google Scholar
Russo, E. B. (2017). Canabisul și epilepsia: un tratament străvechi revine în prim-plan. Epilepsy Behav. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | Cross Full Text | Google Scholar
Russo, E. B., Jiang, H. E. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Analize fitochimice și genetice ale canabisului antic din Asia Centrală. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract | Refef Full Text | Google Scholar
Russo, E. B., and Marcu, J. (2017). Farmacologia canabisului: suspecții obișnuiți și câteva piste promițătoare. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | Refef Full Text | Google Scholar
Russo, E. B., și McPartland, J. M. (2003). Canabisul este mai mult decât pur și simplu Delta(9)-tetrahidrocannabinol. Psychopharmacology 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). The genetic structure of marijuana and hemp (Structura genetică a marijuanei și a cânepei). PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., și Lockwood, T. (1974). Cannabis: un exemplu de neglijență taxonomică. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Cristalizarea sintezei acidului delta1-tetrahidrocannabinolic (THCA) din Cannabis sativa. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). Gena care controlează psihoactivitatea marijuanei: clonarea moleculară și expresia heterologă a sintezei acidului Delta1-tetrahidrocannabinolic din Cannabis sativa L. J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | Textul integral | Google Scholar
Small, E. (2015). Evoluția și clasificarea Cannabis sativa (marijuana, cânepă) în legătură cu utilizarea umană. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: Un ghid complet. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., și Cronquist, A. (1976). O taxonomie practică și naturală pentru Cannabis. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., and Marcus, D. (2003). Nivelurile de tetrahidrocannabinol în resursele de germoplasmă de cânepă (Cannabis sativa). Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y. (2001). Furnter evidence for the paraphyly of the Celtidaceae from the chloroplast gene mat K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s00606010170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., and Goldstein, B. (2017). Situația actuală a canabisului artizanal pentru tratamentul epilepsiei în Statele Unite ale Americii. Epilepsy Behav. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., și Morimoto, S. (2007). Producerea acidului Delta(1)-tetrahidrocannabinolic de către enzima biosintetică secretată de Pichia pastoris transgenică. Biochem. Biophys. Res. Commun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., and Shoyama, Y. (1996). Purificarea și caracterizarea sintezei acidului canabidiolic din Cannabis sativa L. Analiza biochimică a unei noi enzime care catalizează oxidociclarea acidului canabigerolic în acid canabidiolic. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | Ref Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol la pacienții cu convulsii asociate cu sindromul Lennox-Gastaut (GWPCARE4): un studiu de fază 3 randomizat, dublu-orb, controlat cu placebo. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). Dicționarul Wordsmith de botanică. Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). The draft genome and transcriptome of Cannabis sativa. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | Refef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., and Guries, R. P. (1998). The Ulmaceae, o familie sau două? Dovezi din cartografierea situsurilor de restricție ale ADN-ului cloroplastic. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Canabisul medicinal: este delta9-tetrahidrocannabinolul necesar pentru toate efectele sale? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | Full Text | Google Scholar
Wirtshafter, D. (1997). „Valoarea nutrițională a semințelor de cânepă și a uleiului din semințe de cânepă”, în Cannabis in Medical Practice, Ed. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Receptorii canabinoizi CB(2) din creier modulează acțiunile cocainei la șoareci. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | Text integral | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z., și Yi, T.-S. (2013). Filogenetica moleculară și evoluția caracterelor la Cannabaceae. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., și Stehle, F. (2017). Drojdiile de inginerie ca organisme platformă pentru biosinteza canabinoidelor. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Optimizarea producției de sintetază a acidului delta(9)-tetrahidrocannabinolic în Komagataella phaffii prin identificarea gâtului de gâtul post-translațional. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text
.