- Serum Albumin
- Structure
- Funcția
- Distribuție
- Acumularea de albumină în interstițiul tumoral
- Proteine de legare a albuminei celulare
- Albondina/gp60
- gp18 și gp30
- SPARC
- hnRNPs și Calreticulin
- FcRn
- Cubilin și Megalin
- Albumina ca purtător de medicamente în oncologie
- Concluzie
- Declarație privind conflictul de interese
- Recunoștințe
Serum Albumin
Structure
Serum Albumin este cea mai abundentă proteină din plasma sanguină a tuturor vertebratelor, concentrația în serul uman fiind de 35-50 mg/mL (Peters, 1996). Albumina serică umană (HSA) are o masă moleculară de 66.348 Da și este compusă din trei domenii omoloage, numerotate I, II și III (figura 1) (He și Carter, 1992; Peters, 1996; Sugio et al., 1999). Fiecare domeniu este grupat în subdomeniile A și B care posedă motive structurale comune. Cele două regiuni principale responsabile de legarea ligandului la HSA sunt cunoscute sub numele de Sudlow’s Site I și II, situate în subdomeniul IIA și, respectiv, IIIA (figura 1) (Sudlow et al., 1976; Peters, 1996). Albumina este codificată de o singură genă, care este exprimată într-o manieră codominantă, ambele alele fiind transcrise și traduse (Hawkins și Dugaiczyk, 1982; Peters, 1996). Gena albuminei umane este localizată pe brațul lung al cromozomului 4 la poziția q13.3.
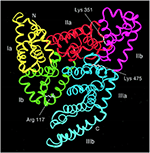
Figura 1. Structura seroalbuminei umane formată din trei domenii, fiecare grupat în subdomeniile A și B (subdomeniul Ia, galben; Ib, verde; IIa, roșu; IIb, magenta; IIIa, albastru; și IIIb, cyan). Sugio et al. (1999) cu permisiunea Oxford University Press.
Funcția
Albuma este sintetizată în principal de ficat, ficatul uman producând ~13,9 g de HSA pe zi (Peters, 1996). HSA are un timp de înjumătățire aproximativ de 19 zile și este degradată mai eficient dacă este denaturată sau alterată structural (Peters, 1996). Albumina are o varietate de funcții importante și este responsabilă pentru 80% din presiunea osmotică coloidală a sângelui (Peters, 1996). În mod semnificativ, albumina este capabilă să lege diverse molecule endogene, inclusiv acizi grași cu lanț lung, steroizi, L-triptofan etc. (Kragh-Hansen, 1981; Peters, 1996; Evans, 2002). Mai mult, albumina este, de asemenea, implicată în transportul ionilor în circulație, inclusiv cupru, zinc, calciu etc. (Peters, 1996).
În plus, această proteină vitală este capabilă să lege compuși exogeni și medicamente, cum ar fi warfarina, ibuprofenul, clorpromazina și naproxenul, afinitatea de legare a acestora afectând semnificativ activitatea și timpul de înjumătățire (Kragh-Hansen, 1981; Peters, 1996; Evans, 2002). În plus, albumina acționează, de asemenea, ca un transportor de deșeuri toxice, legând bilirubina, produsul descompunerii hemului, pentru a o transporta la ficat în vederea excreției hepatice (Peters, 1996). În mod interesant, se crede că albumina acționează, de asemenea, ca un antioxidant din cauza capacității sale de a: (1) de a proteja substanțele legate de deteriorarea peroxidantă (de exemplu, acizii grași și lipoproteinele); și (2) de a lega cuprul liber, limitând activitatea sa redox și producția de radicali liberi (Peters, 1996; Evans, 2002). În cele din urmă, albumina este o sursă de tioli care sunt agenți avizi de curățare a oxigenului reactiv și a speciilor de azot (Peters, 1996; Evans, 2002).
Distribuție
Interesant este faptul că albumina este prezentă în mod predominant în spațiul extravascular (~242 g) mai degrabă decât în spațiul intravascular (~118 g) (Peters, 1996; Evans, 2002). De fapt, proteina este predominantă în locațiile extracelulare, cum ar fi pielea, intestinul, mușchii, alte lichide (de exemplu, cerebrospinal, pleural etc.) și secreții (de exemplu, sudoare, lacrimi și lapte) (Peters, 1996). Cu toate acestea, concentrații foarte mici de albumină sunt prezente la nivel intracelular (Peters, 1996). Albumina revine din spațiul extravascular în circulație prin intermediul sistemului limfatic, făcând ~28 de „călătorii” de intrare și ieșire din sistemul limfatic în timpul vieții sale (Peters, 1996; Evans, 2002).
După secreția din hepatocite, albumina intră în circulație și se translocă în spațiul extracelular prin porii endoteliului sinusoidal sau fenestrat din anumite organe, cum ar fi ficatul, pancreasul, intestinul subțire și măduva osoasă (Peters, 1996). Cu toate acestea, în organele în care predomină un endoteliu continuu, se crede în prezent că albumina poate traversa endoteliul prin mecanisme transcitare active, inclusiv mecanisme mediate de receptori (de ex, albondina; a se vedea secțiunea intitulată „Proteine de legare a albuminei celulare”).
Acumularea de albumină în interstițiul tumoral
Tumorile solide posedă în mod obișnuit o vasculatură imatură, foarte permeabilă, asupra căreia acționează factori de creștere a permeabilității vasculare (de ex, oxidul nitric) (Carmeliet și Jain, 2000; Maeda et al., 2000; Greish, 2007; van der Veldt et al., 2008). Cu toate acestea, în ciuda acestui fapt, există, în general, un drenaj limfatic insuficient (Carmeliet și Jain, 2000; Maeda et al., 2000; Greish, 2007). Acest lucru duce ulterior la o acumulare de macromolecule (>40 kDa) în interstițiul tumoral, iar acest lucru este cunoscut sub numele de efect de permeabilitate și retenție îmbunătățită (figura 2) (Maeda et al., 2000; Greish, 2007). De interes, Matsumura și Maeda (1986) au demonstrat că un complex Evans blue-albumină injectat intravenos s-a acumulat în tumorile sarcomului 180 ale șoarecilor ddY. De atunci, retenția albuminei în tumori a fost observată în diverse tumori solide experimentale (de exemplu, sarcom, carcinom ovarian, hepatom Novikof etc.) folosind albumină serică complexată cu radiomarcat sau cu colorant (Peterson și Appelgren, 1973; Sinn et al, 1990; Andersson et al., 1991; Schilling et al., 1992; Stehle et al., 1997; Wunder et al., 1997).
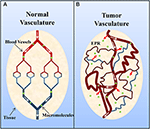
Figura 2. Reprezentarea schematică a vasculaturii (A) normale și (B) tumorale. Țesutul normal este alcătuit din vase de sânge mature, organizate, în timp ce țesutul tumoral este format din vase imature, cu scurgeri și tortuoase. Organizarea alterată a vasculaturii tumorale și rețeaua limfatică dezorganizată are ca rezultat scurgerea vasculară și acumularea de macromolecule (>40 kDa) în interstițiu și este cunoscută sub numele de efect de permeabilitate și retenție îmbunătățită (EPR). Adaptat cu permisiunea Macmillan Publishers Ltd: Nature Medicine (Jain, 2001), copyright (2001).
În plus, o serie de studii au propus că tumorile sunt un loc de catabolism al albuminei (Hradec, 1958; Andersson et al., 1991; Schilling et al., 1992; Stehle et al., 1997). De exemplu, la un model de sarcom de șoarece (C57/RL6J) căruia i s-a injectat albumină marcată cu 3H-rafinază, s-au observat niveluri de 3H de cel puțin 2-3 ori mai mari în lizozomii tumorilor în comparație cu lizozomii din țesutul normal (Andersson et al., 1991). Mai mult, studiile au demonstrat că albumina are un timp de înjumătățire mai scurt și o cifră de afaceri mai mare la șoarecii purtători de tumori, în ciuda unei creșteri compensatorii a sintezei hepatice de albumină, în comparație cu șoarecii nepurtători de tumori (Hradec, 1958). Prin urmare, s-a sugerat că tumorile utilizează albumina ca sursă de energie, prin descompunerea albuminei în aminoacizii săi componenți în lizozomi, care sunt ulterior utilizați de celulele canceroase pentru creșterea lor accelerată (Stehle et al., 1997). Mai mult, studiile au sugerat că hipoalbuminemia evidentă la pacienții cu cancer este un rezultat al catabolismului albuminei de către tumoră (Stehle et al., 1997).
Cu toate acestea, unele dintre aceste studii anterioare suferă de mai multe limitări experimentale. De exemplu, este dificil să se obțină fracții lizozomiale pure și, prin urmare, este necesar să se reproducă aceste studii și să se testeze puritatea fracțiilor cu ajutorul unor markeri de membrană și organite bine stabiliți (Graham, 2002; Yamagishi et al., 2013). În plus, mai mulți alți factori in vivo pot afecta degradarea și catabolismul albuminei (de exemplu, nivelurile de corticosteroizi) (Peters, 1996). Prin urmare, nu a fost stabilită o relație clară și sunt necesare studii suplimentare in vivo pentru a susține distribuția intracelulară și catabolismul albuminei de către tumori.
Mai recent, Commisso et al. au observat că celulele canceroase care adăpostesc mutații Ras oncogene endogene au niveluri crescute de macropinocitoză in vitro și in vivo (Commisso et al., 2013). Mai mult, s-a demonstrat că albumina marcată cu FITC a fost internalizată prin macropinocitoză și, ulterior, a dus la creșterea nivelului de glutamat și α-cetoglutarat în celulele cu mutații Ras oncogene (Commisso et al., 2013). În mod interesant, s-a demonstrat că scăderea proliferării celulelor oncogene care exprimă Ras după privarea de glutamină a fost salvată prin suplimentarea cu albumină extracelulară (Commisso et al., 2013). Aceste constatări sugerează că macropinocitoza albuminei furnizează nutrienți pentru a susține proliferarea celulelor canceroase (Commisso et al., 2013).
Proteine de legare a albuminei celulare
Considerând importanța albuminei, un număr de proteine și receptori putativi de legare a albuminei au fost identificați în diferite țesuturi și linii celulare (Tabelul 1), inclusiv în rinichi (Zhai et al., 2000; Amsellem et al., 2010), endoteliul (Schnitzer și Bravo, 1993), fibroblastele (Porter et al., 1995) și suprafețele celulelor tumorale (Fritzsche et al., 2004). În mod specific, au fost descoperite șapte proteine de legare a albuminei asociate cu membrana, și anume: albondina/glicoproteina 60 (gp60) (Schnitzer et al., 1988), glicoproteina 18 (gp18) (Ghinea et al., 1988), glicoproteina 30 (gp30) (Ghinea et al, 1988), receptorul neonatal Fc (FcRn) (Roopenian și Akilesh, 2007), ribonucleoproteinele nucleare heterogene (hnRNP) (Fritzsche et al., 2004), calreticulina (Fritzsche et al., 2004), cubilina (Zhai et al., 2000; Amsellem et al., 2010) și megalina (Zhai et al., 2000; Amsellem et al., 2010). În plus, a fost identificată o proteină secretată care se leagă de albumină, cunoscută sub numele de proteină secretată, acidă și bogată în cisteină (SPARC) (Schnitzer și Oh, 1992). Având în vedere importanța lor în absorbția albuminei de către celule, fiecare dintre aceste proteine este descrisă în detaliu mai jos.

Tabel 1. Localizarea proteinelor de legare a albuminei și a receptorilor.
Albondina/gp60
Albondina (gp60) este o glicoproteină de 60 kDa care acționează ca un receptor de albumină care este larg răspândită, dar este selectiv exprimată pe membrana plasmatică a endoteliului continuu (cu excepția creierului), unde acționează pentru a crește permeabilitatea capilară (Ghinea et al, 1988, 1989; Schnitzer și colab., 1988; Schnitzer, 1992; Schnitzer și Oh, 1994; Tiruppathi și colab., 1996). Albondina nu numai că se leagă în mod specific de albumina nativă, dar, de asemenea, facilitează internalizarea acesteia și transcitoza ulterioară (Milici et al., 1987; Schnitzer, 1992; Schnitzer și Oh, 1994; Tiruppathi et al., 1996).
S-a propus ca ~50% din albumină să părăsească lumenul capilar prin albondină, restul traversând această barieră prin joncțiuni intercelulare și/sau mecanisme de fază fluidă (Schnitzer, 1993; Schnitzer și Oh, 1994). Mai mult decât atât, s-a demonstrat că internalizarea albondinei are loc printr-un proces endocitotic dependent de caveolină, care are ca rezultat transcitoza și nu pare să intre în sistemul degradant endosom-lysosom (Schnitzer, 1993; Schnitzer și Bravo, 1993; Schnitzer și colab., 1995; Tiruppathi și colab., 1997; Iancu și colab, 2011).
gp18 și gp30
Atât gp18, cât și gp30 se leagă avid de albumina modificată conformațional (i.e., albumina marcată cu aur, albumina tratată cu formaldehidă sau anhidridă maleică) și nu interacționează preferențial cu albumina nativă, în mod similar cu alți receptori scavenger cunoscuți (Ghinea și colab., 1989; Schnitzer și Oh, 1992, 1994; Schnitzer și colab., 1992; Schnitzer și Bravo, 1993). Spre deosebire de albondină, gp18 și gp30 se găsesc pe o varietate de celule, cum ar fi macrofagele și fibroblastele, precum și pe o serie de endotelii (Schnitzer et al., 1992). Mai mult, s-a observat că gp18 este exprimată în celulele umane de cancer de sân MDA-MB-453 (Wang et al., 1994). Acești receptori scavenger se leagă și direcționează albuminele modificate pentru degradare, poate ca parte a catabolismului proteic sau ca o cale de protecție pentru a elimina albuminele alterate, vechi, deteriorate sau potențial dăunătoare (Schnitzer, 1993; Schnitzer și Bravo, 1993). Albumina poate fi modificată prin oxidare, glicare neenzimatică, maleilare etc., ca urmare a îmbătrânirii normale sau ca răspuns protector sau patologic (Schnitzer, 1993; Peters, 1996). Albumina denaturată sau modificată este degradată mai rapid și mai eficient decât albumina nativă, sugerând că aceste modificări selectează moleculele de albumină pentru degradare (Peters, 1996).
SPARC
SPARC este cunoscută și sub numele de osteonectină și BM-40 și este secretată de mai multe tipuri de celule (Brekken și Sage, 2001). Este interesant faptul că s-a constatat că SPARC este foarte bine exprimată în celulele maligne și în celulele stromale asociate cu neoplazia (Porter et al., 1995; Podhajcer et al., 2008). SPARC posedă proprietăți de legare a albuminei și interacționează în mod specific cu albumina nativă într-un mod similar cu albondina, dar diferit de 18 la gp30 care se leagă de albumina alterată conformațional (Schnitzer și Oh, 1992). În mod specific, anticorpii anti-SPARC recunosc, de asemenea, albondina, dar nu și 18 sau gp30, ceea ce sugerează că SPARC și albondina au în comun un domeniu nativ de legare a albuminei (Schnitzer și Oh, 1992). Cu toate acestea, nu există dovezi că SPARC mediază absorbția albuminei în tumori. S-a emis ipoteza că abilitatea SPARC de a se lega de albumină în interstițiul tumoral sporește acumularea medicamentelor legate de albumină în spațiul tumoral (Desai et al., 2008, 2009). Mai mult, un studiu clinic preliminar a demonstrat că expresia SPARC este corelată cu răspunsul la tratamentul cu nanoparticule de albumină încărcate cu paclitaxel (nab-paclitaxel sau Abraxane®), pacienții SPARC-pozitivi având un rezultat clinic mai bun (Desai et al., 2009). Cu toate acestea, date contradictorii într-un model de șoarece KPfC au contestat această ipoteză, deoarece deficitul de SPARC nu a modificat concentrațiile intra-tumorale de Abraxane® (Neesse et al., 2014). În consecință, sunt necesare studii suplimentare pentru a valida această ipoteză, inclusiv studii clinice mai ample care să implice un număr mai mare de pacienți. În prezent, un studiu de fază III (NCT00785291), realizat de National Cancer Institute, evaluează dacă expresia SPARC în ser prezice răspunsul pacienților la Abraxane®, iar acest lucru ar putea să ne ajute să înțelegem mai bine rolul SPARC în acumularea de albumină de către tumori.
hnRNPs și Calreticulin
Cinci proteine diferite care se leagă de albumină au fost identificate din membranele plasmatice ale unor linii de celule canceroase umane (de ex, leucemie cu celule T CCRF-CEM, melanom MV3 și carcinom mamar MCF7) (Fritzsche et al., 2004). Patru dintre aceste proteine au fost identificate ca fiind membre ale familiei hnRNP, inclusiv hnRNP A2/B1, hnRNP C1, hnRNP A1 și hnRNP A3, iar a cincea proteină s-a dovedit a fi calreticulina (Fritzsche et al., 2004). Calreticulina a fost descrisă pentru prima dată ca fiind o chaperonă a reticulului endoplasmatic și o proteină de semnalizare a calciului, dar de atunci s-a demonstrat că este implicată în mai multe funcții celulare, inclusiv în adeziunea celulară, modularea interacțiunilor plachetă-colagen (vindecarea rănilor) și apoptoza (Mendlovic și Conconi, 2010). Funcțiile familiei hnRNP nu sunt bine caracterizate. Cu toate acestea, cei mai mulți membri ai familiei hnRNP au fost descriși ca proteine nucleare de legare a ARN implicate în procesarea pre-ARNm, cum ar fi splicingul ARN, exportul și stabilitatea (Chaudhury et al., 2010). În mod interesant, s-a propus ca hnRNP-urile să joace un rol în carcinogeneză, unde supraexpresia lor acționează ca biomarkeri pentru detectarea timpurie a tumorilor (Han et al., 2013). Semnificația acestor constatări este în prezent neclară și rămâne de stabilit dacă aceste proteine sunt implicate în absorbția mediată de albumină.
FcRn
FcRn este exprimată în mai multe tipuri de celule și țesuturi, inclusiv în celulele prezentatoare de antigen, endoteliul vascular, intestinul, plămânii, rinichii și bariera hemato-encefalică (BBB) (de ex, endoteliul și plexul coroidian) (Roopenian și Akilesh, 2007). Acest receptor protejează albumina și IgG, de degradare prin legarea ambelor proteine cu afinitate ridicată doar la un pH scăzut (pH < 6,5) în endosomi acizi, împiedicând degradarea lor prin calea lizozomală și returnându-le în spațiul extracelular (pH 7,4) (Chaudhury et al., 2003; Ober et al., 2004; Anderson et al., 2006; Andersen et al., 2012). Prin urmare, acest lucru prelungește perioada de înjumătățire a albuminei serice (Chaudhury et al., 2003; Anderson et al., 2006; Sarav et al., 2009). Rolul acestui receptor în absorbția albuminei de către tumori rămâne neclar.
Cubilin și Megalin
Cubilin este un receptor multi-ligand care este cel mai recunoscut pentru implicarea sa în absorbția intestinală a complexului de vitamina B12 cu factor intrinsec (Seetharam et al., 1997). Mai mult, s-a demonstrat că cubilina este implicată în endocitoza și transportul transcelular al numeroșilor liganzi, inclusiv al albuminei (Birn et al., 2000). Cubilina este localizată în celulele intestinale absorbante, în placentă, în celulele viscerale ale sacului vitelin și în tubulii proximali ai rinichilor (Christensen și Birn, 2002). Megalina este o proteină trans-membranară mare care s-a demonstrat, de asemenea, că se leagă de albumină (Cui et al., 1996). Această proteină este exprimată pe scară mai largă decât cubilina, fiind prezentă în plexul coroid, în celulele tubulilor proximali renali, în tirocite etc. (tabelul 1) (Christensen și Birn, 2002).
Interesant este faptul că megalina se leagă de cubilină cu o afinitate ridicată și s-a sugerat că megalina contribuie la internalizarea complexelor cubilină-ligand ca și co-receptor (Moestrup și colab., 1998; Christensen și Birn, 2002). Mai mult, cubilina se leagă, de asemenea, de amnionless, o proteină care este necesară pentru exprimarea cubilinei pe membrana celulară (Amsellem et al., 2010). Cubilina, împreună cu megalina, are un rol esențial în preluarea albuminei (adică în reabsorbția) de către tubulii proximali ai rinichilor (Zhai et al., 2000; Amsellem et al., 2010). S-a demonstrat că deficitul de cubilină și/sau megalină la șoareci și câini determină o scădere a absorbției de albumină în tubulii proximali, ceea ce duce la albuminurie (Birn et al., 2000; Amsellem et al., 2010). În plus, pacienții cu sindromul Imerslund-Gräsbeck, cauzat de o mutație în gena cubilinei, suferă în general de proteinurie, demonstrând importanța cubilinei în reabsorbția renală a proteinelor (Grasbeck, 2006).
Albumina ca purtător de medicamente în oncologie
Considerând efectul sporit de permeabilitate și retenție și acumularea albuminei în interstițiul tumoral, dezvoltarea albuminei ca purtător de medicamente este din ce în ce mai important de luat în considerare în ceea ce privește administrarea țintită a terapiei împotriva cancerului (Kratz, 2008, 2010). S-a propus, de asemenea, că purtătorii de albumină profită de prezența albondinei pe endoteliu și a SPARC în interstițiul tumoral pentru a crește acumularea de medicamente în spațiul tumoral (Desai et al., 2009; Kratz, 2010). Au fost dezvoltate diverse sisteme de eliberare a medicamentelor cu albumină, inclusiv nanoparticule de albumină, conjugate medicament-albumină, derivați de medicamente care se leagă de albumină și promedicamente (pentru recenzii, a se vedea Kratz, 2008, 2010).
Dezvoltarea și aprobarea pe piață a nanoparticulei de albumină încărcată cu paclitaxel, nab-paclitaxel sau Abraxane®, a reprezentat un progres major în domeniul dezvoltării purtătorilor de albumină. Abraxane® a fost aprobat inițial pentru utilizare clinică în Statele Unite în 2005 (Kudlowitz și Muggia, 2014). Această nanoparticulă de albumină este indicată pentru tratamentul cancerului de sân metastatic, după eșecul chimioterapiei combinate (Kudlowitz și Muggia, 2014). Mai recent, Abraxane® a fost descris, de asemenea, pentru tratamentul de primă intenție al pacienților cu adenocarcinom de pancreas metastatic, în asociere cu gemcitabină, și al pacienților cu carcinom pulmonar cu celule non-mici local avansat sau metastatic, în asociere cu carboplatin (Kudlowitz și Muggia, 2014). Abraxane® are un indice terapeutic mai mare decât paclitaxel singur, putând fi administrat la doze mai mari, cu mai puțină toxicitate și mai multă eficacitate decât terapia tradițională cu paclitaxel (Gradishar et al., 2005; Socinski et al., 2012; Iwamoto, 2013). În prezent, Abraxane® este încă în curs de evaluare în cadrul unor studii clinice pentru alte tumori, cum ar fi cancerul de vezică urinară (NCT00583349) și mielomul multiplu (NCT02075021).
În plus, se evaluează, de asemenea, legarea de albumină ca strategie generală pentru îmbunătățirea farmacocineticii medicamentelor. În mod tradițional, se consideră că legarea unui medicament de albumină reduce nivelul de medicament liber disponibil pentru a-și exercita activitatea terapeutică (Lancon et al., 2004; Vuignier et al., 2010). Cu toate acestea, studiile au demonstrat, de asemenea, mecanisme prin care albumina acționează pentru a îmbunătăți în mod eficient utilizarea terapeutică sau pentru a reduce eliminarea rapidă (Dennis et al., 2002; Merlot și Richardson, 2014). De exemplu, s-a demonstrat că tiosemicarbazona experimentală anticancerigenă, și anume di-2-piridilcetona 4,4-dimetil-3-tiosemicarbazona (Dp44mT) (Merlot et al., 2013a), este internalizată de celulele canceroase prin intermediul unui purtător/receptor putativ (Merlot et al., 2013b; Merlot și Richardson, 2014). Interesant este faptul că absorbția, toxicitatea și activitatea apoptotică a Dp44mT sunt mult îmbunătățite în prezența HSA (Merlot și Richardson, 2014). Având în vedere că Dp44mT țintește lizozomii pentru a induce apoptoza (Lovejoy et al., 2011) și că HSA este potențial supus catabolismului lizozomal în tumori (Andersson et al., 1991; Stehle et al., 1997), se poate emite ipoteza că HSA facilitează livrarea Dp44mT către lizozomi, sporind activitatea sa anticancerigenă (Merlot și Richardson, 2014). Deși studiile nu au identificat încă mecanismul exact al procesului de absorbție stimulat de HSA, legarea de albumină poate oferi un avantaj atunci când se generează agenți de direcționare a tumorilor, iar acest lucru necesită în continuare investigații intense.
Concluzie
Albumina este o proteină versatilă și captivantă. Având în vedere marea izolare a albuminei în spațiul vascular și interstițial, distribuția intracelulară a albuminei a rămas slab caracterizată timp de mulți ani. Ar putea fi posibil ca albumina, în condiții specifice sau în timpul stresului celular, să fie preluată de celulele normale și de celulele tumorale la niveluri scăzute și, respectiv, ridicate, datorită ratei lor metabolice. Rolul exact al unor proteine de legare a albuminei incomplet caracterizate (de exemplu, hnRNP și calreticulina) în medierea absorbției albuminei rămâne să fie determinat. Cu toate acestea, căutarea și caracterizarea proteinelor care se leagă de albumină, în special în celulele canceroase, prezintă un interes considerabil în lumina dezvoltării albuminei ca purtător eficient de medicamente pentru a viza tumorile.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Angelica M. Merlot este beneficiara unui grant de cercetare la începutul carierei de la Universitatea din Sydney. Des R. Richardson este beneficiarul unei burse de cercetare principală și a unor granturi de proiect de la National Health and Medical Research Council (NHMRC). Danuta S. Kalinowski este beneficiara unui grant de proiect NHMRC (1048972) și a unei burse Helen and Robert Ellis Fellowship de la Fundația Școlii de Medicină din Sydney a Universității din Sydney.
Amsellem, S., Gburek, J., Hamard, G., Nielsen, R., Willnow, T. E., Devuyst, O., et al. (2010). Cubilina este esențială pentru reabsorbția albuminei în tubulii proximali renali. J. Am. Soc. Nephrol. 21, 1859-1867. doi: 10.1681/ASN.2010050492
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Andersen, J. T., Dalhus, B., Cameron, J., Daba, M. B., Plumridge, A., Evans, L., et al. (2012). Mutageneza bazată pe structură dezvăluie locul de legare a albuminei din receptorul Fc neonatal. Nat. Commun. 3, 610. doi: 10.1038/ncomms1607
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Anderson, C. L., Chaudhury, C., Kim, J., Bronson, C. L., Wani, M. A., și Mohanty, S. (2006). Perspective-FcRn transportă albumina: relevanță pentru imunologie și medicină. Trends Immunol. 27, 343-348. doi: 10.1016/j.it.2006.05.004
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Andersson, C., Iresjo, B. M., și Lundholm, K. (1991). Identificarea situsurilor tisulare pentru o degradare crescută a albuminei la șoarecii purtători de sarcoame. J. Surg. Res. 50, 156-162. doi: 10.1016/0022-4804(91)90240-M
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Birn, H., Fyfe, J. C., Jacobsen, C., Mounier, F., Verroust, P. J., Orskov, H., et al. (2000). Cubilina este o proteină de legare a albuminei importantă pentru reabsorbția tubulară renală a albuminei. J. Clin. Invest. 105, 1353-1361. doi: 10.1172/JCI8862
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Brekken, R. A., and Sage, E. H. (2001). SPARC, o proteină matricelulară: la răscrucea comunicării celulă-matrice. Matrix Biol. 19, 816-827. doi: 10.1016/S0945-053X(00)00133-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Carmeliet, P., and Jain, R. K. (2000). Angiogeneza în cancer și alte boli. Nature 407, 249-257. doi: 10.1038/35025220
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Chaudhury, A., Chander, P., and Howe, P. H. (2010). Heterogeneous nuclear ribonucleoproteins (hnRNPs) in cellular processes: focus on hnRNP E1’s multifunctional regulatory roles. RNA 16, 1449-1462. doi: 10.1261/rna.2254110
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | CrossRef Full Text
Chaudhury, C., Mehnaz, S., Robinson, J. M., Hayton, W. L., Pearl, D. K., Roopenian, D. C., et al. (2003). Receptorul Fc pentru IgG (FcRn) legat de complexul major de histocompatibilitate se leagă de albumină și își prelungește durata de viață. J. Exp. Med. 197, 315-322. doi: 10.1084/jem.20021829
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Christensen, E. I., și Birn, H. (2002). Megalin și cubilin: receptori endocitari multifuncționali. Nat. Rev. Mol. Cell Biol. 3, 256-266. doi: 10.1038/nrm778
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Commisso, C., Davidson, S. M., Soydaner-Azeloglu, R. G., Parker, S. J., Kamphorst, J. J. J., Hackett, S., et al. (2013). Macropinocitoza proteinelor este o cale de aprovizionare cu aminoacizi în celulele transformate de Ras. Nature 497, 633-637. doi: 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Cui, S., Verroust, P. J., Moestrup, S. K., și Christensen, E. I. (1996). Megalin/gp330 mediază absorbția albuminei în tubulii proximali renali. Am. J. Physiol. 271, F900-F907. doi: 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Dennis, M. S., Zhang, M., Meng, Y. G., Y. G., Kadkhodayan, M., Kirchhofer, D., Combs, D., et al. (2002). Legarea albuminei ca strategie generală pentru îmbunătățirea farmacocineticii proteinelor. J. Biol. Chem. 277, 35035-35043. doi: 10.1074/jbc.M205854200
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Desai, N., Trieu, V., Damascelli, B., și Soon-Shiong, P. (2009). Expresia SPARC se corelează cu răspunsul tumoral la paclitaxel legat de albumină la pacienții cu cancer la cap și gât. Transl. Oncol. 2, 59-64. doi: 10.1593/tlo.09109
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Desai, N. P., Trieu, V., Hwang, L. Y., Wu, R., Soon-Shiong, P., și Gradishar, W. J. (2008). Eficacitatea îmbunătățită a paclitaxelului legat de nanoparticule de albumină (nab) față de docetaxel pe bază de polisorbat în xenogrefe multiple, în funcție de statutul HER2 și SPARC. Anticancer Drugs 19, 899-909. doi: 10.1097/CAD.0b013e32830f9046
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Evans, T. W. (2002). Articol de revizuire: albumina ca medicament-efecte biologice ale albuminei fără legătură cu presiunea oncotică. Aliment. Pharmacol. Ther. 16(Suppl. 5), 6-11. doi: 10.1046/j.1365-2036.2002.00190.x
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Fritzsche, T., Schnolzer, M., Fiedler, S., Weigand, M., Wiessler, M., and Frei, E. (2004). Izolarea și identificarea ribonucleoproteinelor nucleare eterogene (hnRNP) din membranele plasmatice purificate ale liniilor de celule tumorale umane ca proteine care se leagă de albumină. Biochem. Pharmacol. 67, 655-665. doi: 10.1016/j.bcp.2003.09.027
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Ghinea, N., Eskenasy, M., Simionescu, M., și Simionescu, N. (1989). Proteinele de legare a albuminei endoteliale sunt componente asociate membranei expuse pe suprafața celulară. J. Biol. Chem. 264, 4755-4758.
Pubmed Abstract | Pubmed Full Text
Ghinea, N., Fixman, A., Alexandru, D., Popov, D., Hasu, M., Ghitescu, L., et al. (1988). Identificarea proteinelor care se leagă de albumină în celulele endoteliale capilare. J. Cell Biol. 107, 231-239.
Pubmed Abstract | Pubmed Full Text
Gradishar, W. J., Tjulandin, S., Davidson, N., Shaw, H., Desai, N., Bhar, P., et al. (2005). Studiu de fază III al paclitaxelului legat de nanoparticule de albumină comparativ cu paclitaxel pe bază de ulei de ricin polietilenat la femeile cu cancer de sân. J. Clin. Oncol. 23, 7794-7803. doi: 10.1200/JCO.2005.04.937
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Graham, J. M. (2002). Prepararea fracțiunilor subcelulare brute prin centrifugare diferențială. ScientificWorldJournal 2, 1638-1642. doi: 10.1100/tsw.2002.851
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Grasbeck, R. (2006). Sindromul Imerslund-Grasbeck (malabsorbție selectivă de vitamina B(12) cu proteinurie). Orphanet. J. Rare Dis. 1:17. doi: 10.1186/1750-1172-1-17
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Greish, K. (2007). Permeabilitatea și retenția îmbunătățită a medicamentelor macromoleculare în tumorile solide: o poartă regală pentru nanomedicamentele anticanceroase țintite. J. Drug Target. 15, 457-464. doi: 10.1080/10611860701539584
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Han, N., Li, W., și Zhang, M. (2013). Funcția proteinei de legare a ARN hnRNP în metastaza cancerului. J. Cancer Res. Ther. 9(Suppl.), S129-S134. doi: 10.4103/0973-1482.122506
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Hawkins, J. W., și Dugaiczyk, A. (1982). Gena seroalbuminei umane: structura unui locus unic. Gene 19, 55-58. doi: 10.1016/0378-1119(82)90188-3
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Pubmed Full Text
He, X. M., and Carter, D. C. (1992). Structura atomică și chimia albuminei serice umane. Nature 358, 209-215. doi: 10.1038/358209a0
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Hradec, J. (1958). Metabolismul albuminei serice la șobolanii purtători de tumori. Br. J. Cancer 12, 290-304. doi: 10.1038/bjc.1958.35
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Iancu, C., Mocan, L., Bele, C., Orza, A. I., Tabaran, F. A., Catoi, C., et al. (2011). Ablația termică cu laser îmbunătățită pentru tratamentul in vitro al cancerului hepatic prin livrarea specifică de nanotuburi de carbon cu mai multe pereți funcționalizate cu albumină serică umană. Int. J. Nanomed. 6, 129-141. doi: 10.2147/IJN.S15841
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Iwamoto, T. (2013). Aplicarea clinică a sistemelor de eliberare a medicamentelor în chimioterapia cancerului: revizuire a eficacității și a efectelor secundare ale medicamentelor aprobate. Biol. Pharm. Bull. 36, 715-718. doi: 10.1248/bpb.b12-01102
Pubmed Abstract | Pubmed Full Text | Ref Full Text
Jain, R. K. (2001). Normalizarea vasculaturii tumorale cu terapia anti-angiogenică: o nouă paradigmă pentru terapia combinată. Nat. Med. 7, 987-989. doi: 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Kragh-Hansen, U. (1981). Aspecte moleculare ale legării ligandului la albumina serică. Pharmacol. Rev. 33, 17-53. doi: 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Kratz, F. (2008). Albumina ca purtător de medicamente: proiectarea de promedicamente, conjugate de medicamente și nanoparticule. J. Control. Release 132, 171-183. doi: 10.1016/j.jconrel.2008.05.010
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Kratz, F. (2010). Albumina, un purtător versatil în oncologie. Int. J. Clin. Pharmacol. Ther. 48, 453-455. doi: 10.5414/CPP48453
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Kudlowitz, D., și Muggia, F. (2014). Paclitaxel legat de nanoparticule de albumină (nab-paclitaxel): extinderea indicațiilor sale. Expert Opin. Drug Saf. 13, 681-685. doi: 10.1517/14740338.2014.910193
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Lancon, A., Delmas, D., Osman, H., Thenot, J. P., Jannin, B., și Latruffe, N. (2004). Absorbția resveratrolului de către celulele hepatice umane: implicarea atât a difuziei pasive, cât și a procesului mediat de transport. Biochem. Biophys. Res. Comm. 316, 1132-1137. doi: 10.1016/j.bbrc.2004.02.164
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Lovejoy, D. B., Jansson, P. J., Brunk, U. T., Wong, J., Ponka, P., și Richardson, D. R. (2011). Activitatea antitumorală a compusului de chelare a metalelor Dp44mT este mediată de formarea unui complex de cupru redox-activ care se acumulează în lizozomi. Cancer Res. 71, 5871-5880. doi: 10.1158/0008-5472.CAN-11-1218
Pubmed Abstract | Pubmed Full Text |Ref Full Text
Maeda, H., Wu, J., Sawa, T., Matsumura, Y., și Hori, K. (2000). Permeabilitatea vasculară tumorală și efectul EPR în terapeutica macromoleculară: o analiză. J. Control. Release 65, 271-284. doi: 10.1016/S0168-3659(99)00248-5
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text
Matsumura, Y., and Maeda, H. (1986). Un nou concept pentru terapeutica macromoleculară în chimioterapia cancerului: mecanismul de acumulare tumoritropică a proteinelor și a agentului antitumoral smancs. Cancer Res. 46, 6387-6392.
Pubmed Abstract | Pubmed Full Text
Mendlovic, F., și Conconi, M. (2010). Calreticulina: o proteină cu multiple fațete. Nature Educ. 4, 1.
Merlot, A. M., Kalinowski, D. S., și Richardson, D. R. (2013a). Noi chelatori pentru tratamentul cancerului: unde ne aflăm acum? Antioxid. Redox Signal. 18, 973-1006. doi: 10.1089/ars.2012.4540
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Merlot, A. M., Pantarat, N., Menezes, S. V., Sahni, S., Richardson, D. R., și Kalinowski, D. S. (2013b). Absorbția celulară a agentului antitumoral Dp44mT are loc prin intermediul unui mecanism mediat de transport/receptor. Mol. Pharmacol. 84, 911-924. doi: 10.1124/mol.113.088393
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Merlot, A. M., și Richardson, D. R. (2014). Recunoașterea receptorilor și direcționarea lizozomală pentru a spori citotoxicitatea noilor agenți anticancerigeni care leagă fierul și cuprul. Vitam. Miner. 3:e125. doi: 10.4172/vms.1000e125
CrossRef Full Text
Milici, A. J., Watrous, N. E., Stukenbrok, H., și Palade, G. E. (1987). Transcitoza albuminei în endoteliul capilar. J. Cell Biol. 105, 2603-2612.
Pubmed Abstract | Pubmed Full Text
Moestrup, S. K., Kozyraki, R., Kristiansen, M., Kaysen, J. H., Rasmussen, H. H. H., Brault, D., et al. (1998). Receptorul factorului intrinsec-receptor al vitaminei B12 și țintă a anticorpilor teratogeni este o proteină membranară periferică de legare a megalinei cu homologie cu proteinele de dezvoltare. J. Biol. Chem. 273, 5235-5242. doi: 10.1074/jbc.273.9.5235
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Neesse, A., Frese, K. K. K., Chan, D. S., Bapiro, T. E., Howat, W. J., Richards, F. M., et al. (2014). Eliberarea independentă de SPARC a medicamentului și efectele antitumorale ale nab-paclitaxelului la șoarecii modificați genetic. Gut 63, 974-983. doi: 10.1136/gutjnl-2013-305559
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text |Ref Full Text
Ober, R. J., Martinez, C., Lai, X., Zhou, J., și Ward, E. S. (2004). Exocitoza IgG ca fiind mediată de receptorul FcRn: o analiză la nivelul unei singure molecule. Proc. Natl. acad. Sci. U.S.A. 101, 11076-11081. doi: 10.1073/pnas.0402970101
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Peters, T. (1996). Totul despre albumină: Biochimie, genetică și aplicații medicale. San Diego, CA: Academic Press Limited.
Peterson, H. I., și Appelgren, K. L. (1973). Studii experimentale privind absorbția și reținerea proteinelor marcate într-o tumoră de șobolan. Eur. J. Cancer 9, 543-547. doi: 10.1016/0014-2964(73)90142-4
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Podhajcer, O. L., Benedetti, L. G., Girotti, M. R., Prada, F., Salvatierra, E. și Llera, A. S. (2008). Rolul proteinei matricelulare SPARC în interacțiunea dinamică dintre tumoră și gazdă. Cancer Metastasis Rev. 27, 691-705. doi: 10.1007/s10555-008-9146-7
CrossRef Full Text
Porter, P. L., Sage, E. H., Lane, T. F., Funk, S. E., și Gown, A. M. (1995). Distribuția SPARC în țesutul uman normal și neoplazic. J. Histochem. Cytochem. 43, 791-800. doi: 10.1177/43.8.7622842
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Roopenian, D. C., and Akilesh, S. (2007). FcRn: receptorul Fc neonatal ajunge la maturitate. Nat. Rev. Immunol. 7, 715-725. doi: 10.1038/nri2155
Pubmed Abstract | Pubmed Full Cross |Ref Full Text
Sarav, M., Wang, Y., Hack, B. K., Chang, A., Jensen, M., Bao, L., et al. (2009). FcRn renală recuperează albumina, dar facilitează eliminarea IgG. J. Am. Soc. Nephrol. 20, 1941-1952. doi: 10.1681/ASN.2008090976
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Schilling, U., Friedrich, E. A., Sinn, H., Schrenk, H. H. H., Clorius, J. H., și Maier-Borst, W. (1992). Proiectarea de compuși cu absorbție tumorală îmbunătățită, folosind ser-albumina ca suport – Partea II. Studii in vivo. Int. J. Rad. Appl. Instrum. B 19, 685-695. doi: 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Schnitzer, J. E. (1992). gp60 este o glicoproteină care se leagă de albumină exprimată de endoteliul continuu implicat în transcitoza albuminei. Am. J. Physiol. 262, H246-H254. doi: 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
Schnitzer, J. E. (1993). Actualizare privind baza celulară și moleculară a permeabilității capilare. Trends Cardiovasc. Med. 3, 124-130. doi: 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Refef Full Text
Schnitzer, J. E., Allard, J., and Oh, P. (1995). NEM inhibă transcitoza, endocitoza și permeabilitatea capilară: implicarea fuziunii caveolelor în endotelii. Am. J. Physiol. 268, H48-H55.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., și Bravo, J. (1993). Legarea de mare afinitate, endocitoza și degradarea albuminelor modificate conformațional. Rolul potențial al gp30 și gp18 ca noi receptori scavenger. J. Biol. Chem. 268, 7562-7570.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Carley, W. W., și Palade, G. E. (1988). Albumina interacționează în mod specific cu o glicoproteină endotelială microvasculară de 60-kDa. Proc. Natl. acad. Sci. U.S.A. 85, 6773-6777. doi: 10.1073/pnas.85.18.6773
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Schnitzer, J. E., și Oh, P. (1992). Anticorpii împotriva SPARC inhibă legarea albuminei la SPARC, gp60 și la endoteliul microvascular. Am. J. Physiol. 263, H1872-H1879.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., și Oh, P. (1994). Permeabilitatea capilară mediată de albondină la albumină. Rolul diferențial al receptorilor în transcitoza endotelială și endocitoza albuminelor native și modificate. J. Biol. Chem. 269, 6072-6082.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Sung, A., Horvat, R., și Bravo, J. (1992). Interacțiunea preferențială a proteinelor de legare a albuminei, gp30 și gp18, cu albumine modificate conformațional. Prezența în multe celule și țesuturi cu un posibil rol în catabolism. J. Biol. Chem. 267, 24544-24553.
Pubmed Abstract | Pubmed Full Text
Seetharam, B., Christensen, E. I., Moestrup, S. K., Hammond, T. G., și Verroust, P. J. (1997). Identificarea proteinei țintă a sacului vitelin de șobolan a anticorpilor teratogeni, gp280, ca receptor al factorului intrinsec-cobalamină. J. Clin. Invest. 99, 2317-2322. doi: 10.1172/JCI119411
Pubmed Abstract | Pubmed Full Cross |Ref Full Text
Sinn, H., Schrenk, H. H. H., Friedrich, E. A., Schilling, U., și Maier-Borst, W. (1990). Proiectarea compușilor care au o absorbție tumorală îmbunătățită, folosind ser-albumina ca suport. Partea I. Int. J. Rad. Appl. Instrum. B 17, 819-827. doi: 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Ref Full Text
Socinski, M. A., Bondarenko, I., Karaseva, N. A., Makhson, A. M., Vynnychenko, I., Okamoto, I., et al. (2012). Nab-paclitaxel săptămânal în combinație cu carboplatin versus paclitaxel pe bază de solvent plus carboplatin ca terapie de primă linie la pacienții cu cancer pulmonar avansat fără celule mici: rezultatele finale ale unui studiu de fază III. J. Clin. Oncol. 30, 2055-2062. doi: 10.1200/JCO.2011.39.5848
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Stehle, G., Sinn, H., Wunder, A., Schrenk, H. H. H., Stewart, J. C., Hartung, G., et al. (1997). Catabolismul proteinelor plasmatice (albumină) de către tumora însăși – implicații pentru metabolismul tumoral și geneza cașexiei. Crit. Rev. Oncol. Hematol. 26, 77-100. doi: 10.1016/S1040-8428(97)00015-2
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text |Ref Full Text
Sudlow, G., Birkett, D. J., and Wade, D. N. (1976). Caracterizarea suplimentară a situsurilor specifice de legare a medicamentelor pe albumina serică umană. Mol. Pharmacol. 12, 1052-1061.
Pubmed Abstract | Pubmed Full Text
Sugio, S., Kashima, A., Mochizuki, S., Noda, M., și Kobayashi, K. (1999). Structura cristalină a albuminei serice umane la o rezoluție de 2,5 A. Protein Eng. 12, 439-446. doi: 10.1093/protein/12.6.439
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Tiruppathi, C., Finnegan, A., and Malik, A. B. (1996). Izolarea și caracterizarea unei proteine de legare a albuminei de suprafață celulară din celulele endoteliale vasculare. Proc. Natl. acad. Sci. U.S.A. 93, 250-254. doi: 10.1073/pnas.93.1.250
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Tiruppathi, C., Song, W., Bergenfeldt, M., Sass, P., and Malik, A. B. (1997). Activarea Gp60 mediază transcitoza albuminei în celulele endoteliale prin calea dependentă de tirozină kinază. J. Biol. Chem. 272, 25968-25975. doi: 10.1074/jbc.272.41.25968
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross | Refef Full Text
van der Veldt, A. A., Luurtsema, G., Lubberink, M., Lammertsma, A. A., și Hendrikse, N. H. (2008). Planificarea individualizată a tratamentului în oncologie: rolul PET și al medicamentelor anticanceroase radiomarcate în prezicerea rezistenței tumorale. Curr. Pharm. Des. 14, 2914-2931. doi: 10.2174/138161208786404344
Pubmed Abstract | Pubmed Full Text | Refef Full Text
Vuignier, K., Schappler, J., Veuthey, J. L., Carrupt, P. A., și Martel, S. (2010). Legătura medicament-proteină: o revizuire critică a instrumentelor analitice. Anal. Bioanal. Chem. 398, 53-66. doi: 10.1007/s00216-010-3737-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, J., Ueno, H., Masuko, T., și Hashimoto, Y. (1994). Legarea albuminei serice de celulele tumorale și caracterizarea proteinei de legare a albuminei. J. Biochem. 115, 898-903.
Pubmed Abstract | Pubmed Full Text
Wunder, A., Stehle, G., Sinn, H., Schrenk, H., Hoffbiederbeck, D., Bader, F., et al. (1997). Absorbția sporită a albuminei de către tumorile de șobolan. Int. J. Oncol. 11, 497-507. doi: 10.3892/ijo.11.3.497
Pubmed Abstract | Pubmed Full Text | Pubmed Full Text | Refef Full Text
Yamagishi, T., Sahni, S., Sharp, D. M., Arvind, A., Jansson, P. J. J., și Richardson, D. R. (2013). P-glicoproteina P mediază rezistența la medicamente prin intermediul unui mecanism nou care implică sechestrarea lizozomală. J. Biol. Chem. 288, 31761-31771. doi: 10.1074/jbc.M113.514091
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Zhai, X. Y., Nielsen, R., Birn, H., Drumm, K., Mildenberger, S., Freudinger, R., et al. (2000). Absorbția de albumină mediată de cubilină și megalină în celulele tubulare proximale cultivate ale rinichiului de opossum. Kidney Int. 58, 1523-1533. doi: 10.1046/j.1523-1755.2000.00314.x
Pubmed Abstract | Pubmed Full Text | Refef Full Text
.