- Introducere
- Materiale și metode
- Animale și locuințe
- Tratament cu gaboxadol și cronologie experimentală
- Open Field Test (OFT)
- Testul aleilor succesive (SAT)
- Testul de explorare lumină-întuneric (LDT)
- Interacțiune socială (SI), comportamente agresive
- Stereotipie
- Autogrijirea
- Analiză statistică
- Rezultate
- Gaboxadolul normalizează hiperactivitatea observată la șoarecii Fmr1 KO2
- Comportamentele asemănătoare anxietății la șoarecii Fmr1 KO2 sunt normalizate de gaboxadol
- Iritabilitatea și comportamentele agresive la șoarecii Fmr1 KO2 sunt normalizate de gaboxadol
- Gaboxadolul normalizează comportamentele repetitive la șoarecii Fmr1 KO2
- Discuție
- Declarație etică
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
Introducere
Sindromul X fragil (FXS) este cea mai frecventă formă moștenită de dizabilitate intelectuală și autism, cu o frecvență estimată de 1:4.000-5.000, afectând toate grupurile etnice din întreaga lume (Gross et al., 2015). Persoanele cu FXS prezintă un risc crescut pentru o serie de probleme comportamentale asociate, inclusiv: probleme de atenție, hiperactivitate, anxietate și multe caracteristici asociate cu autismul, inclusiv stereotipii motorii, evitarea socială, comportament auto-vătămător și agresivitate (Hagerman et al., 2010). În plus, persoanele cu FXS sunt predispuse la probleme medicale comorbide, inclusiv convulsii, tulburări de somn, dificultăți gastrointestinale și probleme ale țesutului conjunctiv. Intervențiile comportamentale și managementul farmacologic al simptomelor discrete sunt oferite indivizilor cu FXS, dar în prezent nu există terapii aprobate de FDA pentru a trata sindromul în ansamblul său.
FXS este rezultatul unor mutații în gena FMR1 care blochează expresia proteinei retardului mental X fragil (FMRP). FMRP este o proteină de legare a ARNm exprimată omniprezent, necesară pentru transportul și traducerea a 4%-8% din proteinele sinaptice și, astfel, reglează o varietate de funcții sinaptice (Bassell și Warren, 2008). Rolul FMRP în FXS și evaluarea substanțelor terapeutice candidate au fost studiate în mare parte prin utilizarea unui model de șoarece Fmr1 knock-out (KO) caracterizat pentru prima dată de consorțiul olandez-belgian Fragile X (Bakker et al., 1994). Modelul Fmr1 KO a fost generat prin inserția direcționată a unei casete de neomicină în exonul 5 al genei FMR1, rezultând un șoarece care avea niveluri nedetectabile de proteină FMRP și niveluri scăzute de ARNm Fmr1 rezidual (Bakker et al., 1994). Șoarecele Fmr1 KO2 vizează o nouă alelă nulă la Fmr1 generată prin deleția promotorului și a primului exon al Fmr1 (Mientjes et al., 2006). Acesta este nul atât pentru proteină, cât și pentru ARNm. Acest model a fost utilizat pe scară largă pentru testarea medicamentelor (Deacon et al., 2015; Cheng et al., 2017; Gaudissard et al., 2017; Dahlhaus, 2018; Leboucher et al., 2019; Tranfaglia et al., 2019), iar bateria de teste comportamentale s-a axat în mare parte pe hiperactivitate, sensibilitate crescută la stimuli auditivi, stereotipie și deficite în învățare și memorie (Olmos-Serrano et al., 2011). La nivel celular și al circuitelor, studiile asupra șoarecilor FXS s-au concentrat în mare parte pe semnalizarea hiperactivă a receptorului metabotropic al glutamatului 5 (mGluR5) (Dölen et al., 2007), pe sinteza crescută a proteinelor (Osterweil et al., 2010), și potențarea sporită pe termen lung (LTP; Auerbach și Bear, 2010).
A apărut, de asemenea, o ipoteză ergică a acidului γ-aminobutiric (GABA) a FXS, bazată pe observații de la persoane cu FXS și șoareci cărora le lipsește o copie activă a genei Fmr1. GABA este principalul neurotransmițător inhibitor din creier și semnalează post-sinaptic fie prin intermediul receptorilor ionotropi rapizi (GABAA), fie prin intermediul receptorilor metabotropi lenți (GABAB). În cadrul populației de receptori GABAA, se face o distincție suplimentară între receptorii sinaptici și extrasinaptici care mediază inhibiția fazică și, respectiv, tonică (Olmos-Serrano et al., 2010; Meera et al., 2011). În sprijinul ipotezei GABAergice, indivizii cu FXS prezintă o disponibilitate redusă a receptorilor GABAA (D’Hulst et al., 2015). Acest rezultat de la indivizii cu FXS este bine pus în paralel cu constatările într-un model de șoarece al bolii.
Studiile moleculare au arătat scăderi ale mașinăriei GABAergice, inclusiv modificări ale subunităților receptorilor GABA, ale transportatorului GABA (Rotschafer et al., 2015) și ale decarboxilazei acidului glutamic (GAD; D’Hulst și Kooy, 2007; Olmos-Serrano et al., 2010). Mai precis, s-a raportat că nivelurile ARNm pentru gena care codifică subunitatea delta a subunității receptorului GABAA-specifică pentru populația extrasinaptică de receptori-este redusă (Gantois et al., 2006). În ceea ce privește funcția GABAergică, eliberarea de GABA sinaptic a fost redusă, iar inhibiția fazică și tonică a fost diminuată în amigdala (Olmos-Serrano et al., 2010).
În ceea ce privește comportamentul, hiperactivitatea, tresărirea auditivă, precum și învățarea și memoria observate la șoarecii FX au fost corelate cu pierderea tonusului inhibitor de la intrările GABAergice în cerebel și amigdala (Olmos-Serrano et al., 2010), două regiuni ale creierului legate, de asemenea, de FXS la om (Lightbody și Reiss, 2009; Hall și colab, 2013).
Mai important, potențarea selectivă a receptorilor GABAA extrasinaptici care conțin subunitatea delta (dSEGAs) cu gaboxadol, cunoscut și sub numele de OV101 și 4,5,6,7-tetrahidroizoxazolo(5,4-c)piridin-3-ol (THIP), a normalizat hiperactivitatea aberantă și răspunsurile de startle auditiv la șoarecii Fmr1 KO (Olmos-Serrano et al., 2010). Este important de remarcat faptul că aceste rezultate au fost observate la expuneri echivalente cu cele la care gaboxadolul este bine tolerat la om (Meera et al., 2011).
Pentru că studiile clinice inițiale nu au arătat încă niciun beneficiu terapeutic al inhibitorilor mGluR5 (Scharf et al., 2015), în studiul de față, am căutat să explorăm abordări care ar putea informa mai direct un plan clinic, incluzând aspecte mai largi ale fenotipului FXS care nu au fost raportate anterior. În mod specific, aici am investigat efectele diferitelor doze de gaboxadol asupra hiperactivității, anxietății, agresivității și comportamentelor repetitive în modelul Fmr1 KO2 de FXS, demonstrând potențialul de eficacitate al gaboxadolului pentru tratarea acestor simptome FXS.
Materiale și metode
Animale și locuințe
Șoareci Fmr1 KO2, generați anterior prin ștergerea promotorului și a primului exon al Fmr1, rezultând șoareci cu ARNm și proteină nulă (Mientjes et al, 2006), au fost utilizați pentru toate experimentele. Șoarecii Fmr1 floxați au fost împerecheați cu șoareci care exprimau o Cre-recombinază timpurie exprimată ubicuitar, ceea ce a dus la eliminarea Fmr1 din toate celulele. Șoarecii KO au fost încrucișați timp de cel puțin opt generații cu șoareci C57BL/6J, iar partenerii sălbatici (WT) au fost utilizați ca martori. Zece șoareci (masculi, în vârstă de 2 luni) au fost utilizați pentru fiecare grup de tratament în toate experimentele comportamentale. S-au folosit perechi de reproducere heterozigote pentru a genera perechi de descendenți WT și KO pentru toate studiile. Masculii au fost îndepărtați din cuștile de reproducere după naștere, femelele au fost sacrificate din puiet și genotiparea a fost efectuată cu ajutorul TransnetXY Automated Genotyping (Transnetyx, Inc., Cordova, TN, SUA), folosind primeri și protocolul stabilit. Șoarecii din aceeași cușcă au fost injectați cu aceeași doză de gaboxadol sau vehicul, iar mutanții și martorii au fost adăpostiți separat. Toți șoarecii au fost adăpostiți în grup în cuști de plastic (35 × 30 × 12 cm), câte cinci pe cușcă, și au fost obișnuiți cu animalăria timp de cel puțin o săptămână înainte de testare. Temperatura camerei (21 ± 2°C), umiditatea relativă (55 ± 5%), un ciclu lumină-întuneric de 12 ore (luminile aprinse de la 7 dimineața la 7 seara) și schimbul de aer (de 16 ori pe oră) au fost controlate automat. Toți șoarecii au avut acces ad libitum la hrană și apă. Toate testele au fost efectuate în faza de lumină de către un investigator orb în ceea ce privește genotipul și tratamentul medicamentos. Cazarea și experimentele au avut loc la GeN DDI Limited (Londra, Marea Britanie), în conformitate cu cerințele Legii britanice privind animalele (proceduri științifice) din 1986.
Tratament cu gaboxadol și cronologie experimentală
Șoarecii FMR1 KO2 au fost injectați cu vehicul (0.9% soluție salină sterilă) sau gaboxadol (0,5, 1, 1,5, 1,5, 2, 3, 4 sau 5 mg/kg, i.p.) cu 30 min înainte de testarea comportamentală în fiecare zi de testare, cu un interval de trei zile între fiecare test pentru a evita orice efect cumulativ al administrării medicamentului. Șoarecii de tip sălbatic injectați cu vehicul la același moment au fost, de asemenea, incluși în toate experimentele. Selecția comportamentală a șoarecilor (n = 10 per grup) a fost efectuată în următoarea ordine, cu 2-3 zile între fiecare test: Open Field Test (OFT; ziua 1), alei succesive (ziua 4), cutie de lumină/întuneric (ziua 7), teste sociale și agresivitate (ziua 10) și autogrijire și stereotipie (ziua 12).
Open Field Test (OFT)
În ziua de testare 1, OFT a fost efectuat într-o cameră de monitorizare a activității VersaMax (AccuScan Instruments, Columbus, OH, SUA). Activitatea locomotorie a fost înregistrată timp de 30 de minute într-o cameră mare din plexiglas (40 × 40 cm) iluminată la 40-lux. Activitatea a fost monitorizată prin întreruperi ale fasciculului infraroșu care au fost combinate în intervale de 1 minut și decodificate cu ajutorul software-ului VersaDat (AccuScan Instruments, Columbus, OH, SUA) pentru a determina distanța parcursă (cm), distanța centrală parcursă (cm), rotațiile în sensul acelor de ceasornic și în sens invers (de cel puțin 5.08 cm în diametru), și întreruperile repetitive ale fasciculului.
Testul aleilor succesive (SAT)
În ziua 4 de testare, șoarecii au fost supuși testului aleilor succesive (SAT). SAT are un avantaj față de labirintul elevat plus, deoarece pune între paranteze o gamă mai largă de niveluri de anxietate (Deacon, 2013). Camera de testare a constat din patru alei succesive, dispuse liniar, din ce în ce mai anxiogene (culoare mai deschisă, pereți mai mici, mai înguste), care aveau o lungime de 25 cm și o înălțime de 50 cm de la sol. Șoarecii au fost observați pe o perioadă de 5 minute sub o lumină roșie de 60 W poziționată deasupra aparatului. S-a înregistrat numărul de intrări în fiecare alee.
Testul de explorare lumină-întuneric (LDT)
În ziua 7 de testare, șoarecii au fost supuși testului de explorare lumină-întuneric (LDT). LDT este utilizat pe scară largă pentru a măsura comportamentul asemănător anxietății la șoareci pe baza fricii lor înnăscute de spațiile deschise și luminoase (Prut și Belzung, 2003). Camera de testare din polipropilenă (44 × 21 × 21 cm) a fost împărțită într-un compartiment mai mic, întunecat, acoperit (14 cm) și un compartiment mai mare, deschis, luminat puternic (28 cm), printr-un perete despărțitor întunecat cu o mică deschidere (13 × 5 cm). Tranzițiile dintre compartimente au fost înregistrate de celule fotoelectrice amplasate în deschiderea partiției. Fiecare șoarece a fost plasat în partea luminoasă orientată spre partea opusă peretelui despărțitor, i s-a permis să exploreze liber camera timp de 10 minute, iar tranzițiile între camere au fost înregistrate.
În ziua 10 de testare, testele de interacțiune socială (SI) și de agresivitate au fost efectuate într-o cușcă de dimensiuni similare cu cea de acasă (40 × 23 × 12 cm), cu un capac din Perspex pentru a facilita vizualizarea șoarecilor. Șoarecii au fost obișnuiți cu camera de testare timp de 25 de minute. Doi subiecți, un șoarece experimental și un șoarece „test” de tip sălbatic, au fost apoi plasați simultan în cușca de testare. Durata totală și numărul total de investigații sociale, zornăitul cozii, numărul de mușcături și numărul de montări au fost înregistrate de sus și măsurate timp de 3 min.
Stereotipie
În ziua 12 de testare, ratele de stereotipie spontană (mișcări ale capului) au fost evaluate cu ajutorul unui aparat fotocelular automat modificat (Columbus Instruments, Columbus, OH, SUA). Protocolul de testare a implicat scoaterea șoarecilor din cuștile lor de acasă și plasarea lor individuală în cuști de testare din plexiglas (22 × 25 × 28 cm). Șoarecii au fost lăsați netulburați timp de 2 minute pentru a se obișnui cu camera de testare. Apoi, fiecare șoarece a fost monitorizat timp de 3 minute pentru a genera un scor de stereotipie care corespunde cu frecvența medie a stereotipiei pe oră. Hrana și apa au fost furnizate pe toată durata perioadei de testare. Numărul de stereotipii este o cuantificare a numărului de ori de câte ori un șoarece interferează cu același fascicul infraroșu într-un episod de activitate stereotipică, așa cum este măsurat de aparatul de testare.
Autogrijirea
De asemenea, în ziua 12 de testare, a fost monitorizată autogrijirea. Fiecare șoarece a fost plasat individual într-o cușcă standard pentru șoareci (46 × 23,5 × 20 cm) iluminată la 40-lux. După o perioadă de obișnuință de 5 minute în cușca de testare, timpul cumulativ petrecut pentru toaletarea oricărei regiuni corporale a fost înregistrat timp de 3 minute pentru a determina timpul cumulativ (în secunde) de toaletare a oricărei regiuni corporale.
Analiză statistică
Din moment ce șoarecii Fmr1 KO2 au fost tratați cu gaboxadol sau vehicul, dar șoarecii WT au fost tratați doar cu vehicul, datele parametrice au fost analizate folosind analiza varianței într-o singură direcție (ANOVA) și testul post hoc al lui Tukey. Toate datele au fost analizate utilizând GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, SUA). Semnificația statistică a fost stabilită la P < 0,05.
Rezultate
Gaboxadolul normalizează hiperactivitatea observată la șoarecii Fmr1 KO2
Hiperactivitatea este o caracteristică proeminentă a FXS uman (Bailey și colab, 2008; Wheeler et al., 2014; Hagerman et al., 2017) și a fost reprodusă în mod fiabil la șoarecele Fmr1 KO olandez-belgian caracterizat anterior (Olmos-Serrano et al., 2010; Kazdoba et al., 2014). Pentru a testa dacă șoarecii Fmr1 KO2 au prezentat hiperactivitate locomotorie și dacă gaboxadolul ar putea normaliza acest comportament aberant, șoarecii Fmr1 KO2 au fost injectați cu vehicul sau gaboxadol (0,5-5 mg / kg, i.p.), iar partenerii de litieră WT au fost injectați cu vehicul 30 min înainte de testare în OFT. Distanța totală parcursă (cm) în OFT a fost înregistrată timp de 30 min. Rezultatele au arătat că distanța parcursă de șoarecii Fmr1 KO2 a fost semnificativ crescută în comparație cu martorii de litieră WT (Figura 1, F(8,81) = 21,27, p < 0,0001), în concordanță cu rezultatele altor modele de FXS. Tratamentul cu gaboxadol (0,5 mg/kg) a normalizat distanța parcursă de șoarecii Fmr1 KO2 la nivelurile de activitate WT (Figura 1). Dozele mai mari de gaboxadol (1-5 mg/kg, i.p.) nu au avut niciun efect asupra activității locomotorii la șoarecii Fmr1 KO2 (Figura 1). Aceste rezultate nu au fost atribuite efectelor sedative ale gaboxadolului, deoarece la șoarecii WT C57Bl/6 sau BALB/c, dozele de gaboxadol de până la 2,0 mg/kg, i.p. nu au niciun efect asupra activității locomotorii într-o OFT de 60 minute (date nearătate), în concordanță cu lucrările anterioare care nu arată niciun efect al gaboxadolului asupra locomoției la șoarecii WT (Olmos-Serrano și colab, 2011) sau șobolani (Silverman et al., 2016).
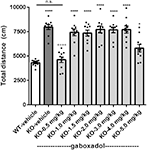
Figura 1. Gaboxadolul normalizează hiperactivitatea la șoarecii Fmr1 KO2. Distanța totală parcursă timp de 30 min pentru șoarecii de tip sălbatic (WT) tratați cu vehicul (bară albă), șoarecii Fmr1 KO2 tratați cu vehicul (knockout, KO bară gri închis) și șoarecii Fmr1 KO2 tratați cu gaboxadol (KO-0,5-5,0 mg/kg, bare gri deschis). Barele sunt medii ± SEM, punctele sunt date brute de la șoareci individuali. *p < 0,05, ****p < 0,0001 față de grupul WT-vehicul; ns, nesemnificativ față de grupul WT-vehicul; ++++p < 0,0001 față de grupul Fmr1 KO2-vehicul. N = 10 per grup.
Comportamentele asemănătoare anxietății la șoarecii Fmr1 KO2 sunt normalizate de gaboxadol
Pentru a evalua efectul gaboxadolului asupra comportamentelor asemănătoare anxietății la șoarecii Fmr1 KO2, au fost utilizate trei teste comportamentale diferite: distanța centrală parcursă în OFT, LDT și SAT. Creșterea distanței parcurse în centru este interpretată ca o scădere a anxietății și profită de preferința inerentă a șoarecilor de a rămâne în perimetru atunci când sunt introduși într-un mediu nou. Șoarecii Fmr1 KO2 au fost injectați cu gaboxadol (0,5-5 mg/kg, i.p.), iar partenerii de litieră WT au fost injectați cu vehicul cu 30 de minute înainte de a fi plasați în OFT timp de 30 de minute. Distanța totală parcursă în centru a fost semnificativ mai mare la șoarecii Fmr1 KO2 în comparație cu controalele WT (Figura 2A, F(8,81) = 21,32, p < 0,0001). Tratamentul cu gaboxadol (0,5 mg/kg, i.p.) a normalizat efectul Fmr1 KO2 asupra distanței parcurse în centru la niveluri comparabile cu controalele WT (Figura 2A). Dozele mai mari de gaboxadol (1-5 mg/kg) nu au avut niciun efect asupra șoarecilor Fmr1 KO2 în acest test (Figura 2A).
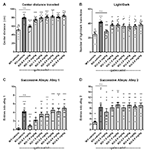
Figura 2. Gaboxadolul normalizează comportamentele legate de anxietate la șoarecii Fmr1 KO2. Șoarecii WT tratați cu vehicul (bară albă), șoarecii Fmr1 KO2 tratați cu vehicul (KO, bară gri închis) sau șoarecii Fmr1 KO2 tratați cu gaboxadol (KO-0,5-5,0 mg/kg, bare gri deschis) au fost supuși testului de câmp deschis (OFT), testului de explorare lumină/întuneric (LDT) și testului de alei succesive (SAT). (A) Distanța totală parcursă în centrul OFT. (B) Numărul de tranziții între compartimentele de lumină și întuneric în LDT. (C) Numărul de intrări în Aleea 1 în timpul SAT. (D) Numărul de intrări în Aleea 2 în timpul SAT. Barele reprezintă medii ± SEM, iar punctele reprezintă date brute de la șoareci individuali. ****p < 0,0001, ***p < 0,001, **p < 0,01, *p < 0,05 față de grupul WT-vehicul; ns, nesemnificativ față de grupul WT-vehicul; ++++p < 0,0001, +++p < 0,001, ++p < 0,01 față de grupul Fmr1 KO2-vehicul. N = 10 per grup.
În continuare, LDT, care profită de preferința naturală a șoarecilor pentru medii întunecate și protejate, a fost folosit ca un alt test comportamental pentru anxietate. Dorința de a explora compartimentul luminos al camerei, măsurată prin numărul de tranziții între compartimente, este interpretată ca un comportament anxiolitic și este sensibilă la tratamentul cu agenți anxiolitici (Bourin și Hascoët, 2003). Șoarecii Fmr1 KO2 au prezentat un număr semnificativ mai mare de tranziții între compartimente în LDT în comparație cu șoarecii WT (Figura 2B, F(8,81) = 5.819, p < 0.0001). Gaboxadolul (0,5 mg/kg, i.p.) a normalizat fenotipul comportamental al șoarecilor Fmr1 KO2 la nivelurile WT (Figura 2B). Dozele mai mari de gaboxadol nu au avut niciun efect asupra tranzițiilor lumină/întuneric ale șoarecilor Fmr1 KO2 (Figura 2B).
În cele din urmă, rezultatele de la SAT au întărit faptul că fenotipul legat de anxietate observat la șoarecii Fmr1 KO2 ar putea fi normalizat prin tratamentul cu gaboxadol. Acest test este utilizat ca o variantă mai sensibilă a Elevated Plus Maze și este alcătuit din patru alei liniare, succesive, din ce în ce mai anxiogene (Deacon, 2013). Numărul de intrări în aleile 2-4 evaluează comportamentul anxios (Deacon, 2013), în timp ce intrările crescute în aleea 1 sunt în concordanță cu hiperactivitatea generală (Deacon, 2013). Este important faptul că lucrările anterioare au arătat că hiperactivitatea locomotorie nu duce la rezultate fals pozitive în acest test (revizuit în Deacon, 2013). Șoarecii Fmr1 KO2 au prezentat un număr crescut de intrări în aleea 1 (Figura 2C, F(8,81) = 11.50, p < 0.0001), în concordanță cu o activitate locomotorie crescută și cu fenotipul de hiperactivitate prezentat în Figura 1. Șoarecii Fmr1 KO2 au prezentat, de asemenea, un număr semnificativ mai mare de intrări în aleea 2 în comparație cu controalele WT (Figura 2D, F(8,81) = 4,925, p < 0,0001), susținând un fenotip legat de anxietate. Injectarea de gaboxadol (0,5 mg / kg) în șoarecii Fmr1 KO2 30 min înainte de testare a normalizat intrările în aleile 1 și 2 la nivelurile controalelor WT (figurile 2C, D). Dozele mai mari de gaboxadol nu au avut niciun efect asupra șoarecilor Fmr1 KO2 în SAT (figurile 2C,D). Intrările în aleile 3 și 4 au fost semnificativ crescute la șoarecii Fmr1 KO2 în raport cu martorii WT, dar nu s-a observat niciun beneficiu evident al gaboxadolului cu nicio doză testată (nu se arată).
Iritabilitatea și comportamentele agresive la șoarecii Fmr1 KO2 sunt normalizate de gaboxadol
Ca și în cazul altor forme de autism sindromic, o proporție mare de indivizi cu FXS prezintă iritabilitate, anxietate socială și agresivitate. Aceste comportamente aberante pot fi modelate la rozătoare prin caracterizarea SI între un șoarece de test și un nou coleg de cușcă. Pentru a testa ipoteza că iritabilitatea și agresivitatea au fost crescute la mutanții Fmr1 KO2, am cuantificat cazurile de zornăit coada, comportamentul de mușcătură, comportamentul de montare și latența la atac. Șoarecii au fost injectați cu vehicul sau cu gaboxadol (0,5-5 mg/kg, i.p.) cu 30 de minute înainte de a fi plasați în cușca de testare.
Tocăitul cozii, sau vibrațiile rapide ale cozii, reflectă agresivitatea și tendința de luptă. Șoarecii Fmr1 KO2 au prezentat o frecvență semnificativ crescută a zornăitului cozii în comparație cu controalele WT (Figura 3A, F(8,81) = 16,03, p < 0,0001). Gaboxadolul (0,5, 1,5 și 5,0 mg/kg) a normalizat efectul la șoarecii Fmr1 KO2 la niveluri comparabile cu controalele WT (Figura 3A).
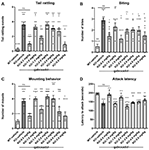
Figura 3. Gaboxadolul normalizează comportamentele de iritabilitate și agresivitate la șoarecii Fmr1 KO2. Zăngănitul cozii (A), comportamentul de mușcătură (B), comportamentul de montare (C) și latența de a ataca un nou coleg de cușcă (D) au fost măsurate la șoarecii WT tratați cu vehicul (bară albă), la șoarecii Fmr1 KO2 tratați cu vehicul (KO, bară gri închis) sau la șoarecii Fmr1 KO2 tratați cu gaboxadol (KO-0,5-5,0 mg/kg, bare gri deschis). Barele sunt medii ± SEM, punctele sunt date brute de la șoareci individuali. ****p < 0,0001,***p < 0,001,**p < 0,01, *p < 0,05 față de grupul WT-vehicul; ns, nesemnificativ față de grupul WT-vehicul; ++++p < 0,0001, +++p < 0,001, ++p < 0,01, +p < 0,05 față de grupul Fmr1 KO2-vehicul. N = 10 per grup.
Ca și zornăitul cozii, mușcătura este o măsură a agresivității la șoareci. Șoarecii Fmr1 KO2 au prezentat un număr semnificativ mai mare de mușcături în comparație cu controalele WT (Figura 3B, F(8,81) = 5,446, p < 0,0001). Gaboxadolul (0,5, 1,5 și 5,0 mg/kg) a scăzut semnificativ numărul de mușcături făcute de șoarecii Fmr1 KO2 (Figura 3B). Cu toate acestea, la unele dintre dozele testate (1,0, 3,0 și 4,0 mg/kg), comportamentul de mușcătură a rămas semnificativ crescut în comparație cu grupurile WT-vehicule și nu a fost modificat semnificativ în comparație cu controalele KO-vehicule (Figura 3B).
La șoarecii masculi, comportamentul de montare este o afirmare agresivă a dominanței sociale. Șoarecii Fmr1 KO2 au prezentat un număr semnificativ mai mare de montări în comparație cu controalele WT (Figura 3C, F(8,81) = 9,008, p < 0,001). Tratamentul cu gaboxadol (0,5, 1,5, 4,0 și 5,0 mg / kg) a scăzut semnificativ comportamentul de montare la șoarecii Fmr1 KO2, iar efectele dozelor de 0,5 și 5,0 mg / kg au fost semnificative din punct de vedere statistic în comparație cu controalele tratate cu KO-vehicule (Figura 3C). La șoarecii Fmr1 KO2 tratați cu 1,5 și 4,0 mg/kg de gaboxadol, comportamentul de montare nu a fost semnificativ diferit față de șoarecii tratați cu WT-vehicul, sugerând o tendință pentru un efect la aceste doze, chiar dacă comparația lor cu grupul tratat cu KO-vehicul nu a atins semnificația statistică (Figura 3C).
În cele din urmă, latența de a ataca un șoarece nou întâlnit a fost înregistrată ca o altă măsură a agresivității. Șoarecii Fmr1 KO2 au prezentat o latență de atac semnificativ mai mică în comparație cu partenerii de litieră WT (Figura 3D, F(8,81) = 17,22, p < 0,0001). Latența redusă la atac a fost normalizată la șoarecii Fmr1 KO2 tratați cu gaboxadol (0,5, 1,5 mg / kg; Figura 3D).
Gaboxadolul normalizează comportamentele repetitive la șoarecii Fmr1 KO2
Perseverarea și comportamentele repetitive sunt frecvente la persoanele cu FXS și sunt foarte perturbatoare (Arron et al., 2011; Leekam et al., 2011; Hall et al., 2016). Pentru a testa ipoteza că astfel de trăsături ar putea fi observate la animalele Fmr1 KO2, am cuantificat încercuirea, auto-îngrijirea și stereotipia la șoarecii mutanți WT și Fmr1 KO2. Revoluțiile în sens invers acelor de ceasornic (CCW) au fost măsurate în camera de testare după ce șoarecii au fost injectați cu vehicul sau gaboxadol (0,5-5 mg/kg, i.p.). Șoarecii Fmr1 KO2 au prezentat revoluții CCW semnificativ mai mari în timpul testului de 5 min în comparație cu controalele WT (Figura 4A, F(8,81) = 25.46, p < 0.0001). Injectarea de gaboxadol (0,5, 1,0 mg / kg) în șoarecii Fmr1 KO2 a restabilit numărul de revoluții CCW la nivelurile WT (Figura 4A). Nu a existat nici un efect al genotipului asupra cercurilor în sensul acelor de ceasornic (p = 0,386, datele nu sunt prezentate).

Figura 4. Gaboxadolul normalizează comportamentele repetitive la șoarecii Fmr1 KO2. Șoarecii WT tratați cu vehicul (bară albă), șoarecii Fmr1 KO2 tratați cu vehicul (KO, bară gri închis) sau șoarecii Fmr1 KO2 tratați cu gaboxadol (KO-0,5-5,0 mg/kg, bare gri deschis) au fost supuși la patru teste care măsoară comportamentele repetitive. (A) Revoluțiile în sens invers acelor de ceasornic (CCW) au fost măsurate prin întreruperi ale fasciculului infraroșu în timpul unui test 5-min în câmpul deschis. (B) După o obișnuință de 5-min la cușca de testare, este indicat timpul petrecut la toaletare timp de 3 min. (C) Este indicat numărul de stereotipii (evenimente de legănare a capului) în timpul unei perioade de testare de 3 minute. Barele sunt medii ± SEM, punctele sunt date brute de la șoareci individuali. ****p < 0,0001 față de grupul WT-vehicul; ns, nesemnificativ față de grupul WT-vehicul; ++++p < 0,0001 față de grupul Fmr1 KO2-vehicul. N = 10 per grup.
Timpul petrecut la toaletare a fost semnificativ mai mare la șoarecii Fmr1 KO2 comparativ cu controalele WT (Figura 4B, F(8,81) = 41,99, p < 0,0001). La șoarecii Fmr1 KO2, injectarea de gaboxadol (0,5 mg/kg) a normalizat timpul petrecut la toaletare la nivelurile WT (Figura 4B).
Stereotipia este definită ca mișcări repetitive și ritualice și este frecventă în autism și FXS. La șoareci, activitățile stereotipe, cum ar fi legănatul capului, pot fi măsurate prin cuantificarea întreruperilor fasciculului infraroșu în cușca de testare. Numărul de stereotipii a fost semnificativ crescut la șoarecii Fmr1 KO2 în comparație cu controalele WT (Figura 4C, F(8,81) = 19.93, p < 0.0001). Șoarecii Fmr1 KO2 injectați cu gaboxadol (0,5 mg/kg) au avut un comportament stereotipic normalizat înapoi la nivelurile WT (Figura 4C).
Discuție
Simptomele clinice ale FXS pot include hiperactivitate, anxietate, deficiențe de memorie și învățare, anomalii sociale, agresivitate și comportamente repetitive. În toate cazurile, tratamentul cu 0,5 mg/kg gaboxadol a restabilit comportamentul șoarecilor Fmr1 KO2 la nivelurile WT (rezumate în figura 5). Aceste date oferă un sprijin suplimentar pentru creșterea activității dSEGA și a inhibiției tonice prin gaboxadol ca strategie terapeutică care merită investigată în continuare la persoanele cu FXS.

Figura 5. Efectele comportamentale globale ale gaboxadolului la șoarecii Fmr1 KO2. Rezumatul rezultatelor evaluării comportamentale a șoarecilor Fmr1 KO2 tratați cu vehicul sau cu gaboxadol (0,5-5,0 mg/kg) în comparație cu martorii WT de pe litieră. Șoarecii Fmr1 KO2 au prezentat fenotipuri semnificative în activitatea locomotorie, comportamente legate de anxietate, iritabilitate și agresivitate și comportamente repetitive. Toate aceste fenotipuri au fost normalizate în mod constant la nivelurile WT prin tratamentul cu gaboxadol la doza de 0,5 mg/kg. Comportamentul „normal” (pătrate verzi) este în concordanță cu cel al șoarecilor WT tratați cu vehicule și este diferit statistic de cel al șoarecilor Fmr1 KO2 (KO) tratați cu vehicule. Comportamentul „anormal” (pătrate roșii) este în concordanță cu șoarecii Fmr1 KO2 (KO) tratați cu vehiculul și este diferit statistic față de șoarecii WT tratați cu vehiculul. Pătratele galbene indică o diferență care fie nu este semnificativ diferită față de șoarecii WT, fie este diferită statistic față de șoarecii tratați cu vehiculul Fmr1 KO2 (KO).
Hiperactivitatea locomotorie este o caracteristică a FXS uman (Bailey et al., 2008; Wheeler et al., 2014; Hagerman et al., 2017). În studiul actual, șoarecii Fmr1 KO2 au prezentat o activitate locomotorie crescută care a fost normalizată de gaboxadol. Lucrările anterioare la șoarecii Fmr1 KO olandezi-belgieni Fmr1 au arătat, de asemenea, un fenotip consistent de hiperactivitate care a fost inversat cu tratamentul cu gaboxadol, însă la o doză mai mare (Olmos-Serrano et al., 2011). Printre explicațiile potențiale pentru această diferență se numără: reglarea diferențiată a ARNm Gabrd (D’Hulst et al., 2006; Curia et al., 2009), expresia de suprafață modificată a receptorilor GABA extrasinaptici (Zhang et al., 2017), efecte asupra structurii creierului (Lai et al., 2016) sau diferențe în manifestările comportamentale ale mutației (Pietropaolo et al., 2011; Spencer et al., 2011). Fiecare dintre acestea ar putea fi mediată de rezultatul fondului genetic, deoarece lucrările anterioare au fost realizate folosind șoareci FVB, în timp ce animalele studiate aici au fost C57BL/6J. Diferențele subtile în echipamentul de laborator, manipularea animalelor și chiar condițiile de adăpostire, care sunt modificatori bine stabiliți ai comportamentului șoarecilor, ar putea, de asemenea, să contribuie (Crabbe et al., 1999; Wahlsten et al., 2006).
Rezultatele celor trei teste de anxietate, distanța centrală în OFT, cutia de lumină/întuneric și SAT, demonstrează un fenotip robust la șoarecele Fmr1 KO2, care este inversat de tratamentul cu gaboxadol. Trebuie remarcat faptul că hiperactivitatea ar putea confunda rezultatele OFT și ale boxei lumină/întuneric. Cu toate acestea, comportamentul legat de anxietate observat în SAT apare independent de modificările activității locomotorii (revizuit în Deacon, 2013); și în timp ce efectul anxietății în KO este în direcția opusă față de ceea ce se observă la pacienții cu FXS (Bailey și colab., 2008), rezultatele noastre sunt în concordanță cu rapoartele anterioare care descriu fenotipul șoarecilor FXS (revizuit de Kazdoba și colab., 2014). Cu toate acestea, va fi important ca studiile viitoare să urmărească să elucideze în continuare efectul anxietății la acești șoareci. În ciuda acestui fapt, și mai ales, datele noastre demonstrează că gaboxadolul normalizează comportamentul aberant de anxietate observat în modelul de șoareci FXS, precum și în toate celelalte comportamente evaluate în analizele noastre.
Irritabilitatea și comportamentele agresive, modelate prin măsurarea SI cu un nou partener de cușcă, au fost, de asemenea, crescute la șoarecii Fmr1 KO2 și inversate de gaboxadol. Un studiu recent a raportat că aproape toți (>90%) bărbații și femelele cu FXS intervievați s-au implicat în unele agresiuni în ultimele 12 luni. Dintre aceștia, 33% dintre bărbați și 20% dintre femei au manifestat agresivitate severă, suficientă pentru a provoca răni celor care îi îngrijesc (Wheeler et al., 2016). Auto-vătămarea și comportamentul impulsiv sunt, de asemenea, mai răspândite la persoanele cu FXS (Arron et al., 2011).
Comportamentele repetitive și stereotipia au fost crescute în mod constant la șoarecii Fmr1 KO2 și ameliorate de tratamentul cu gaboxadol. Comportamentele repetitive pot cauza probleme serioase pentru funcționarea zilnică și pot deveni o barieră în calea învățării și a SI (Leekam et al., 2011). Paradigmele care evaluează comportamentele stereotipice și deficitele socioemoționale ar putea fi astfel utile pentru a evalua noi medicamente pentru eficacitatea lor în ameliorarea fenotipurilor autiste în FXS.
Gaboxadolul a normalizat toate deficitele comportamentale testate ale șoarecilor Fmr1 KO2 la o doză de 0,5 mg/kg. În timp ce dozele mai mari au normalizat, de asemenea, iritabilitatea și comportamentele agresive, acest lucru nu a fost observat pentru alte domenii comportamentale evaluate. O explicație pentru fereastra de eficacitate oarecum îngustă observată aici poate proveni din lucrările anterioare care au arătat compromiterea procesării informațiilor fie prin inhibiția tonică insuficientă, fie prin exces, procesul fiziologic pe care gaboxadolul îl potențează. În cadrul acestui model, beneficiul comportamental al medicamentului la doze mari ar fi compensat de deficitele independente de FXS introduse farmacologic (Duguid et al., 2012).
Rezultatele noastre oferă dovezi solide ale potențialului beneficiu al gaboxadolului în inversarea comportamentelor legate de TSA, agresivitate și sociabilitate. Luate împreună, aceste rezultate susțin ipoteza că potențarea receptorilor GABAA extrasinaptici de către gaboxadol poate fi benefică la persoanele cu FXS. În concluzie, aceste date susțin evaluarea viitoare a gaboxadolului la persoanele cu FXS, în special în ceea ce privește simptomele de hiperactivitate, anxietate, stereotipie legată de ASD, sociabilitate, iritabilitate, agresivitate și cogniție.
Declarație etică
Toate experimentele au fost efectuate cu aprobarea Comitetului Etic al Institutului de Ecologie și Biodiversitate, Universitatea din Chile, Santiago, Chile.
Contribuții ale autorilor
BA și MD au inițiat această lucrare și au lucrat cu PC și RD pentru a dezvolta un plan experimental. PC și RD au redactat un raport tehnic care rezumă rezultatele, pe care JW-S l-a folosit pentru a produce un manuscris pregătit pentru publicare. MvS, ca și ceilalți autori, a contribuit la interpretarea rezultatelor. Toți autorii au oferit feedback asupra manuscrisului înainte de a fi trimis.
Finanțare
Acest studiu a fost sponsorizat și plătit integral de Ovid Therapeutics Inc., New York, NY, SUA.
Declarație privind conflictul de interese
PC și RD sunt fondator/CEO și CSO al Gen. DDI Limited, care a fost contractat de Ovid Therapeutics pentru a efectua activitatea experimentală descrisă aici. PC și RD sunt în prezent șef și membru al echipei FRAXA-DVI. JW-S, prin intermediul NeuroJenic Consulting, LLC, a fost contractat pentru a redacta acest manuscris în vederea publicării. MvS, BA și MD sunt angajați cu normă întreagă la Ovid Therapeutics și dețin, de asemenea, fie acțiuni, fie opțiuni pe acțiuni.
Arron, K., Oliver, C., Moss, J., Berg, K. și Burbidge, C. (2011). Prevalența și fenomenologia comportamentului auto-vătămător și agresiv în sindroamele genetice. J. Intellect. Disabil. Res. 55, 109-120. doi: 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., and Bear, M. F. (2010). Pierderea proteinei retardului mental fragil X decuplează amorsarea dependentă de receptorul metabotropic de glutamat a potențării pe termen lung de la sinteza proteinelor. J. Neurophysiol. 104, 1047-1051. doi: 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M., și Holiday, D. B. (2008). Condițiile co-ocurrente asociate cu variațiile genei FMR1: constatări dintr-un sondaj național pentru părinți. Am. J. Med. Genet. A 146A, 2060-2069. doi: 10.1002/ajmg.a.32439
PubMed Abstract | Full Cross Full Text | Google Scholar
Bassell, G. J., and Warren, S. T. (2008). Sindromul X fragil: pierderea reglării locale a ARNm modifică dezvoltarea și funcția sinaptică. Neuron 60, 201-214. doi: 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., și Hascoët, M. (2003). Testul cutiei de lumină/întuneric pentru șoareci. Eur. J. Pharmacol. 463, 55-65. doi: 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., și Zeng, Y. (2017). Implicarea receptorului AMPA în afectarea plasticității sinaptice și a dizabilității intelectuale în sindromul X fragil. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., și Dudek, B. C. (1999). Genetica comportamentului șoarecilor: interacțiuni cu mediul de laborator. Science 284, 1670-1672. doi: 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P., și Avoli, M. (2009). Downregulation of tonic GABAergic inhibition in a mouse model of fragile X syndrome. Cereb. Cortex 19, 1515-1520. doi: 10.1093/cercor/bhn159
PubMed Abstract | Full CrossRef Text | Google Scholar
Dahlhaus, R. (2018). De bărbați și șoareci: modelarea sindromului X fragil. Front. Mol. Neurosci. 11:41. doi: 10.3389/fnmol.2018.00041
PubMed Abstract | Refef Full Text | Google Scholar
Deacon, R. M. (2013). Testul de anxietate pe alei succesive de anxietate la șoareci și șobolani. J. Vis. Exp. 76:e2705. doi: 10.3791/2705
PubMed Abstract | Red Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). NNZ-2566, un nou analog al (1-3) IGF-1, ca potențial agent terapeutic pentru sindromul X fragil. Neuromolecular Med. 17, 71-82. doi: 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P., Hassan, B. A., et al. (2006). Scăderea expresiei receptorului GABAA în sindromul X fragil. Brain Res. 1121, 238-245. doi: 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). Cuantificarea prin tomografie cu emisie de pozitroni (PET) a receptorilor GABAA în creierul pacienților cu X fragil. PLoS One 10:e0131486. doi: 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., și Kooy, R. F. (2007). Receptorul GABAA: o nouă țintă pentru tratamentul sindromului X fragil? Trends Neurosci. 30, 425-431. doi: 10.1016/j.tins.2007.06.003
PubMed Abstract | Full CrossRef Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B. B., Auerbach, B. D., Chattarji, S., et al. (2007). Corectarea sindromului X fragil la șoareci. Neuron 56, 955-962. doi: 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
>Duguid, I., Branco, T., London, M., Chadderton, P. și Hausser, M. (2012). Inhibiția tonică îmbunătățește fidelitatea transmiterii informațiilor senzoriale în cortexul cerebelos. J. Neurosci. 32, 11132-11143. doi: 10.1523/jneurosci.0460-12.2012
PubMed Abstract | Refef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A., et al. (2006). Profilul de expresie sugerează o subexprimare a subunității delta a receptorului GABAA în modelul șoricelului knock-out X fragil. Neurobiol. Dis. 21, 346-357. doi: 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A., și Pietropaolo, S. (2017). Anomalii comportamentale în modelul de șoarece Fmr1-KO2 al sindromului X fragil: relevanța fazelor timpurii ale vieții. Autism Res. 10, 1584-1596. doi: 10.1002/aur.1814
PubMed Abstract |Ref Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J., și Berry-Kravis, E. M. (2015). Strategii terapeutice în sindromul X fragil: de la bancă la patul bolnavului și înapoi. Neurotherapeutics 12, 584-608. doi: 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Sindromul X fragil. Nat. Rev. Dis. Primers 3:17065. doi: 10.1038/nrdp.2017.65
PubMed Abstract | Text integral | Google Scholar
Hagerman, R., Hoem, G., și Hagerman, P. (2010). X fragil și autismul: întrepătrunse la nivel molecular care conduc la tratamente specifice. Mol. Autism 1:12. doi: 10.1186/2040-2392-1-12
PubMed Abstract | Text integral | Google Scholar
Hall, S. S., Barnett, R. P., și Hustyi, K. M. (2016). Comportamentul problematic la băieții adolescenți cu sindromul X fragil: prevalența relativă, frecvența și severitatea. J. Intellect. Disabil. Res. 60, 1189-1199. doi: 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., și Greicius, M. D. (2013). Identificarea rețelelor cerebrale la scară largă în sindromul X fragil. JAMA Psychiatry 70, 1215-1223. doi: 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T. T., Silverman, J. L., și Crawley, J. N. (2014). Modelarea sindromului X fragil în șoarecele Fmr1 knockout. Intractable Rare Dis. Res. 3, 118-133. doi: 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., și Ellegood, J. (2016). Modificări ale volumelor regionale ale creierului la șoarecii adulți masculi FMR1-KO pe tulpina FVB. Neuroscience 318, 12-21. doi: 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | Cross Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., et al. (2019). Regulatorul translațional FMRP controlează metabolismul lipidelor și al glucozei la șoareci și la oameni. Mol. Metab. 21, 22-35. doi: 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., și Uljarevic, M. (2011). Comportamente restricționate și repetitive în tulburările de spectru autist: o revizuire a cercetărilor din ultimul deceniu. Psychol. Bull. 137, 562-593. doi: 10.1037/a0023341
PubMed Abstract | Textul integral | Google Scholar
Lightbody, A. A., and Reiss, A. L. (2009). Relațiile dintre gene, creier și comportament în sindromul X fragil: dovezi din studiile de neuroimagistică. Dev. Disabil. Res. Rev. 15, 343-352. doi: 10.1002/ddrr.77
PubMed Abstract | Full Text | Google Scholar
Meera, P., Wallner, M., și Otis, T. S. (2011). Baza moleculară pentru sensibilitatea ridicată la THIP / gaboxadol a receptorilor GABAA extrasinaptici. J. Neurophysiol. 106, 2057-2064. doi: 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., et al. (2006). Generarea unui model de șoarece condițional Fmr1 knock out pentru a studia funcția Fmrp in vivo. Neurobiol. Dis. 21, 549-555. doi: 10.1016/j.nbd.2005.08.019
PubMed Abstract |Ref Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., și Burns, M. P. (2011). Agonistul THIP al receptorului GABAA ameliorează deficitele comportamentale specifice în modelul de șoarece al sindromului X fragil. Dev. Neurosci. 33, 395-403. doi: 10.1159/000332884
PubMed Abstract |Ref Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G., și Huntsman, M. M. (2010). Neurotransmisia GABAergică defectuoasă și salvarea farmacologică a hiperexcitabilității neuronale în amigdala într-un model de șoarece al sindromului X fragil. J. Neurosci. 30, 9929-9938. doi: 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K., și Bear, M. F. (2010). Hipersensibilitatea la mGluR5 și ERK1/2 duce la sinteza excesivă a proteinelor în hipocampul unui model de șoarece al sindromului X fragil. J. Neurosci. 30, 15616-15627. doi: 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
>Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R., și Crusio, W. E. (2011). Modularea genetică de fond genetic a simptomelor de bază și a simptomelor variabile de tip autist la șoarecii Fmr1 knock-out. PLoS One 6:e17073. doi: 10.1371/journal.pone.0017073
PubMed Abstract | Ref Full Text | Google Scholar
Prut, L., and Belzung, C. (2003). Câmpul deschis ca paradigmă pentru a măsura efectele medicamentelor asupra comportamentelor asemănătoare anxietății: o revizuire. Eur. J. Pharmacol. 463, 3-33. doi: 10.1016/s0014-2999(03)01272-x
PubMed Abstract | Refef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., și Cramer, K. S. S. (2015). Ștergerea lui Fmr1 modifică funcția și intrările sinaptice în trunchiul cerebral auditiv. PLoS One 10:e0117266. doi: 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., și Lindemann, L. (2015). Receptorul metabotropic glutamat 5 ca țintă a medicamentelor pentru sindromul X fragil. Curr. Opin. Pharmacol. 20, 124-134. doi: 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J., și Dow-Edwards, D. (2016). Efectele gaboxadolului asupra expresiei sensibilizării la cocaină la șobolani. Exp. Clin. Psychopharmacol. 24, 131-141. doi: 10.1037/pha0000069
PubMed Abstract | Reflect Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., S. M., Thomas, A. M., Serysheva, E., Yuva-Paylor, L. A., et al. (2011). Modificarea fenotipurilor comportamentale la șoarecii Fmr1KO: diferențele de fond genetic dezvăluie răspunsuri de tip autist. Autism Res. 4, 40-56. doi: 10.1002/aur.168
PubMed Abstract | Text integral | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. (1994). Șoareci Fmr1 knock-out: un model pentru studierea retardului mental de tip X fragil. Cell 78, 23-33. doi: 10.1016/0092-8674(94)90569-x
PubMed Abstract |Ref Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). Repurposing medicamente disponibile pentru tulburările de neurodezvoltare: experiența X fragilă. Neuropharmacology 147, 74-86. doi: 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., și Crabbe, J. C. (2006). Stabilitatea diferențelor de tulpină de șoareci consangvinizați în comportament și dimensiunea creierului între laboratoare și de-a lungul deceniilor. Proc. Natl. acad. Sci. U S A 103, 16364-16369. doi: 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. (2014). Anxietatea, problemele de atenție, hiperactivitatea și lista de verificare a comportamentului aberant în sindromul X fragil. Am. J. Med. Genet. A 164A, 141-155. doi: 10.1002/ajmg.a.36232
PubMed Abstract | Full CrossRef Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E. și Bailey, D. B. Jr. (2016). Agresivitatea în sindromul X fragil. J. Intellect. Disabil. Res. 60, 113-125. doi: 10.1111/jir.12238
PubMed Abstract | Full CrossRef Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). Scăderea expresiei de suprafață a subunității delta a receptorului GABAA contribuie la reducerea inhibiției tonice în celulele dentate granule într-un model de șoarece al sindromului X fragil. Exp. neurol. 297, 168-178. doi: 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
.