- Introducere
- Epidemiologie
- Organismul și fiziopatologia diareei cu C. difficile
- Manifestări clinice
- Diagnostic
- Ghiduri practice pentru diagnosticul sindroamelor diareice cu C. difficile
- Diagnosticul endoscopic al diareei și colitei cu C. difficile
- Tratament
- Managementul diareei recurente cu C. difficile
- Colită severă cu C. difficile
- Concluzie
Introducere
Diareea asociată cu Clostridium difficile (CDAD) a fost recunoscută cu o frecvență crescută ca fiind o cauză de boală nosocomială. Frecvența și incidența CDAD variază foarte mult și este influențată de mai mulți factori, inclusiv focarele nosocomiale, modelele de utilizare a antimicrobienelor și susceptibilitatea individuală. Nu există rapoarte de studii prospective efectuate de spitale care să urmărească toxina A sau A/B pozitivă și rezultatele CDAD și complicațiile acesteia.
Centrii pentru Controlul și Prevenirea Bolilor (Centers for Disease Control and Prevention – CDC) a analizat tendințele seculare ale incidenței CDAD și a raportat o creștere constantă din 1987 până în 2001 (1). În acest raport, 30% dintre cei 440 de medici infecționiști care au participat la un sondaj de opinie pe internet au raportat că observă rate mai mari de CDAD, CDAD mai severe și mai multe recidive de CDAD decât în trecut. Există o impresie generală că s-a înregistrat o creștere a proporției de cazuri cu complicații severe și fatale și o creștere a ratei de recidivă în rândul pacienților afectați.
În plus față de morbiditate și mortalitate, povara economică a infecției cu C. difficile în ceea ce privește externarea întârziată și alte costuri spitalicești este considerabilă.
Epidemiologie
Frecvența și incidența CDAD variază între spitale și în cadrul unei anumite instituții în timp. Riscul de îmbolnăvire crește la pacienții cu expunere la antibiotice, intervenții chirurgicale gastrointestinale, creșterea duratei de ședere în unitățile sanitare, boli subiacente grave, afecțiuni imuno-compromițătoare și vârstă înaintată.
C. difficile se elimină în fecale. Orice suprafață, dispozitiv sau material (de exemplu, comodă, cadă de baie și termometru electronic rectal) care se contaminează cu fecale poate servi drept rezervor pentru sporii de C. difficile. Sporii sunt transferați la pacienți în principal prin intermediul mâinilor personalului medical care a atins o suprafață sau un obiect contaminat (2-6).
 click pentru versiunea mare
click pentru versiunea mare
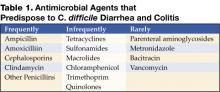
Figura 1 . Radiografia digitală de la tomografia computerizată arată îngroșarea haustală nodulară în colonul transvers.
Organismul și fiziopatologia diareei cu C. difficile
C. difficile este un bacil gram-pozitiv, anaerob, formator de spori, care este responsabil de apariția diareei și colitei asociate cu antibiotice. C. difficile a fost descris pentru prima dată în 1935 ca o componentă a florei fecale a nou-născuților sănătoși și inițial nu a fost considerat patogen (7). Bacilul a fost denumit dificil deoarece se dezvoltă lent și este dificil de cultivat. În prezent, C. difficile este responsabil pentru aproape toate cauzele de colită pseudomembranoasă și până la 20% din cazurile de diaree asociată cu antibiotice fără colită. Deși se găsește în scaunul a numai 5% din populația generală, până la 21% dintre adulți sunt colonizați cu acest organism în timpul spitalizării (2,6).
O alterare a microflorei colonice normale, de obicei cauzată de terapia cu antibiotice, este principalul factor care predispune la infecția cu C. difficile. Aproape toate antibioticele au fost asociate cu diareea și colita cu C. difficile. Printre antibioticele cel mai frecvent asociate se numără clindamicina, cefalosporinele, ampicilina și amoxicilina (tabelul 1) (8).
În plus față de terapia cu antibiotice, vârsta înaintată și severitatea bolii de bază sunt factori de risc importanți pentru infecția cu C. difficile. Alți factori de risc includ prezența unei sonde nazogastrice, procedurile gastrointestinale, medicamentele antisecreționare acide, șederea în unitatea de terapie intensivă și durata spitalizării (9).
Diareea cu C. difficile este cauzată în principal de elaborarea toxinelor A și B produse de multiplicarea bacteriană în interiorul lumenului intestinal. Aceste toxine se leagă de mucoasa colonică și își exercită efectele nocive asupra acesteia. Organismul dăunează rareori colonului prin invazie directă, iar diareea este cauzată de efectele toxinelor produse în interiorul lumenului intestinal care aderă la suprafața mucoasei. Majoritatea izolatelor toxigene produc ambele toxine, iar aproximativ 5-25% dintre izolate nu produc nici toxina A, nici toxina B și nu provoacă colită sau diaree (3-5).
Manifestări clinice
Infecția cu C. difficile poate produce o gamă largă de manifestări clinice, inclusiv portul asimptomatic, diaree ușoară până la moderată și boală fulminantă cu colită pseudomembranoasă (10). La pacienții care dezvoltă CDAD, simptomele încep de obicei la scurt timp după colonizare. Colonizarea poate apărea în timpul tratamentului cu antibiotice sau până la câteva săptămâni după o cură de antibiotice. CDAD este în mod obișnuit asociată cu trecerea unor scaune frecvente și moi, în concordanță cu proctocolita. Mucusul sau sângele ocult pot fi prezente, dar sângele vizibil este rar.
Diagnostic
Diagnosticul de CDAD se bazează pe istoricul unui tratament antibiotic recent sau actual, apariția diareei sau a altor dovezi de colită acută și demonstrarea infecției cu C. difficile toxigenic, de obicei prin detectarea toxinei A sau a toxinei B în proba de scaun.
 click pentru versiunea mare
click pentru versiunea mare
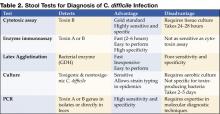
Figura 1 . Radiografia digitală de la CT arată îngroșarea nodulară a haustului în colonul transvers.
Ghiduri practice pentru diagnosticul sindroamelor diareice cu C. difficile
- Diagnosticul trebuie suspectat la orice persoană cu diaree care a primit antibiotice în ultimele 2 luni și/sau a cărei diaree începe la 72 de ore sau mai mult după spitalizare.
- Când diagnosticul este suspectat, o singură probă de scaun trebuie trimisă la laborator pentru testarea prezenței C. difficile și/sau a toxinelor sale.
- Când diareea persistă în ciuda unui rezultat negativ la toxinele din scaun, pot fi trimise una sau două probe suplimentare pentru testare cu aceleași teste sau cu teste diferite (4). Endoscopia este rezervată pentru situații speciale, cum ar fi atunci când este necesar un diagnostic rapid și rezultatele testului întârzie sau când testul nu este foarte sensibil, când pacientul are ileus și scaunul nu este disponibil sau când sunt luate în considerare și alte boli ale colonului.
Deocamdată nu există un test simplu, ieftin, rapid, sensibil și specific pentru diagnosticarea C. difficile diaree și colită, și nici toate testele disponibile nu sunt adecvate pentru a fi adoptate de fiecare laborator (tabelul 2) (11).
Diagnosticul endoscopic al diareei și colitei cu C. difficile
Sigmoidoscopia și colonoscopia nu sunt indicate pentru majoritatea pacienților cu CDAD (10,12). Endoscopia este utilă, totuși, în situații speciale, cum ar fi atunci când diagnosticul este îndoielnic sau când situația clinică impune un diagnostic rapid. Rezultatele examenului endoscopic pot fi normale la pacienții cu diaree ușoară sau pot arăta colită nespecifică în cazurile moderate. Constatarea pseudomembranelor colonice la un pacient cu diaree asociată cu antibiotice este practic patognomonică pentru colita cu C. difficile. Câțiva pacienți fără nicio caracteristică diagnostică la nivelul rectosigmoidului prezintă pseudomembrane în zonele mai proximale ale colonului (13). Alte constatări endoscopice includ eritem, edem, friabilitate și colită nespecifică cu mici ulcerații sau eroziuni.
Tratament
Primul pas în tratamentul diareei și colitei cu C. difficile este întreruperea antibioticelor precipitante, dacă este posibil (10,12). Diareea se rezolvă la aproximativ 15-25% dintre pacienți fără tratament specific anti-C. difficile (14,15). Cu toate acestea, este posibil ca managementul conservator singur să nu fie indicat în cazul pacienților care sunt bolnavi sistemic sau care au probleme medicale multiple, deoarece este dificil de prezis care pacienți se vor ameliora spontan. În cazul în care nu este posibilă întreruperea antibioticului precipitant din cauza altor infecții active, regimul antibiotic al pacientului trebuie modificat, dacă este posibil, pentru a face uz de agenți mai puțin susceptibili de a provoca CDAD (de ex, aminoglicozide, trimetoprim, rifampicină sau o chinolonă).
Agenții antiperistaltici, cum ar fi difenoxilatul plus atropina (Lomotil) sau loperamida (Imodium), și analgezicele narcotice trebuie evitate deoarece acestea pot întârzia eliminarea toxinelor din colon și, astfel, pot exacerba leziunile colonice induse de toxine sau pot precipita ileusul și dilatarea toxică (12,16). Terapia specifică pentru eradicarea C. difficile trebuie utilizată la pacienții cu simptome inițial severe și la pacienții ale căror simptome persistă în ciuda întreruperii tratamentului cu antibiotice. Deși diagnosticul de colită cu C. difficile ar trebui stabilit în mod ideal înainte de implementarea terapiei antimicrobiene, ghidurile actuale ale ACG recomandă ca terapia empirică să fie inițiată în cazurile foarte sugestive ale pacienților grav bolnavi (tabelul 3 de la pagina 54) (12).
În prezent, vancomicina orală sau metronidazolul, utilizate timp de 7 până la 10 zile, sunt considerate terapie de primă linie de către majoritatea autorilor și ghidurile actuale. Metronidazolul în doză de 250 mg de 4 ori pe zi este recomandat de majoritatea autorilor și de ghidurile ACG ca medicament de elecție pentru tratamentul inițial al colitei cu C. difficile (12). Aceste recomandări se bazează în mare parte pe eficacitate, pe costurile mai mici și pe preocupările legate de dezvoltarea tulpinilor rezistente la vancomicină. Dezavantajele majore ale metronidazolului includ un profil medicamentos mai puțin dezirabil și contraindicații la copii și la femeile gravide.
Vancomicina, pe de altă parte, în doză de 125 mg de 4 ori pe zi, este sigură și bine tolerată și atinge niveluri în scaun de 20 de ori mai mari decât concentrația minimă inhibitoare necesară pentru tratamentul C. difficile. Dezavantajele utilizării vancomicinei sunt costul și dezvoltarea potențială a tulpinilor rezistente la vancomicină. Ghidurile actuale ale ACG consideră vancomicina ca fiind medicamentul de elecție la pacienții grav bolnavi și în cazurile în care utilizarea metronidazolului este exclusă.
Nu există studii clinice controlate pentru pacienții cu colită fulminantă care ar putea să nu tolereze tratamentul oral. Administrarea metronidazolului pe cale intravenoasă sau administrarea de vancomicină prin sondă nazogastrică sau clismă rectală a fost descrisă în serii mici de cazuri (17-20). Administrarea intravenoasă a vancomicinei nu este recomandată, deoarece medicamentul nu este excretat în colon (17).
Managementul diareei recurente cu C. difficile
În ciuda tratamentului inițial de succes al DACD, 15-20% dintre pacienți prezintă recurență a diareei în asociere cu un test de scaun pozitiv pentru toxina C. difficile. Recidiva simptomatică este rareori datorată eșecului tratamentului sau rezistenței antimicrobiene la metronidazol sau vancomicină. Abordările de management includ terapia conservatoare (cu toate acestea, mulți pacienți sunt vârstnici și infirmi și nu pot tolera diareea), terapia cu antibiotice specifice anti-C. difficile, utilizarea de rășini care fixează anioni, terapia cu microorganisme (probiotice) și terapia cu imunoglobuline.
Cel mai frecvent tratament pentru diareea recurentă cu C. difficile este un al doilea tratament cu același antibiotic utilizat pentru tratarea episodului inițial (12). Într-un studiu observațional de amploare realizat în Statele Unite, 92% dintre pacienții cu DACD recurentă au răspuns cu succes la o singură cură repetată de tratament, de obicei cu metronidazol sau vancomicină (14). Există dovezi care sugerează că pacienții cu antecedente de recurență prezintă un risc ridicat de noi episoade de CDAD după întreruperea tratamentului cu antibiotice. Nu există date care să sugereze că episoadele secvențiale devin progresiv mai severe sau mai complicate (21). Au fost sugerate o varietate de programe de tratament pentru pacienții cu recurențe multiple de diaree cu C. difficile. O abordare este de a administra un tratament prelungit cu vancomicină (sau metronidazol) folosind un program de dozare descrescătoare urmat de o terapie cu pulsuri (tabelul 4).
Colestiramină, o rășină schimbătoare de anioni administrată în doză de 4 grame de 3 sau 4 ori pe zi timp de 1 până la 2 săptămâni, leagă toxinele C. difficile și poate fi utilizată împreună cu antibioticele pentru a trata recidivele repetate. Deoarece colestiramină poate lega vancomicina, precum și toxinele, aceasta trebuie administrată la cel puțin 2 până la 3 ore distanță de vancomicină.
Colită severă cu C. difficile
Incidența colitei fulminante cu C. difficile a fost raportată la 1,6-3,2% (22). Deși lipsesc cifre precise recente din alte centre, aceasta este recunoscută ca fiind o cauză din ce în ce mai mare de complicații și deces. Sindromul clinic al colitei fulminante cu C. difficile poate fi recunoscut cu o cunoaștere adecvată a spectrului de prezentare a bolii.
A. Diareea: Deși diareea este semnul distinctiv al colitei cu C. difficile, ea nu este invariabil prezentă, iar absența ei poate duce la confuzie diagnostică. Atunci când diareea este absentă, aceasta pare să fie secundară unei dismotilități colonice severe. Chiar și atunci când este prezentă, diareea poate fi percepută ca fiind o componentă minoră a unui tablou septic nespecific.
 Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
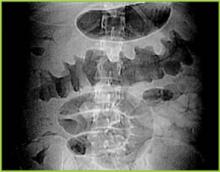
Figura 1 . Radiografia digitală de la CT arată îngroșarea nodulară a haustului în colonul transvers.
 Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
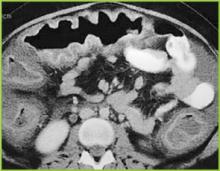
Figura 2 . Imaginea CT a abdomenului superior confirmă îngroșarea haustrală marcată în colonul transvers.
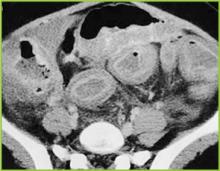 Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
Retipărită cu permisiunea BUMC Proceedings 1999; 12:249-250
Figura 3 . Imaginea CT a abdomenului mediu demonstrează îngroșarea marcată a întregului colon. Modificări inflamatorii ușoare sunt prezente în grăsimea pericolonică.
B. Boala severă: Colita fulminantă este o formă neobișnuită de infecție cu C. difficile, apărând la numai 3% dintre pacienți, dar reprezentând practic toate complicațiile grave. Pacienții cu forme mai severe ale bolii se pot prezenta cu sau fără diaree. Atunci când pacienții dezvoltă colită localizată la nivelul cecumului și al părții drepte a colonului, diareea poate fi minimă sau absentă. În absența diareei, singurele indicii de diagnostic pot fi semnele sistemice de toxicitate (febră, tahicardie, leucocitoză și/sau depleție de volum).
Un număr ridicat de celule albe din sânge poate fi un indiciu important pentru colita fulminantă iminentă cu C. difficile. Ridicarea rapidă a numărului de globule albe periferice (frecvent până la 30.000-50.000) cu un exces semnificativ de benzi și, uneori, de forme mai imature, precede adesea instabilitatea hemodinamică și dezvoltarea disfuncției de organ. Chiar și la pacienții care sunt ușor simptomatici pentru o perioadă îndelungată, poate apărea o evoluție bruscă și neașteptată spre șoc. Este dificil de prezis acei pacienți care ar putea să nu răspundă la tratamentul medical. Prin urmare, semnele de avertizare timpurie, cum ar fi o reacție leucemoidă, pot fi de neprețuit.
Hipotensiunea arterială este o constatare tardivă și poate fi rezistentă la suportul vasopresor. Semnele abdominale variază de la distensie la sensibilitate generalizată cu garda. Perforația colonică este de obicei însoțită de rigiditate abdominală, gardă involuntară, sensibilitate de revenire și absența zgomotelor intestinale. Aerul liber poate fi evidențiat pe radiografiile abdominale. Orice suspiciune de perforație în acest context trebuie să determine un consult chirurgical imediat. În general, decesul survine înainte de apariția aerului liber și a perforației. Într-un studiu, contrar majorității literaturii de specialitate, s-a constatat că perforația este rară (22).
Radiografia abdominală poate evidenția un colon dilatat (>7 cm în cel mai mare diametru), în concordanță cu un megacolon toxic. Pacienții cu megacolon pot avea asociat un ileus al intestinului subțire cu intestinul subțire dilatat pe radiografiile abdominale simple, cu niveluri de aer-fluid care mimează obstrucția intestinului subțire sau ischemia. CT fără substanță de contrast și endoscopia pot diagnostica rapid sau cel puțin pot sugera puternic colita fulminantă cu C.difficile. Constatările CT includ dovezi de ascită, îngroșarea și/sau dilatarea peretelui colonic. Aceste constatări se pot dovedi utile în clasificarea severității colitei.
Intervenția mai agresivă la pacienții care nu răspund din punct de vedere medical, inclusiv identificarea rapidă a pacienților care nu răspund la terapia medicală, este crucială pentru un rezultat pozitiv, iar intervenția chirurgicală timpurie ar trebui să se facă în acest grup (figurile 1-3).
Este important ca toți cei implicați în îngrijirea pacienților din spitale, cămine de bătrâni și centre de îngrijire calificată să fie educați cu privire la acest organism și la epidemiologia sa, la abordările raționale pentru tratamentul și îngrijirea pacienților cu C. difficile diaree, importanța spălării mâinilor între contactele cu pacienții, utilizarea mănușilor atunci când se îngrijește un pacient cu C. difficile diaree și evitarea utilizării inutile a antimicrobienelor.
Concluzie
Anii recenți au stârnit îngrijorări cu privire la creșterea incidenței și a ratelor de complicații grave ale CDAD în spitalele nord-americane (22,23). Revista Asociației Medicale Canadiene a publicat în 2004 un raport care detalia un focar de CDAD care a implicat mai multe spitale din Montreal. Introducerea unor noi tulpini hipervirulente și foarte transmisibile de C. difficile a fost postulată ca posibilă cauză a epidemiei (24). O infrastructură în deteriorare, practicile inadecvate de control al infecțiilor, numărul tot mai mare de pacienți debilitați, o populație îmbătrânită și tulpinile hipervirulente au fost considerate a fi factori care au contribuit probabil la focarele recente din Canada (25).
Două investigații epidemiologice din Statele Unite și Canada (24,26) au examinat în mod independent eșantioane de C. difficile și au constatat că o versiune mutantă a tulpinii „sălbatice” a fost responsabilă pentru focarele din Quebec și pentru ratele crescute de CDAD în spitalele din Statele Unite în ultima vreme (22,23). Epidemiologii clinici de la CDC au investigat izolatele de C. difficile din spitalele din Statele Unite cu focare recente (și anume, 2001-2004) de CDAD (22,23). Raportul indică apariția unei noi tulpini epidemice, „BI” (distinctă de tulpina „J” din 1989-1992), care poate fi responsabilă pentru creșterea recentă a ratelor și a gravității aparente a CDAD (26).
CDAD și colita în majoritatea cazurilor pot fi tratate prin administrarea de metronidazol sau vancomicină. La unii pacienți se dezvoltă o toxicitate severă care pune în pericol viața în ciuda tratamentului medical adecvat și în timp util și este necesară intervenția chirurgicală. S-a raportat că simptomele sistemice ale infecției cu C. difficile nu derivă din bacteriemie, perforație colonică sau ischemie, ci din mediatorii inflamatori induși de toxine și eliberați de colon (27-29). Intervenția chirurgicală precoce ar trebui să fie utilizată în cazurile refractare de boală severă. Cu toate acestea, intervenția chirurgicală este departe de a fi ideală și implică o rată foarte mare de complicații și un risc semnificativ de mortalitate (22). Viitoarea abordare clinică a tratamentului colitei nosocomiale cu C. difficile poate implica, în cele din urmă, hiperimunoglobuline antitoxină specifice și inhibitori ai cascadei inflamatorii (28,30,31).
- Archibald LK, Banerjee SN, Jarvis WR. Tendința seculară a bolii Clostridium difficile dobândită în spital în Statele Unite; 1987-2001. J Infect Dis. 2004;189:1585-9.
- Fekety R. Antibiotic-associated colitis. În: A: Mandell G, Bennet JE, Dolin R, eds. Principles and Practice of Infectious Diseases. Ed. a 4-a. New York: Churchill Livingston; 1996:978-806.
- Mitty RD, LaMont T. Clostridium difficile diarrhea: Patogenie, epidemiologie și tratament. Gastroenterologist. 1994;2:61-9.
- Bartlett JG. Clostridium difficile: Istoricul rolului său ca agent patogen enteric și stadiul actual al cunoștințelor despre acest organism. Clin Infect Dis. 1994;18(Suppl 4):265-72.
- Johnson S, Gerding D. Clostridium difficile. În: A: Mayhall CG, ed. Hospital Epidemiology and Infection Control. Baltimore, Md: Williams & Wilkins; 1996:99-408.
- Mcfarland LV, Mulligan ME, Kwok RY, Stamm WE. Achiziționarea nosocomială a Clostridium difficile. N Engl J Med. 1989;320:204-10.
- Hall IC, O Toole E. Intestinal Flora in new-born infants: Cu o descriere a unui nou anaerob patogen, Bacillus difficile. Am J Dis Child. 1935;49:390-402.
- Kelly CP, LaMont JT. Tratamentul diareei și colitei cu Clostridium difficile. În: A: Wolfe MM, ed. Gastrointestinal Pharmacotherapy. Philadelphia, Pa.: WB Saunders; 1993:199-212.
- Bignardi GE. Factori de risc pentru infecția cu Clostridium difficile. J Hosp Infect. 1998;40:1-15.
- Kelly CP, Pothoulakas C, LaMont JT. Colita cu Clostridium difficile. N Engl J Med. 1994;330:257-62.
- Linevsky JK, Kelly CP. Colita cu Clostridium difficile. În: C: Lamont JT, ed. Lamont JT. Infecții gastrointestinale: Diagnosis and Management. New York: Marcel Dekker; 1997:293-325.
- Fekety R. Guidelines for the diagnosis and management of Clostridium difficile associated diarrhea and colitis. Colegiul American de Gastroenetrologie, Comitetul pentru parametri de practică. Am J Gastroenterol. 1997;92:739-50.
- Tedesco FJ, Corless JK, Brownstein RE. Conservarea rectală în colita pseudomembranoasă asociată cu antibiotice: Un studiu prospectiv. Gastroenterology. 1982;83:1259-60.
- Olson MM, Shanholtzer CJ, Lee JT Jr, Gerding DN. Zece ani de supraveghere prospectivă a bolii asociate cu Clostridium difficile și tratament la Centrul Medical VA din Minneapolis, 1982-1991. Infect Control Hosp Epidemiol. 1994;15: 371-81.
- Teasley DG, Gerding DN, Olson MM, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet. 1983;2:1043-6.
- Walley T, Milson D. Megacolon toxic legat de loperamidă în colita cu Clostridium difficile. Postgrad Med J. 1990;66:582.
- Malnick SD, Zimhony O. Treatment of Clostridium difficile associated diarrhea. Ann Pharmacother. 2002;36:1767-75.
- Sehgal M, Kyne L. Clostridium difficile disease. Curr Treatment Options Infect Dis. 2002;4:201-10.
- Apisarnthanarak A, Razavi B, Mundy LM. Vancomicina intracolonică adjuvantă pentru colita severă cu Clostridium difficile: serie de cazuri și analiza literaturii. Clin Infect Dis. 2002;35:690-6.
- Friendenberg F, Fernandez A, Kaul V, Niami P, Levine GM. Metronidazol intravenos pentru tratamentul colitei cu Clostridium difficile. Dis Colon Rectum. 2001;44:1176-80.
- Fekety R, McFarland LV, Surawicz CMGreenberg, RN, Elmer GW, Mulligan ME. Diareea recurentă cu Clostridium difficile: caracteristici și factori de risc pentru pacienții înscriși într-un studiu prospectiv, randomizat, dublu-orb. Clin Infect Dis. 1997;24:324-33.
- Dallal RM, Harbrecht BG, Boujoukas AJ, et al. Clostridium difficile fulminant: o cauză subapreciată și în creștere de deces și complicații. Ann Surg. 2002;235:363-72.
- Morris AM, Jobe BA, Sontey, M, Sheppard BC, Deveney CW, Deveney KE. Colita cu Clostridium difficile: o boală iatrogenă din ce în ce mai agresivă? Arch Surg. 2002;137:1096-100.
- Eggerston L, Sibbald B. Hospitals battling outbreaks of C. difficile. CMAJ. 2004;171:19-21.
- Valiquette L, Low DE, Pepin J, McGeer A. Clostridium difficile infection in hospitals: a brewing storm. CMAJ. 2004;171:27-9.
- McDonald LC, Killgore GE, Thompson A, et al. Emergența unei tulpini epidemice de Clostridium difficile în Statele Unite, 2001-4: Rolul potențial al factorilor de virulență și al trăsăturilor de rezistență antimicrobiană. A 42-a reuniune anuală a Societății de Boli Infecțioase a Americii. Boston, MA, 30 septembrie – 3 octombrie 2004. Rezumat # LB-2.
- Flegel W, Muller F, Daubener W, Fischer HG, Hadding U, Northoff H. Răspunsul citokinelor de către monocitele umane la toxina A și toxina B a Clostridium difficile. Infect Immun. 1991;59:3659-66.
- Castagliuolo I, Keates A, Qiu B, et al. Răspunsuri crescute la substanța P în ganglionii rădăcinii dorsale, macrofage intestinale în timpul enteritei cu toxina A a Clostridium difficile la șobolani. Proc Natl Acad Sci U S A. 1997;94:4788-93.
- Castagliuolo I, Keates A, Wang C, et al. Clostridium difficile toxin A stimulează producția de proteină inflamatorie macrofagică-2 în celulele epiteliale intestinale de șobolan. J Immunol. 1998;160:6039-45.
- Kelly C, Chetham S, Keates S, et al. Supraviețuirea concentratului de imunoglobulină bovină anti-Clostridium difficile în tractul gastrointestinal uman. Antimicrob Agents Chemother. 1997;41:236-41.
- Salcedo J, Keates S, Pothoulakis C, et. al. Terapia cu imunoglobulină intravenoasă pentru colita severă cu Clostridium difficile. Gut. 1997;41:366-70.