- Abstract
- Cuvintele cheie
- Introducere
- Metode timpurii de producere a pigmentului
- Metoda acidului sulfuric
- Metoda de clorinare
- Separarea fierului
- Procesul cu cuptor electric
- Ruta hidrometalurgică
- Metoda de înaltă presiune
- Proces atmosferic
- Oxihidroliza
- Oxihidroliza în pat fluidizat
- Oxihidroliza prin pulverizare
- Producția titanului
Abstract
Ilmenitul de calitate inferioară poate fi lichefiat cu HCl concentrat la presiune atmosferică și la 80oC. După filtrare pentru a separa materia insolubilă, soluția care conține TiO2+ și Fe2+ este încălzită pentru a precipita hidroxidul de titan și a recupera HCl. Hidroxidul de titan este apoi calcinat pentru a obține rutil sintetic care conține 95+% TiO2, în timp ce FeCl2 este supus oxihidrolizei sau fluidizat pentru a recupera HCl și Fe2O3. Procesul poate fi aplicat, în mod natural, la ilmenitul de înaltă calitate. El ocolește procedeul cuptorului electric, care se aplică numai la ilmenitul de înaltă calitate și este superior procedeului cu acid sulfuric, care este foarte poluant. Produsul acestui procedeu poate fi utilizat pentru prepararea pigmentului alb, precum și a titanului metalic.
Cuvintele cheie
Lixiviere HCl, Procedeu Magpei, Rutil sintetic, Oxihidroliză, Cuptor electric, Clorinare, Procedeu cu acid sulfuric
Introducere
Principalele minerale de titan sunt rutilul, TiO2 și ilmenitul, FeTiO3 (figurile 1 și 2). Rutilul este ușor de prelucrat pentru obținerea titanului metalic sau a pigmentului TiO2 prin metoda de clorinare, în timp ce ilmenitul este mai complicat din cauza conținutului său ridicat de fier. Deoarece rezervele mondiale de titan sunt în proporție de 90 % sub formă de ilmenit și doar 10 % sub formă de rutil, tratarea ilmenitului este în mod evident o chestiune importantă în metalurgie .

Figura 1: Mostră de muzeu de rutil, ~ 90 % TiO2

Figura 2: Mostră de muzeu de ilmenit, FeTiO3 (59.4 % TiO2)
Depozitele de ilmenit pot fi masive ca în provincia Quebec (figura 3) sau sub formă de nisipuri negre (figura 4) asociate cu magnetită, monazit și alte minerale valoroase care sunt separate prin metode fizice (figura 5). În prima separare magnetică se folosește un magnet slab pentru a separa magnetita, în timp ce în a doua separare magnetică se folosește un magnet de mare intensitate pentru a separa ilmenitul.

Figura 3: O mostră de ilmenit masiv din Quebec

Figura 4: Nisipuri negre de plajă ca în India
Metode timpurii de producere a pigmentului
Metoda acidului sulfuric
În 1916, Titanium Pigment Corporation din Niagara Falls, New York și Titan Company din Norvegia au început simultan producția comercială a acestui nou pigment alb. Atunci, principalii pigmenți albi utilizați în vopsele erau plumbul alb, albul de zinc și litopona. În această metodă, ilmenitul a fost tratat cu H2SO4 concentrat la 110-120°C pentru a forma sulfați de fier și de titanil:
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
Reacția se desfășoară în rezervoare mari de beton căptușite cu cărămidă rezistentă la acizi (figura 6), încălzite prin injecție directă de abur de înaltă presiune sau într-o moară de tip pug (figura 7) . Masa solidificată produsă în reactor la sfârșitul reacției a fost apoi evacuată din reactor prin dizolvare în apă sau acid diluat. După îndepărtarea reziduului insolubil prin filtrare, soluția care conține 120-130 g/L TiO2 și 250-300 g/L FeSO4 a fost concentrată în vid la 10°C pentru a cristaliza FeSO4-7H2O, care a fost apoi centrifugată. Oxidul de titan este apoi precipitat din soluție prin diluție și însămânțare, ceea ce duce la formarea de H2SO4 diluat pentru eliminare (figurile 8 și 9). Cu toate acestea, cel mai mare producător de pigmenți din Salvador, Brazilia, încă mai folosește această tehnologie, deoarece elimină produsele reziduale în ocean, care sunt îndepărtate de maree.

Figura 5: Prelucrarea nisipurilor negre pentru recuperarea componentelor sale valoroase

Figura 6: Rezervoare mari de beton căptușite cu cărămidă rezistentă la acizi
Figura 7: Moara cu plug încălzită

Figura 8: Producerea pigmentului TiO2 prin procedeul cu acid sulfuric

Figura 9: Alb de titan, ~ 100% TiO2
Metoda de clorinare
DuPont din SUA produce pigmentul din 1950 prin clorinarea directă a minereului de ilmenit, separarea produselor prin distilare fracționată, apoi oxidarea TiCl4 (figura 10):

Figura 10: Procedeu simplificat Du Pont de obținere a pigmenților din ilmenit
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Problema acestui procedeu este recuperarea clorului din clorura ferică sau comercializarea cantităților mari ale acestui coprodus.
Separarea fierului
Din cauza problemelor de poluare asociate cu eliminarea acidului sulfuric diluat și a FeSO4, fierul din minereu este separat într-un stadiu incipient. Acest lucru se realizează în două moduri: prin cuptor electric și prin căi hidrometalurgice.
Procesul cu cuptor electric
Metoda cu cuptor electric a fost dezvoltată în anii 1950 . Minereul a fost amestecat cu o anumită cantitate de antracit, suficientă pentru a reduce componenta de oxid de fier din minereu, apoi a fost încărcat într-un cuptor electric la 1 650°C, unde oxidul de fier este redus în metal, în timp ce titanul este separat sub formă de zgură (figura 11). Reacțiile care au loc în timpul reducerii sunt următoarele:

Figura 11: Procesul de separare a fierului în cuptorul electric
FeTiO3 + C → Fe + CO + TiO2(zgură)
Fe2O3 + 3C → 2Fe + 3CO
Această metodă este utilizată de Rio Tinto QIT la uzina sa din Sorel, lângă Montreal, și la Richards Bay, în Africa de Sud. Este, de asemenea, utilizată în Uniunea Sovietică la Zaporozhye (Ucraina) și în Japonia.
Scoria de titan este în principal titanat de fier și magneziu, (Fe,Mg)Ti4O10, și o cantitate mică de silicați; analizele tipice sunt de 72-85% TiO2 total. O cantitate mică de TiO2 este redusă la Ti2O3. Reducerea oxizilor de fier nu este dusă până la capăt, astfel încât o parte din oxidul de fier este lăsată în zgură pentru a scădea punctul de topire al acesteia. Punctul de topire al TiO2 1840°C și al ilmenitului 1435°C.
Scoria este bogată în titan și săracă în fier (figura 12) și, prin urmare, este preferabilă ilmenitului la fabricarea pigmentului TiO2 sau a titanului metalic. Cu toate acestea, zgura produsă în Quebec nu este potrivită pentru clorinare din cauza nivelului său ridicat de impurități – aproximativ 16,6%, față de aproximativ 6% în cazul altor zguri . Aceste impurități nu numai că vor consuma cantități inutile de clor, dar vor crea, de asemenea, o problemă de eliminare. În plus, unele dintre aceste impurități, de ex, calciul și magneziul vor interfera cu procesul de clorinare propriu-zis, care se desfășoară la 800°C, formând o fază topită (CaCl2 p.m. 770°C, MgCl2 p.m. 708°C).

Figura 12: Zgură de titan măcinată, FeTi4O10 (70-80 % TiO2)
Din aceste motive, zgura de titan a fost folosită numai pentru fabricarea pigmentului prin procedeul cu acid sulfuric . Scoria a fost tratată în același mod ca și ilmenitul, cu excepția faptului că nu a fost necesară separarea sulfatului feros, deoarece cea mai mare parte a fierului a fost deja separată prin reducere în etapa anterioară (figura 13). Cu toate acestea, procesul de tratare a zgurii cu acid sulfuric suferea încă de problema eliminării acidului rezidual și, prin urmare, a fost abandonat în anii 1980 și înlocuit cu o nouă tehnologie bazată pe îmbunătățirea zgurii până la 94,5% TiO2 prin leșierea majorității impurităților cu HCl sub presiune pentru a o face adecvată pentru clorinare.

Figura 13: Lixivierea zgurii de titan pentru producerea pigmentului TiO2, acum învechită
Ruta hidrometalurgică
Ruta hidrometalurgică a fost dezvoltată în anii 1960 și a presupus leșierea fierului din ilmenit și obținerea unui reziduu bogat în titan (90-95% TiO2) cunoscut sub numele de „rutil sintetic” . Într-un caz, procedeul Altair, s-a obținut un TiO2 de calitate pentru pigmenți. Toate aceste procese utilizează un proces de oxihidroliză pentru tratarea clorurii feroase pentru a obține HCl pentru reciclare și Fe2O3 ca produs secundar.
Metoda de înaltă presiune
În această metodă, ilmenitul de înaltă calitate este descompus în autoclave cu 20% HCl la 120°C și 200 kPa; fierul este solubilizat sub formă de clorură feroasă, lăsând un solid care conține aproximativ 95% TiO2, care are analiza chimică a rutilului, motiv pentru care este numit rutil sintetic (figura 14):

Figura 14: Rutil sintetic
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
Ilmenitul de calitate inferioară nu poate fi tratat prin această metodă deoarece toți silicații și materiile insolubile vor contamina produsul. Rutilul sintetic este apoi tratat cu clor pentru a prepara TiCl4, din care se obține TiO2 sau titan metal fără probleme de poluare. Acest procedeu este utilizat în SUA, Anglia, Japonia, Taiwan și Australia. Oxihidroliza ar putea fi realizată într-o varietate de moduri, așa cum este descris mai jos.
Proces atmosferic
În 2014 s-a constatat de către Magpie Incorporation din Canada că ilmenitul de calitate inferioară poate fi dizolvat la 80°C cu HCl concentrat la presiune atmosferică. După filtrare pentru a elimina materia insolubilă, soluția este distilată pentru a recupera HCl și pentru a hidroliza ionul titanil în TiO2. După filtrare, reziduul este calcinat pentru a produce rutil sintetic (figura 16):

Figura 15: Producerea rutilului sintetic din ilmenit

Figura 16: Producerea rutilului sintetic din ilmenit

Figura 16: Producerea rutilului sintetic din ilmenit: Producerea a 98+% TiO2 dintr-un ilmenit de calitate inferioară
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Este evident că noua tehnologie de lichefiere la presiune ambiantă este superioară vechii tehnologii de topire în cuptorul electric și de modernizare în autoclav.
Oxihidroliza
Soluția de clorură feroasă este regenerată în HCl și Fe2O3 prin oxihidroliză:
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
Este aceeași tehnologie care este folosită pentru tratarea soluției de murături. Se folosesc două metode
Oxihidroliza în pat fluidizat
Într-un reactor cu pat fluidizat, soluția de clorură feroasă este introdusă pe un pat mare de oxid de fier fierbinte, unde încălzirea este asigurată de gazele fierbinți de combustie de fluidizare (figura 17). Pe măsură ce gazele de combustie curg prin patul de oxid bine agitat, acestea ating rapid echilibrul termic cu patul. Soluția este introdusă deasupra patului de oxizi. Alimentele lichide umezesc stratul exterior al particulelor de oxid fierbinți și se evaporă rapid pentru a forma un strat ca o ceapă de oxid solid nou deasupra oxidului existent, producând astfel particule dense și omogene.

Figura 17: Reactor cu pat fluidizat pentru oxihidroliza clorurii feroase
Oxihidroliza prin pulverizare
În acest tip de prăjitor de oxihidroliză, soluția de clorură feroasă este pulverizată într-un vas cilindric gol, în timp ce energia necesară este furnizată de fluxul ascendent de gaze fierbinți generate în arzătoarele inferioare (figura 18). Cuptoarele de prăjire prin pulverizare au diametre mari pentru a menține vitezele reduse ale gazelor. În cazul în care viteza gazelor este mare, prea multe particule sunt eluzionate cu gazele reziduale, iar calitatea produsului și eficiența prăjitorului scad. Gazele reziduale și oxizii părăsesc prăjitorul în contracurent la o temperatură cuprinsă între 400°C și 500°C. Timpul de ședere al particulelor pulverizate în zona de reacție la temperaturi înalte este foarte scurt; prin urmare, trebuie create prin atomizare picături de lichid foarte mici, care pot fi încălzite rapid. Încălzirea rapidă are ca rezultat formarea unei cruste de oxid solid pe suprafața fiecărei picături. Pe măsură ce cea mai mare parte a picăturii se încălzește, conținutul de apă se vaporizează și străpunge crusta de oxid. Prin urmare, oxidul prăjit prin pulverizare este compus din sfere foarte fine, „pufoase” și goale.

Figura 18: Regenerarea HCl din soluția de clorură feroasă prin oxihidroliză în prăjitorul prin pulverizare
Producția titanului
Tianitiul metalic este produs prin clorurarea rutilului, rutilului sintetic sau a zgurii de titan, apoi reducerea într-un reactor metalotermic a TiCl4 de către magneziu la titan (figurile 19 și 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
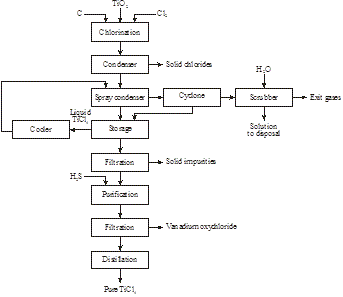
Figura 19: Producerea de TiCl4 din rutil, rutil sintetic sau zgură de titan

Figura 20: Producerea de TiCl4 din rutil, rutil sintetic sau zgură de titan

Figura 20: Producerea de TiCl4 din rutil, rutil sintetic sau zgură de titan: Producerea titanului din TiCl4
TiCl4 + Mg → Ti + MgCl2
Clorura de magneziu este apoi electrolizată pentru a obține înapoi magneziul și clorul pentru reciclare. Figura 21 prezintă reactorul metalotermic scos din cuptor după reducere, din care se recuperează buretele de titan (figura 22).

Figura 21: Reactorul metalotermic fiind scos din cuptor

Figura 22: Buretele de titan (sus) și MgCl2 (jos) scos din reactor
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) „Titanium”, pp. 1129-1179 în Handbook of Extractive Metallurgy editat de F. Habashi, publicat de WILEY-VCH, Weinheim, Germania.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec City, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15: 65-81
- Habashi F (1996) Pollution Problems in the Mineral and Metallurgical Industries, Metallurgie Extractive Quebec, Quebec City.
- Habashi F (1993) Pressure Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec City, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Retipărit în Metall 69: 27-30
- Habashi F (1993) Two Hundred Years Titanium. Prelucrarea minereurilor de titan pentru producția de pigmenți și metale. Arab Min J 11: 74-84
.