Mecanismele explică regioselectivitatea
X2/H2O sau X2/ROH: Regioselectivitatea formării halohidrinelor din reacția unei alchene cu un halogen într-un solvent nucleofil este analogă cu calea de oximercurare-demercurare. Molecula de halogen are rolul de electrofil care acceptă electronii pi nucleofili de la alchenă, formând în același timp o legătură cu celălalt carbon de vinil pentru a crea un ion bromoniu (sau cloroiu). Formarea ionului de bromoniu (sau cloroniu) stabilizează sarcina pozitivă și împiedică rearanjarea carbocationului. Solventul preia rolul de nucleofil deoarece este prezent într-un procent mult mai mare decât grupul de plecare și reacționează cu carbonul cel mai substituit al ionului de bromoniu (sau cloroniu) ciclic pentru a crea regiochimia. Stereochimia acestei reacții este de anti-adăziune, deoarece solventul se apropie de ionul de bromoniu cu orientare dorsală pentru a produce produsul de adiție. Cu toate acestea, deoarece interacțiunea halogenului cu alchena poate avea loc de sus sau de jos, nu există un control stereochimic în această reacție și, dacă este cazul, se va produce un amestec de enantiomeri. Etapa finală a acestui mecanism este un transfer de protoni către o moleculă de apă din solvent pentru a neutraliza produsul de adiție.
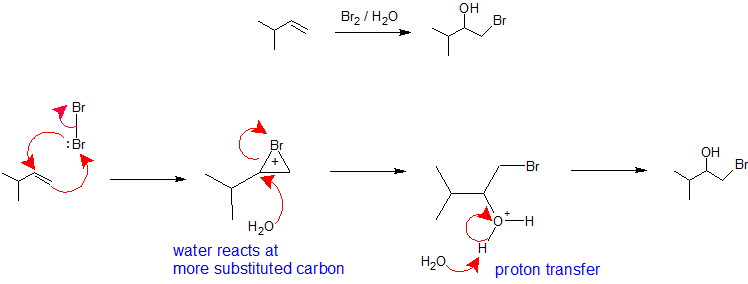
HOX sau RSCl: Regio-selectivitatea reacțiilor cu acizi hipohalogenați și clorură de sulfenil poate fi explicată prin același mecanism pe care l-am folosit pentru a raționaliza regula lui Markovnikov. Legătura dintre o specie electrofilă și dubla legătură a unei alchene se formează preferențial pentru a produce carbocationul mai stabil (mai puternic substituit). Acest intermediar ar trebui apoi să se combine rapid cu o specie nucleofilă pentru a produce produsul de adiție.
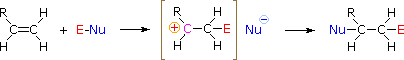
Pentru a aplica acest mecanism trebuie să determinăm fracțiunea electrofilă din fiecare dintre reactivi. Utilizând diferențele de electronegativitate, putem diseca reactivii de adiție obișnuiți în fracțiuni electrofile și nucleofile, așa cum se arată în dreapta. În cazul acizilor hipocloros și hipobromos (HOX), acești acizi Brønsted slabi (pKa de aproximativ 8) nu reacționează ca donatori de protoni; și deoarece oxigenul este mai electronegativ decât clorul sau bromul, electrofilul va fi un cation halogenat. Specia nucleofilă care se leagă de carbocationul intermediar este atunci ionul hidroxid sau, mai probabil, apa (solventul obișnuit pentru acești reactivi), iar produsele se numesc halohidrine. Clorurile de sulfenil se adiționează în mod opus, deoarece electrofilul este un cation de sulf, RS(+), în timp ce fracțiunea nucleofilă este anionul clorură (clorul este mai electronegativ decât sulful).
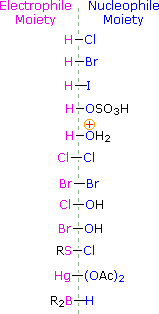
Mai jos sunt prezentate câteva exemple care ilustrează adiția diferiților reactivi electrofili halogenați la grupările alchene. Observați regiochimia specifică a produșilor, așa cum s-a explicat mai sus.
Exercițiu
1. Precizați produsul următoarei reacții:

2. Când butena este tratată cu NBS în prezența apei, produsul arată că bromul se află pe carbonul cel mai puțin substituit, este acesta Markovnikov sau anti-Markovnikov?
Răspuns

2. Deoarece bromul este prima adiție la alchenă, această adiție ar fi o adiție anti-Markovnikov.
Colaboratori
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Profesor Emerit (Michigan State U.), Virtual Textbook of Organic Chemistry
.