O XeF4 ou Tetrafluoreto de Xénon é um composto químico feito de átomos de Xénon e Fluoreto. É o primeiro composto binário do mundo a ser descoberto. É um tipo de gás nobre com a equação química de
Xe +2 F2 -> XeF4
O XeF4 tem uma aparência branca sólida e tem uma densidade de 4,040 g cm-3 numa forma sólida. Em condições normais, aparece como um cristalino incolor. Tem uma temperatura sublime de 115,7 graus Celsius ou 240,26 graus Fahrenheit. Tal como os outros fluoreto de xenônio, o tetrafluoreto de xenônio tem uma formação exergônica. À temperatura e pressão normais, permanece em condições estáveis. Ele reage com água instantaneamente e libera oxigênio molecular, fluoreto de hidrogênio e gás xênon puro.
| Nome da molécula | Tetrafluoreto de xénon (XeF4) |
| Nº de Valência Electrões na molécula | 36 |
| Hibridação de XeF4 | hibridação de sp3d2 |
| Ângulos de ligação | 90 graus e 180 graus |
| Geometria molecular do XeF4 | Plano quadrado |
Para saber mais sobre as suas propriedades físicas e propriedades químicas, é preciso conhecer a sua estrutura Lewis e a sua geometria molecular. Vamos descobrir a estrutura de Lewis do tetrafluoreto de Xenónio.
Para fazer a estrutura de Lewis, precisamos de conhecer os electrões de valência de XeF4 para fazer a sua estrutura e saber a colocação dos átomos na molécula.
Conteúdo
XeF4 Electrões de valência
Nesta molécula, temos um átomo de Xenon e quatro átomos de Flúor. Vamos calcular os elétrons de valência de ambos os átomos para determinar o número total de elétrons de valência de XeF4.
Elétrons de valência de Xenônio = 8
Elétrons de valência de Flúor = 7*4 ( como há quatro átomos de Flúor, multiplicaremos por 4)
Número total de elétrons de valência de Xef4: 8 + 7*4
: 8 + 28
: 36
Haia há um total de 36 elétrons de valência em XeF4.
Estrutura de Lewis XeF4
Agora conhecemos os electrões de valência do Tetrafluoreto de Xénon, será mais fácil para si desenhar a sua estrutura de Lewis. Esta estrutura de pontos de Lewis é uma representação pictórica dos elétrons de valência em torno de átomos individuais em uma molécula junto com a ligação que ela forma.
As ligações na estrutura são mostradas usando linhas, enquanto os elétrons que não participam na formação da ligação são mostrados como pontos. Os elétrons que não formam nenhuma ligação são chamados de elétrons sem ligação ou pares solitários de elétrons.
Aqui como Xénon é o átomo menos electronegativo, vamos colocá-lo no centro e todos os outros átomos de flúor à sua volta assim:

Aqui que colocámos todos os átomos vamos mostrar ligações entre cada átomo de Flúor e Xénon. Cada ligação na molécula ocupa dois elétrons, e como existem quatro ligações individuais nesta molécula, 8 dos 36 elétrons são utilizados.
Inicie colocando o resto dos elétrons de valência ao redor dos átomos. Cada átomo de flúor terá seis elétrons de valência em torno dele, pois um elétron foi usado para fazer a ligação.
Vocês podem notar que já colocamos 24 dos 28 elétrons ao redor dos átomos do flúor. Os demais elétrons sem ligação ou pares solitários de elétrons serão colocados em Xenon, pois é uma exceção à regra do octeto.
Põe estes dois pares de electrões sem ligação em Xénon, e agora tens uma estrutura Lewis onde há dois pares solitários de electrões em Xénon e seis electrões sem ligação em cada átomo do Fluorine.
Hibridação XeF4
Os orbitais do átomo central do Xénon são hibridizados, o que resulta na formação de novos orbitais hibridizados. Xenónio tem seis electrões nas suas orbitais de 5p e dois electrões nas orbitais de 5s. Não há elétrons em d-orbitais e f-orbitais no estado de terra de Xenon. Mas quando este átomo está em estado excitado, dois elétrons em p-orbitais se movem para d-orbitais; como resultado, há quatro elétrons não pareados no total. Destes, dois estão em p-orbitais, e os outros dois elétrons não pareados estão em d-orbitais. Estes orbitais hibridizados levam à hibridização sp3d2 em XeF4.
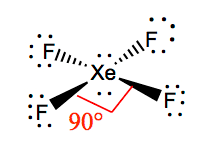
Geometria Molecular XeF4
É mais fácil compreender a geometria molecular de uma dada molécula uma vez que conhecemos a sua estrutura Lewis. Como Xenon tem dois pares solitários de elétrons, ele vai assumir uma estrutura que ajuda esses pares solitários a evitar as forças de repulsão. Para manter estas repulsões no mínimo, os pares solitários estarão em um plano perpendicular. E como há quatro átomos de flúor, a molécula terá um arranjo tal que sua geometria molecular é plana quadrada. XeF4 tem uma geometria eletrônica de octaédrico, fazendo a geometria molecular do Tetrafluoreto de Xenônio em plano quadrado.

Ângulos de ligação de XeF4
Os ângulos de ligação de F-Xe-F são de 90 graus, e os pares solitários têm ângulos de 180 graus. Os átomos do flúor estão localizados a 90 graus um do outro, resultando na distribuição simétrica dos elétrons no plano da molécula. Estes ângulos de ligação contribuem para a formação da geometria molecular planar quadrada.
Polaridade XeF4 – O XeF4 é Polar ou Não-Polar?
Embora as ligações entre o XeF4 e os átomos do flúor sejam polares, o XeF4 é uma molécula não-polar. Como é que se pergunta? Todas as ligações Xe-F estão em oposição umas com as outras, fazendo com que a soma do momento dipolo seja zero. Como existem quatro electrões no átomo de Xenon, que estão localizados como pares de electrões sem ligação. Como a disposição geral dos átomos e elétrons na molécula é tal que a soma vetorial dos dipolos é zero, XeF4 é uma molécula não-polar.
Comentários Finais
Xenon Tetrafluoreto é uma daquelas moléculas que é relativamente fácil de compreender. A sua estrutura Lewis é uma das estruturas menos complicadas, uma vez que todos os átomos do flúor estão dispostos no padrão simétrico. Os pares solitários na molécula estão localizados num plano perpendicular em forma octaédrica para manter as suas forças repulsivas no mínimo.
Para resumir este post no blog, podemos dizer que o XeF4 tem 36 valências de electrões. Tem dois pares solitários de elétrons sem ligação no átomo central de Xenon. A molécula tem geometria de elétrons octaédricos e geometria molecular planar quadrada. XeF4 é uma molécula não-polar e tem hibridação sp3d2.