Immunofluorescence (IF) é uma abordagem morfológica comum utilizada para determinar a distribuição dos componentes subcelulares. Os anticorpos que conjugados com corantes fluorescentes são necessários no ensaio de FI. O anticorpo reconhece especificamente o antígeno ligando-se ao epitópo do alvo, e o fluoróforo será detectado sob um microscópio fluorescente. Assim, os componentes subcelulares podem ser visualizados em um fundo escuro. IF também pode ser usado como um método alternativo de análise semiquantitativa para monitorar a expressão do interesse.
Existem três tipos de IF: IF direto, IF indireto e IF combinado IF.
IF direto está usando um único anticorpo primário que é conjugado com um corante fluorescente.
>
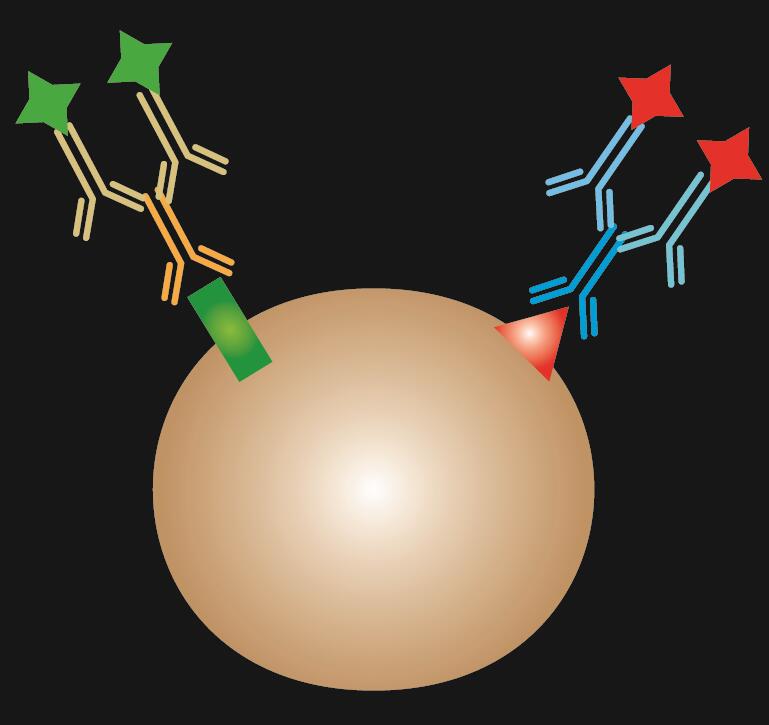
I indireto está usando dois anticorpos para a coloração: anticorpo primário que se liga especificamente ao epitopo e um anticorpo secundário conjugado com corante fluorescente.
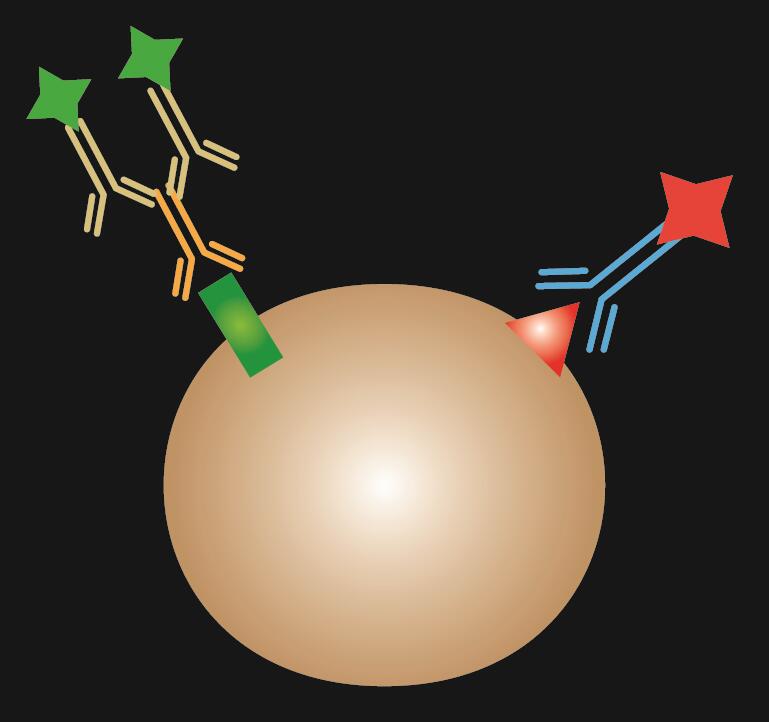
I combinado é uma combinação de IF direta e indireta.
>
Tábua 1. Comparação de IF directo, indirecto e combinado.
| Tipo IF | Directo | Indirecto | Combinado |
|---|---|---|---|
| Digrama esquemático | 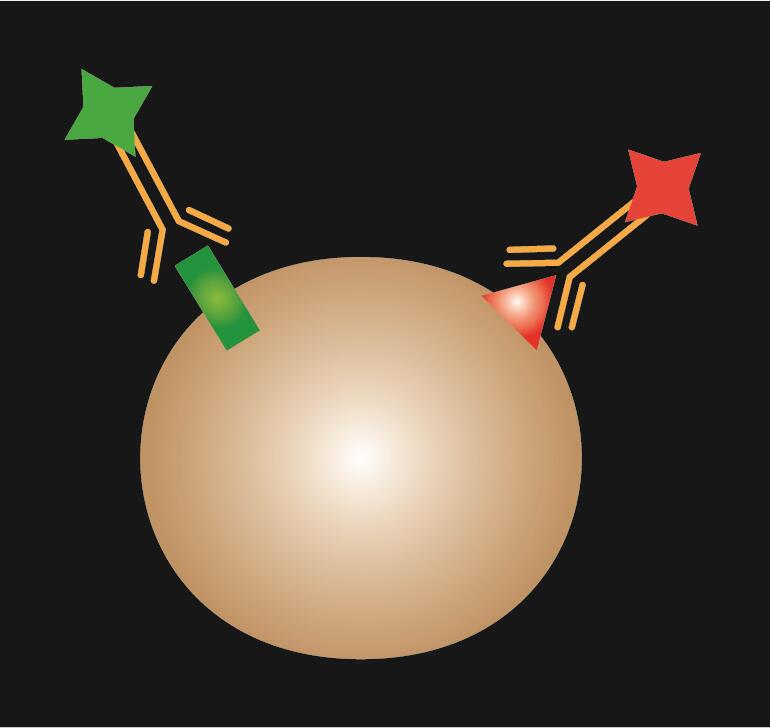 |
 |
 |
| Vantagens |
|
> |
> |
| Desvantagens |
> > |
>
> > |
|
Dentre os três tipos de IF, O método indirecto IF é o mais popular.
IF pode ser usado em secções de tecidos, linhas de células cultivadas e células individuais. O processo do IF é similar ao da imunohistoquímica (IHC).
- Recolha e fixação de amostras
As amostras devem ser fixadas rapidamente após a remoção do tecido, e é melhor realizar a pré-fixação através da infusão do coração com formaldeído a 4% ou paraformaldeído em pequenos animais como roedores. Recomenda-se que os tecidos não sejam mais espessos que 10 mm e que o volume do fixador seja pelo menos 15-20 vezes maior do que o volume do tecido. A fixação é muito importante para manter a morfologia e estrutura da célula, assim como a integridade do antígeno. Assim, soluções de fixação devem ser cuidadosamente escolhidas de acordo com diferentes antígenos e amostras de tecido.
Tabela 2. Estratégia de fixação para antígenos parciais.
| Antigénio | Solução de fixação | Condição de fixação |
|---|---|---|
| Principal proteína | 95~100% álcool 4% paraformaldeído |
3~10 min em 37℃ 4~24 hr em 4℃ |
| Enzima | Acetona | 15 min em RT |
| Hormônio | 95% álcool mais 1~5% ácido acético glacial | 30 min em 4℃ |
| Immune globulin | 95% álcool Carbono tetracloreto |
10 min em 37℃ e depois 15 min em 4℃ |
| Proteína fibrosa | 95% álcool mais 1~5% ácido acético glacial | 10 min em 37℃ depois 15 min em 4℃ |
| Vírus | Acetona Tetracloreto de carbono Álcool |
5~10 min em RT depois 30~60 min em 4℃ |
| Polissacarídeo e bactérias | Acetona 10% formaldeído Metanol |
3~10 min em RT depois 30~60 min em 4℃ |
| Lipoid | 10% formaldeído | 3~10 min em RT |
| Célula cultivada | Aquecimento 4% paraformaldeído | 15~20 min em RT |
- Desidratação e incorporação
Desidratação é necessária na preparação de cortes de tecido pelas seguintes razões:
1. Secções de parafina: A parafina é imiscível com água.
2. Secção congelada: Os cristais de gelo congelados destruiriam a morfologia das células.
A desidratação é sempre realizada submergindo o tecido numa solução de etanol ou de sacarose séria de gradiente crescente.
>
Subsequentemente, as amostras de tecido podem ser incorporadas adicionando cera de parafina fundida para cortes de parafina, enquanto o composto OCT é adicionado para cortes congelados. Esta etapa fornece dureza adequada para amostras de tecidos moles e permite que o tecido seja cortado facilmente.
- Seções e colorações
Os tecidos embebidos podem ser seccionados em fatias finas com micrótomo ou micrótomo gelado. A espessura das fatias deve ser decidida de acordo com o diâmetro celular e a finalidade do ensaio IF. As fatias mais finas (≤10 μm) são sugeridas para montar diretamente nas lâminas adesivas antes da coloração, já que são fáceis de serem empilhadas nas múltiplas etapas de lavagem. Fatias mais espessas (10~30 μm) conseguirão melhores imagens usando o método de flutuação livre, pois o anticorpo primário poderia penetrar através dos dois lados da fatia. E as secções livres flutuantes são montadas nas lâminas após a coloração. Secções flutuantes livres de pequenos tecidos, como a raiz de gânglios dorsais de rato (DRG) são difíceis de realizar e fáceis de perder a amostra. Assim, o método de secção em pau é recomendado em algumas pequenas amostras de tecido. As etapas de coloração devem ser realizadas no escuro quando um anticorpo conjugado com um corante fluorescente está envolvido.
>
Alcance aos protocolos IF:
- Secção do bastão
- Secção livre flutuante
- Células cultivadas
- Imaging and analysis
A sinalização positiva é virtualizada sob um microscópio fluorescente em fundo escuro. A localização de interesse é normalmente determinada pela co-análise de uma proteína da qual a localização tenha sido conhecida. Alternativamente, a quantidade de células positivas ou a intensidade de fluorescência da sinalização positiva pode ser medida para análise quantitativa. Por exemplo, a intensidade de fluorescência mais forte refere-se a uma expressão relativamente elevada da proteína alvo.
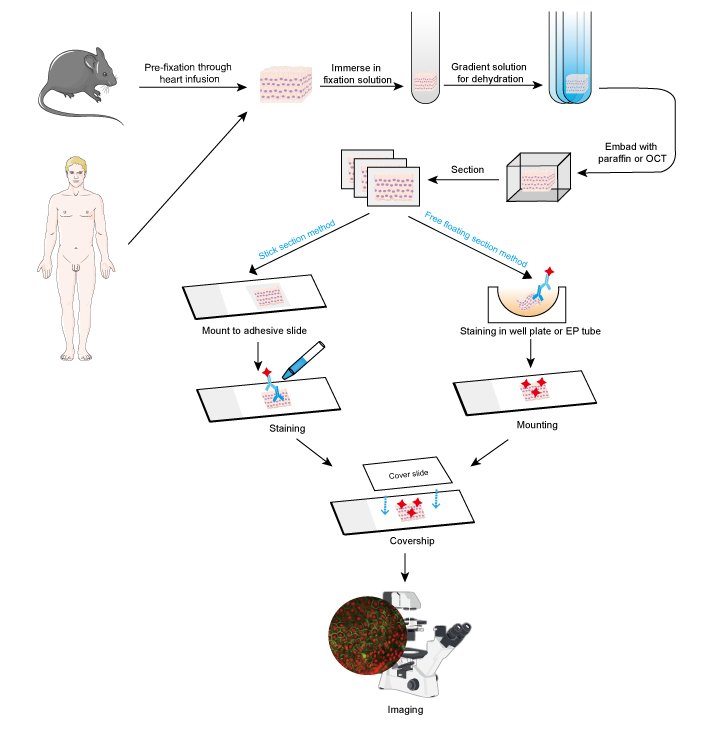
Figure 1. Fluxo de trabalho de IF em cortes de tecido.
IF e IHC ambos são abordagens poderosas para análise morfológica com importantes aplicações diagnósticas e prognósticas. Várias diferenças devem estar preocupadas em sua pesquisa:
Tabela 3. Comparação entre IHC e IF
| IHC | IF | |
|---|---|---|
| Método de rotulagem | Cromogénico | Fluorescente |
| Passo de processamento | Mais como substrato necessário | Menos |
| Image |
|
> |
| Microscópio | Microscópio luminoso | Microscópio fluorescente |
| Estabilidade | Estável para anos | Sem estabilidade por causa do fotobleaching |
| Exemplo (mouse hippocampus) |
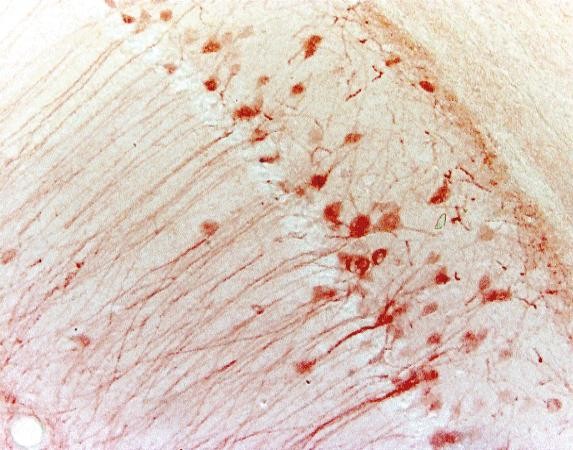 |
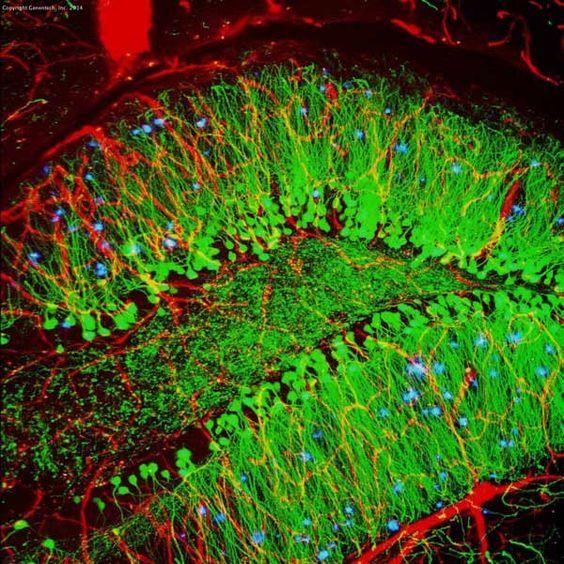 |