Patiente com lesão subepitelial gástrica
Martín Gómez Zuleta, MD (1)
(1) Unidade de Gastroenterologia, Departamento de Medicina Interna, Universidade Nacional da Colômbia. Hospital Tunal. Bogotá, Colômbia…
Recebido: 05-10-10 Aceito: 25-11-10
Abstract
As lesões subepiteliais, apesar de raramente serem encontradas no trato gastrointestinal superior, podem causar incerteza na abordagem diagnóstica e no manejo. Os achados endossonográficos são descritos e as recomendações atuais são revistas à luz de um caso, a fim de permitir uma abordagem racional dessas lesões.
Palavras-chave
Tumores submucosos, ultra-som endoscópico, GIST.
Caso clínico
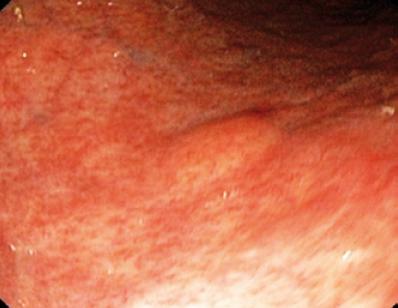
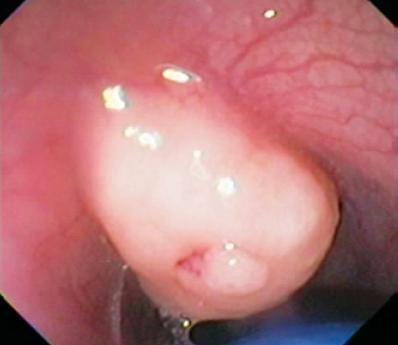
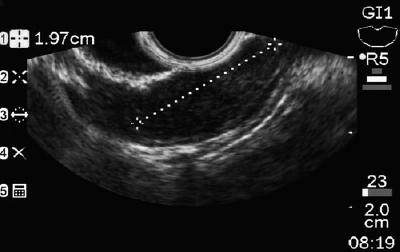
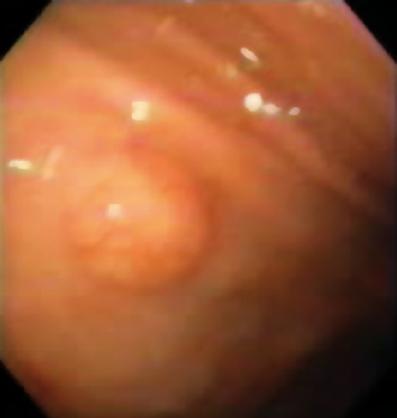
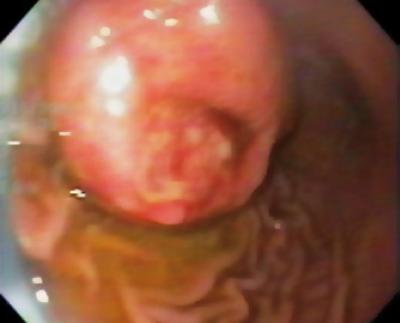
Um homem de 50 anos com dispepsia foi enviado para uma endoscopia superior, que encontrou uma lesão subepitelial de 9 mm no corpus gástrico (Figura 1). A biópsia da mucosa sobrejacente era normal. O paciente não tinha história médica prévia e seu exame físico era normal.
Figure 1. Lesão subepitelial gástrica.
Acesso inicial: O que poderíamos fazer então?
Uma massa ou protrusão na luz de um órgão coberto por epitélio normal é chamada de lesão subepitelial. São lesões pouco comuns que se espera que estejam presentes em 1 de 300 endoscopias (1, 2). As causas podem ser lesões benignas ou malignas intrínsecas da parede do tracto gastrointestinal ou compressão extrínseca causada por estruturas adjacentes normais ou patológicas (3).
Estas lesões são normalmente encontradas incidentalmente e frequentemente não têm relação com sintomas, como foi o caso do nosso paciente. Isto pode levar o médico a duvidar se ela ou ele deve acompanhar com investigações mais específicas e realizar investigações adicionais (4). Em nossa opinião, todas estas lesões devem ser avaliadas para esclarecer sua origem. Devemos sempre fazer uma biópsia da mucosa sobreposta (a menos que suspeitemos de origem vascular ou cística), pois muitas destas lesões podem ter origem na lâmina própria ou na mucosa muscular. Nestes casos, elas podem ser alcançadas através de fórceps e um diagnóstico preciso pode ser feito. Se as biópsias forem normais, é aqui que devemos definir se devemos parar ou continuar o estudo.
Após a endoscopia ter sido realizada e uma lesão subepitelial ter sido detectada, podemos imediatamente avaliá-la. Inicialmente devemos descrever o seu tamanho, forma, cor e mobilidade, e se é pulsante ou não. Finalmente podemos avaliar a sua consistência com uma pinça de biopsia fechada, permitindo-nos detectar se é cística, sólida ou mole, depressiva e em forma de almofada (uma lesão que está a recuperar lentamente). As lesões em forma de almofada com halos amarelos são altamente sugestivas de lipomas. Se a lesão é uma ligeira irregularidade da mucosa e tem uma depressão central, é sugestivo de um pâncreas ectópico. Normalmente os quistos ou varizes têm uma mucosa lisa e simétrica. Os GISTs (tumores do estroma gastrointestinal) podem ser ligeiramente ulcerados, mas são firmes e móveis (9). Também é útil mudar a posição do paciente para descartar a possibilidade de uma lesão extrínseca, cuja aparência endoscópica mudará se o paciente mudar de posição, inalar, ou se o estômago do paciente estiver cheio de ar (10-12).
Qual é o Diagnóstico Diferencial?
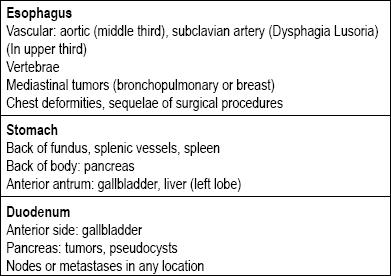
Existem muitos tipos de lesões no trato gastrointestinal que podem ser categorizadas como subepiteliais. Suas causas geralmente dependem se a lesão está localizada no esôfago, estômago, duodeno ou reto. O próximo ponto a considerar é se é realmente uma lesão da parede, ou se é uma compressão extrínseca, pois existem estruturas ao redor de todo o trato gastrointestinal que podem levar à compressão (Tabela 1) (5-8).
Tabela 1. Causas primárias das compressões extraluminais do trato digestivo superior.
Todas as lesões devem ser avaliadas com ultra-som endoscópico (EUS)?
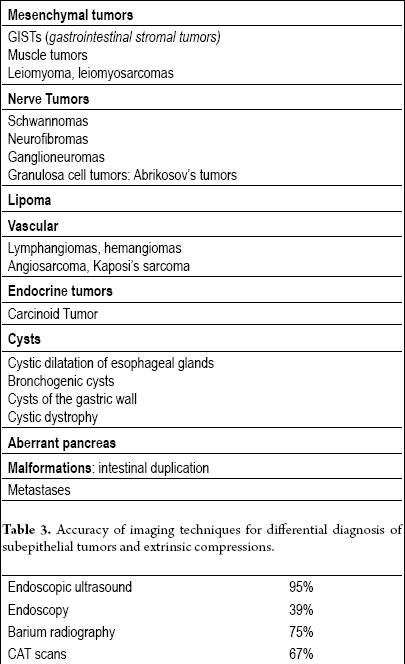
Atualmente, todas as lesões subepiteliais (Tabela 2) devem ser avaliadas com técnicas de imagem adicionais, mas se a lesão tiver menos de um centímetro de diâmetro (especialmente se for amarela), uma avaliação não é necessária porque há uma alta probabilidade de ser um lipoma.
Tabela 2. Tumores subepiteliais do trato gastrointestinal.
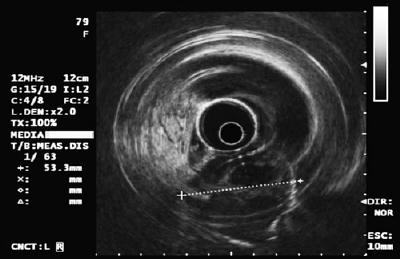
O ultra-som endoluminal ou endoscópico (EUS) é a técnica de escolha (13, 14). A exatidão do EUS para diferenciação da compressão extraluminal de um tumor subepitelial é superior a 95%. Isto é muito melhor que outras técnicas de imagem como a ultra-sonografia convencional ou TAC (15-17) (Tabela 3).
Tabela 3. Precisão das técnicas de imagem para diagnóstico diferencial de tumores subepiteliais e compressões extrínsecas.
Após termos determinado que a lesão é intrínseca à parede e não é uma compressão extrínseca, devemos avaliar a que camada da parede corresponde. Normalmente, a parede do estômago é dividida em mucosa, submucosa, muscularis propria e serosa. A camada mucosa é dividida em epitélio, membrana do porão, lâmina propria e mucosa muscular. Com o EUS e com o equipamento de rádio a parede pode ser dividida em 5 camadas (18):
A primeira camada hiperecóica corresponde à parte mais superficial da mucosa gástrica.
A segunda camada hipoecóica corresponde à parte mais profunda da mucosa que pode ser correlacionada com a mucosa muscular.
A terceira camada hiperecoica corresponde à camada submucosa.
A quarta camada hipoecoica corresponde ao próprio músculo.
A quinta camada hiperecoica corresponde à serosa ou adventícia.
Normalmente não existem lesões nas camadas um e cinco (19), por isso estão limitadas a três camadas. Normalmente são hipoecóicas, anecóicas ou hiperecóicas.
Diagnóstico com Ultrasom Endoscópico
Descreveremos cada apresentação de acordo com sua camada.
Echo camada dois
Corresponde à parte mais profunda da mucosa ou à lâmina propria e à mucosa muscularis. As lesões que surgem nesta camada são raras e geralmente hipoecóicas.
Lesões hispoecóicas: A maioria dos tumores que surgem nesta camada são musculares, geralmente leiomiomas. Eles podem ter calcificações e os grandes podem ser heterogêneos e apresentar nódulos, ao contrário das lesões pequenas, que são homogêneas. (20).
Nesta camada, encontramos também tumores de Abrikosovs ou células granulares. São geralmente pequenos e, ao contrário do leiomioma, deformam a esfera do endoscópio devido à sua dureza (Figuras 2 e 3). Os carcinoides também podem ter origem nesta camada, geralmente no fundo ou no reto (Figura 4).
Figure 2. Lesão subepitelial de cor amarela no esôfago distal.
Figure 3. O SUE mostra uma lesão isoecóica na terceira camada de eco que deforma a bola, sugerindo um tumor de 2 cm de células granulares
Figure 4. Lesão subepitelial com padrão reticular no centro, sugerindo tumor neuroendócrino.
Lesões anecóicas: Normalmente podemos ver que os quistos de inclusão ou retenção podem ter origem nesta camada.
Terceira camada Echo
É uma banda de tecido que parece hiper-ecóica na EUS. Vários tumores podem ter origem nesta camada.
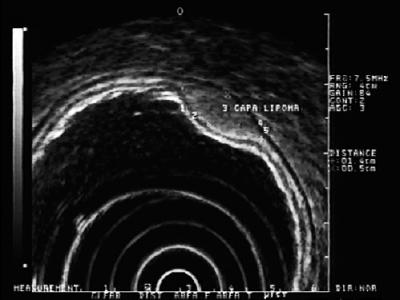
Lesões hiperecóicas: As lesões mais frequentemente encontradas nesta camada são os lipomas. Eles são caracterizados como lesões hiperecoicas homogêneas. Normalmente, são em forma de travesseiro quando empurradas com pinça endoscópica (Figura 5) (9).
Figure 5. EUS: lesão hiperecóica na camada submucosa 3 compatível com lipoma.
Neurofibromas tendem a ser hiperecóicos. São originários da propria submucosa ou muscularis.
Lesões hipoecóicas nesta camada podem corresponder a pancreata ectópica ou aberrante. Estas lesões são geralmente heterogêneas e ocasionalmente estruturas ductais anecóicas que podem corresponder a condutas podem ser vistas no centro. Em uma endoscopia é observada uma lesão com centro deprimido (21).
Lesões hipoecóicas também podem corresponder a tumores carcinoides. Embora não sejam tumores subepiteliais por serem neuroendócrinos e não mesenquimais, podem estar localizados na parede digestiva e dar origem ao mesmo tipo de nódulos. Normalmente são pequenos (menos de um cm), hipoecóicos (mas mais ecogénicos que musculares) e fixam-se na mucosa. O estudo histológico é geralmente possível a partir de uma biópsia (22, 23).
Linfomas gástricos também podem estar presentes como lesões hipoecóicas ou hiperecóicas da submucosa (24).
As lesões anecóicas observadas nesta camada são provavelmente estruturas vasculares ou cistos (25).
Camada Echo quatro
Corresponde à camada muscular. Portanto, a maioria dos tumores desta camada são de origem muscular.
As lesões hiperecóicas são muito raras, mas podem estar ligadas a linfomas, tumores neurogênicos ou metástases (26).
Lesões hipoecóicas: A maioria dos tumores desta camada são hipoecóicos, principalmente tumores estromais (GIST), quando estão situados no estômago. No entanto, se eles estão localizados no esôfago, geralmente são chamados leiomiomas. Outras lesões que podem ter este aspecto são metástases originárias dos pulmões ou mamas e tumor glomoso (27). Linfomas também podem comprometer esta camada, mas geralmente são acompanhados pelo comprometimento das camadas superiores.
GIST (tumor estromal gastrointestinal) é o nome da lesão sobre a qual nosso conhecimento tem melhorado muito nos últimos anos (28-30). Estes tumores parecem ter origem em células totipotenciais que são também os pontos de origem das chamadas células intersticiais do Cajal. Eles podem ser diferenciados em grupos: predominantemente musculares, predominantemente neurais, ou uma combinação dos dois. O diagnóstico é feito pela identificação imunohistoquímica da proteína CD-117 (também conhecida como proteína c-kit) que é um receptor de membrana com atividade de tirosina quinase (31).
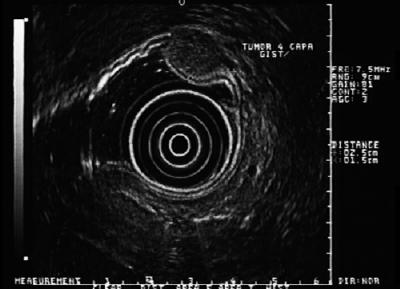
A importância destas lesões é que 30% podem ter comportamento maligno e dar origem a metástases. Somente nos Estados Unidos, 5.000 a 6.000 casos são relatados a cada ano (32). Sua distribuição no trato gastrointestinal é: estômago (40-70%), intestino delgado (20-40%), cólon e reto (5-15%) e esôfago (<5%) (33). Isto significa que se temos uma lesão hipoecóica de quarta camada no esôfago, provavelmente é um leiomioma, mas se estiver no estômago, geralmente é um GIST (Figura 6, 7 y 8). A maioria dos pacientes está na sua quinta ou sexta década de vida. Normalmente eles têm uma lesão localizada na quarta camada ou musculatura propria, embora também possa estar localizada na mucosa muscularis (34). A maioria dos pacientes é assintomática até que o tumor se torne suficientemente grande para ulcerar, sangrar ou metástase.
Figure 6. A EUS mostra lesão hipoecóica da quarta camada compatível com GIST.
Figure 7. Lesão ulcerada sugestiva de GIST.
Figure 8. A EUS da Figura 7 mostra lesão hipoecóica da quarta camada de eco altamente sugestiva de um GIST, mais de 5cm.
Por este motivo, se identificarmos um GIST maior que 3 cm é uma indicação para cirurgia mesmo que seja assintomático (outros autores sugerem um limite de 4 cm). (35). No entanto, lesões inferiores a 3 cm representam desafios para o manejo, pois a maioria é benigna. No entanto, deve-se esclarecer que todos os GISTs são potencialmente malignos, e pequenos GISTs que foram metástaseados foram relatados, especialmente no trato gastrointestinal inferior. Atualmente não somos capazes de prever com ultra-som endoscópico o potencial maligno de um GIST. No entanto, sabemos que lesões maiores que 4 cm, com bordas irregulares e/ou espaços císticos dentro delas, ou com focos ecogênicos têm alta probabilidade de serem malignas (36).
Por outro lado, a aspiração endoscópica de agulha fina guiada por ultra-som (EUS-FNA) pode não só diagnosticar GIST identificando CD-117, mas também a presença da proteína Ki-67 que indica proliferação e sugere comportamento maligno (37). É muito importante enfatizar que as lesões de GIST são muito perigosas. Devemos acompanhá-las continuamente, avaliando o tamanho do tumor e a taxa de proliferação de acordo com os riscos estabelecidos. Mesmo após a ressecção completa, estas lesões podem se repetir, especialmente no local de origem, mas também no peritônio ou fígado. 40% a 90% das lesões recidivam, apesar da ressecção completa. 50% das recidivas envolvem o fígado. Os GISTs têm 4 vezes maior risco de recidiva quando o local primário é o intestino do que quando está no estômago (38).
Qual a precisão da ultra-sonografia endoscópica?
Estudos múltiplos têm mostrado que a EUS é muito precisa para determinar se uma lesão está ou não na parede, e para estabelecer de qual camada de parede a lesão é. Isto permite-nos escolher a melhor abordagem diagnóstica. Um estudo determinou que a camada de origem em 48 de 50 pacientes (96%) com confirmação cirúrgica (39). A concordância interobservador é muito boa, especialmente na identificação de lesões como leiomiomas e lesões vasculares. É importante notar que o aspecto ultrassonográfico das lesões não nos permite determinar suas causas com 100% de certeza. Um estudo de Karaca et al. (40) de 22 pacientes submetidos à EUS seguida de mucosectomia mostrou que a precisão da EUS foi de apenas 45%. Entretanto, as lesões eram, em sua maioria, menores que 20mm, e a precisão do ultra-som aumentou para 66% para diferenciar tumores malignos de benignos. Como os critérios ultrassonográficos podem ser imprecisos, parece razoável que tentemos, se possível, obter um diagnóstico específico. Isto pode ser conseguido com EUS-FNA ou ressecção da mucosa da lesão, como demonstrado neste trabalho. Mekky et al. estudaram 141 pacientes submetidos ao exame cirúrgico de EUS-FNA. Eles encontraram uma precisão de 95,6% para os resultados finais (41).
Monitoramento, biópsia de punção ou ressecção?
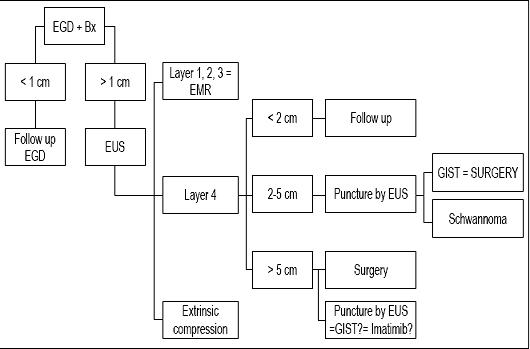
A decisão de monitorar, usar ou realizar uma ressecção depende de vários fatores, incluindo o tamanho da lesão, sua aparência endoscópica, a camada de origem e suas características ecogênicas. Se enfrentarmos uma lesão subepitelial de menos de 1 cm, não se justifica a realização de mais exames, mas uma endoscopia de seguimento deve ser realizada. Se a lesão for superior a 1 cm, a EUS é obrigatória. Se a lesão for pequena e depender da primeira, segunda ou terceira camada de eco, pode ser realizada a ressecção diagnóstica da mucosa, que também é terapêutica. No entanto, se a lesão estiver na quarta camada e for inferior a 2cm, recomenda-se a monitorização apenas com endoscopia. Se mede entre 2cm e 5cm, a EUS-FNA é ideal. Se for estabelecido que se trata de uma lesão benigna, um exame de seguimento pode ser realizado após 6 meses. Se não tiver crescido, não é necessário mais nenhum acompanhamento. Se for maligna, tiver potencial maligno ou for maior que 5 cm, recomenda-se o tratamento (42).
Em conclusão, como nosso paciente tinha uma lesão menor que 1 cm, acreditamos que sua lesão merecia apenas endoscopia de seguimento (ver algoritmo, Figura 9). Um novo exame de seguimento foi proposto em um ano. Se a lesão não tiver crescido, serão programados acompanhamentos adicionais a cada 2 ou 3 anos, mas se ela crescer proporemos EUS-FNA e um estudo imunohistoquímico.
Figure 9. Algoritmo de tratamento em lesões subepiteliais. EGD: endoscopia superior. Bx: Biópsia. EUS: ultra-som endoscópico. EMR: ressecção endoscópica da mucosa.
1. Polkowski M, Butruk E. Lesões submucosas. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Abordagem endoscópica de tumores estromais gastrointestinais. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS em tumores submucosais. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Ultra-som endoscópico e aspiração endoscópica com agulha fina para o diagnóstico de tumores submucosos malignos. Endoscopia 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterologia 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Características endossonográficas do pâncreas ectópico gástrico distinguíveis de tumores mesenquimais. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. Características endossonográficas de tumores de células esofágicas granulares. Endoscopia 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Papel do ultra-som endoscópico no tratamento de tumores submucosos no esôfago e estômago. Acta Endoscopic 1996; 26: 307-12.
10. Ponder TB. Collins BT. Biópsia por aspiração com agulha fina de cistos de duplicação gástrica com orientação endoscópica ultra-sonográfica. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Ressecção endoscópica da mucosa para neoplasias gástricas. Técnicas em Endoscopia Gastrointestinal 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Ressecção endoscópica da mucosa. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ultra-sonografia endoscópica em tumores do estroma gastrointestinal (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27.
15. Yamada Y, Kida M, Sakaguchi. Estudo dos tumores miogênicos do trato gastrointestinal superior por ultra-sonografia endoscópica com especial referência ao diagnóstico diferencial de lesões benignas e malignas. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Avaliação de lesões do trato gastrointestinal superior submucoso por ultrassonografia endoscópica. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Ultra-sonografia endoscópica no diagnóstico de tumor submucoso gástrico. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. Correlatos histológicos de imagens ultrassonográficas gastrointestinais. Gastroenterologia 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultra-sonografia endoscópica para a avaliação de tumores musculares lisos no trato gastrointestinal superior: uma experiência com 42 casos. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Ultrassonografia endoscópica. Endoscopia 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gastrointestinal imaging: endoscopic ultra-sound. Gastroenterologia 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Rendimento da amostragem de tecido para lesões submucosas avaliadas pela EUS. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Ultra-sonografia endoscópica para o estadiamento inicial e acompanhamento em pacientes com linfoma gástrico de baixo grau de tecido linfóide associado à mucosa tratados clinicamente. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Diagnóstico de cistos de duplicação de foregut através de ultra-sonografia endoscópica. Gastroenterologia 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferenciação endosonográfica de tumores benignos e malignos de células do estroma. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Características endossonográficas preditivas de tumores benignos e malignos de células estromocelulares gastrointestinais. Intestino 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. Patologia e critérios diagnósticos dos tumores gastrointestinais-estromais (GIST): Uma revisão. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Eficácia e segurança do mesilato de imatinib em tumores estromais gastrintestinais avançados. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. Tumores do estroma gastrintestinal e outras lesões mesenquimais do intestino. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumores estromais gastrintestinais: De uma abordagem cirúrgica para uma abordagem molecular. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Manejo de tumores malignos do estroma gastrintestinal. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. Tumores do estroma gastrointestinal. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Medição das lesões por endoscopia: uma visão geral. Endoscopia 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. Apresentação clínica dos tumores do estroma gastrointestinal e tratamento da doença operável. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. Estudo dos tumores miogênicos do trato gastrointestinal superior por ultra-sonografia endoscópica com especial referência ao diagnóstico diferencial de lesões benignas e malignas. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. Avaliação prognóstica do tumor estromal gastrointestinal. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumores estromais gástricos. Estudo clinicopatológico de 77 casos com correlação de características com comportamentos clínicos não agressivos e não agressivos. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. tumores submucososais e dobras gástricas espessas. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Precisão de EUS na avaliação de pequenas lesões subepiteliais gástricas. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilidade diagnóstica do FNA guiado por EUS em pacientes com tumores subepiteliais gástricos. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Lesões submucosas. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS em tumores submucososais. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8. 5. Hwang JH, Rulyak SD, Kimmey MB. American gastroenterological association institute technical review on the management of gastric subepithelial masses. Gastroenterologia 2006; 130: 2217-28. 6. Rosch T, Kapfer B, Will U, et al. Accuracy of endoscopic ultrasonography in upper gastrointestinal submucosal lesions: a prospective multicenter study. Scand J Gastroenterol 2002; 37: 856-62. 9. Souquet JC, Bobichon R. Papel do ultra-som endoscópico no tratamento de tumores submucosos no esôfago e estômago. Acta Endoscopic 1996; 26: 307-12. 10. Ponder TB. Collins BT. Biópsia por aspiração com agulha fina de cistos de duplicação gástrica com orientação endoscópica ultra-sonográfica. Acta cytol 2003; 47: 571-4. 11. Farell J, Brugge W. Ressecção endoscópica da mucosa para neoplasias gástricas. Técnicas em Endoscopia Gastrointestinal 2002; 4:34-39. 12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Ressecção endoscópica da mucosa. Gastrointest Endosc 2003; 57: 567-79. 13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Ultra-sonografia endoscópica em tumores do estroma gastrointestinal (GIST). Gastrointest Endosc 1999; 49: AB209. 14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. p. 21-27. 15. Yamada Y, Kida M, Sakaguchi. Estudo dos tumores miogênicos do trato gastrointestinal superior por ultra-sonografia endoscópica com especial referência ao diagnóstico diferencial de lesões benignas e malignas. Dig Endosc 1992; 4: 396-408. 16. Boyce GA, Sivak Jr. MV, Rosch T, et al. Avaliação das lesões do tracto gastrointestinal superior submucoso por ultra-sonografia endoscópica. Gastrointest Endosc 1991; 37: 449-54. 17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6. 18. Caletti G, Zani L, Bolondi L, et al. Ultra-sonografia endoscópica no diagnóstico de tumor submucoso gástrico. Gastrointest Endosc 1989; 35: 413-8. 19. Kimmey MB, Martin RW, Haggitt RC, et al. Correlatos histológicos de imagens ultrassonográficas gastrointestinais. Gastroenterologia 1989; 96: 433-41. 20. Chak A, Isenberg G, Kobayashi K, et al. Prospective evaluation of an over-the-wire catheter US probe. Gastrointest Endosc 2000; 51: 202-5. 21. Tio TL, Tytgat GN, den Hartog Jager FC. Ultra-sonografia endoscópica para avaliação de tumores musculares lisos no trato gastrointestinal superior: uma experiência com 42 casos. Gastrointest Endosc1990; 36: 342-50. 22. Fusaroli P, Caletti G. Ultrassonografia endoscópica. Endoscopia 2003; 35: 127-35 23. Byrne MF, Jowell PS. Gastrointestinal imaging: endoscopic ultra-sound. Gastroenterologia 2002; 122: 1631-48. 24. Hunt GC, Smith PP, Faigel DO. Rendimento da amostragem de tecido para lesões submucosas avaliadas pela EUS. Gastrointest Endosc 2004; 56: 202-5. 25. Levy M, Hammel P, Lamarque D, et al. Ultra-sonografia endoscópica para o estadiamento inicial e acompanhamento em pacientes com linfoma gástrico de baixo grau de tecido linfóide mucosoassociado tratado clinicamente. Gastrointest Endosc 1997; 46: 328-33. 26. Geller A, Wang KK, DiMagno EP. Diagnóstico de cistos de duplicação de foregut através de ultra-sonografia endoscópica. Gastroenterologia 1995; 109: 838-84. 27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. Diferenciação endosonográfica de tumores benignos e malignos de células do estroma. Gastrointest Endosc 1997; 45: 468473. 28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Características endossonográficas preditivas de tumores benignos e malignos de células estromocelulares gastrointestinais. Estômago 2000; 46: 88-102. 29. Miettinen M, Majidi M, Lasota J. Patologia e critérios diagnósticos dos tumores gastrointestinais-estromais (GIST): Uma revisão. Eur J Cancer 2002; 38(suppl 5): S39-S51. 30. Demetri GD, von Mehren M, Blanke CD, et al. Eficácia e segurança do mesilato de imatinib em tumores estromais gastrintestinais avançados. N Engl J Med 2002; 347: 472-480. 31, Greenson JK. Tumores do estroma gastrintestinal e outras lesões mesenquimais do intestino. Mod Pathol 2003; 16: 366-375. 32. Rossi CR, Mocelin S, Mencarelli R, et al. Tumores estromais gastrintestinais: De uma abordagem cirúrgica para uma abordagem molecular. Int J Cancer 2003; 107: 171176. 33. Joensuu H, Fletcher C, Dimitrijevic S, et al. Manejo de tumores malignos do estroma gastrintestinal. Lancet Oncol 2002; 3: 655-664. 34. Davila RE, Faigel DO. Tumores do estroma gastrointestinal. Gastrointest Endosc 2003; 58: 80-88. 35. Vakil N. Medição das lesões por endoscopia: uma visão geral. Endoscopia 1995; 27: 694-697. 36. Roberts PJ, Eisenberg B. Apresentação clínica dos tumores do estroma gastrointestinal e tratamento da doença operável. Eur J Cancer 2002; 38(suppl 5): S37-S38. 37. Yamada Y, Kida M, Sakaguchi. Estudo dos tumores miogênicos do trato gastrointestinal superior por ultra-sonografia endoscópica com especial referência ao diagnóstico diferencial de lesões benignas e malignas. Dig Endosc 1992; 4: 396-408. 38. Yan H, Marchettini P, Acherman YI, et al. Avaliação prognóstica do tumor estromal gastrointestinal. Am J Clin Oncol 2003, 26: 221-228. 39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Tumores estromais gástricos. Estudo clinicopatológico de 77 casos com correlação de características com comportamentos clínicos não agressivos e não agressivos. Am J Surg Pathol 2002; 26: 705-714. 40. Mallery S. tumores submucososais e dobras gástricas espessas. ASGE- 2002. p. 77-81. 41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Precisão de EUS na avaliação de pequenas lesões subepiteliais gástricas. Gastrointest Endosc 2010; 71: 722-7. 42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Utilidade diagnóstica do FNA guiado por EUS em pacientes com tumores subepiteliais gástricos. Gastrointest Endosc 2010; 71: 913-9.