- 1 Introdução
- 2 Destaques Estruturais
- 3 Função
- 4 Relevância para a saúde humana & Doença
- 5 Ligações externas
Introdução
Lipase gástrica humana (HGL, E.C. 3.1.1.3) (PBD ID: 1hlg) é a lipase que é responsável por iniciar a digestão das gorduras dietéticas no estômago . Esta enzima ácido-estável é secretada pelas células principais do estômago humano e catalisa 10-20% dos processos lipolíticos totais (ou seja, aqueles que envolvem a quebra de gordura) em adultos saudáveis . HGL catalisa especificamente a hidrólise do triacilglicerol para produzir diacilglicerol e um subproduto do carboxilato , um processo que facilita a subsequente decomposição da gordura por lipase pancreática . Em termos de implicações da doença, há evidências que sugerem que a secreção HGL está alterada em indivíduos com gastrite (a condição gástrica mais comum, na qual o revestimento estomacal está inflamado). Além disso, indivíduos com função pancreática comprometida (e, portanto, níveis reduzidos de lipase pancreática) devem depender muito da HGL para digerir gorduras dietéticas .
Destaques estruturais
HGL, uma enzima hidrolase que consiste em duas subunidades de 379 aminoácidos com resíduo longo, possui uma que contém resíduos Ser-153, His-353, e Asp-324. Esta estrutura é essencial para a quebra dos lípidos, coordenada com uma em Leu-67 e Gln-154 , que serve para estabilizar o estado de transição. Estruturalmente, a lipase gástrica humana apresenta um complexo (folhas beta mostradas em amarelo, hélices alfa mostradas em laranja, bobinas enroladas mostradas em verde, e carboidratos resolvidos mostrados como púrpura). O de HGL em resíduos 215-244 dá lugar às (regiões hidrofóbicas notadas em vermelho) tanto ao redor do local ativo como em interface com a tampa. Estas áreas são pensadas para extrair lípidos e promover o acoplamento .
Função
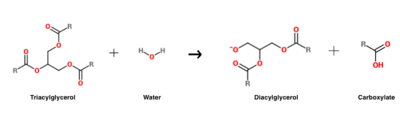
A reacção de hidrólise do triacilglicerol que é catalisado pelo HGL .
>
HGL funciona a um pH óptimo de aproximadamente cinco, e catalisa principalmente a hidrólise de triacilgliceróis de cadeia curta .
Como uma esterase com uma serina catalítica activa, HGL apresenta um mecanismo semelhante ao mecanismo estabelecido da esterase serina. A serina de sítio ativo, localizada dentro do , é facilitada primeiramente pela formação vizinha de uma ponte salina entre Asp-136 e His-152, que induz a apropriação de um próton de Ser-153. O agora altamente nucleofílico Ser-153 irá atacar o carbono carbonilo do grupo do acetato em uma molécula de triactilglicerol. A espécie tetraédrica é estabilizada pelo buraco do oxínion. No entanto, assim que a espécie se desintegra no acetato covalentemente ligado e na lipase, a serina sofre uma deacylação na qual a água age como nucleófilo. Esta última etapa restaura o Ser-153 ao seu estado protonado.
Relevância para a Saúde Humana & Doença
A acção hidrolítica do HGL é algo auxiliar em adultos saudáveis, nos quais o HGL modula no máximo 10-20% da decomposição da gordura dietética . No entanto, a presença de HGL é crucial em bebês prematuros, que frequentemente apresentam função pancreática deficiente, bem como em adultos com insuficiência pancreática patológica (por exemplo, pancreatite crônica) . Estes indivíduos são incapazes de produzir quantidades adequadas de lipase pancreática e devem, portanto, contar principalmente com HGL para a digestão de gorduras dietéticas . Nesses indivíduos, HGL é responsável pela hidrolização de 30-60% dos triglicerídeos da dieta .
Tomasik et al. (2013) investigaram a regulação hormonal da secreção de HGL em crianças e adolescentes com gastrite. A atividade HGL foi comparada em três grupos: um grupo experimental composto por adolescentes com diagnóstico de Helicobacter pylori gastrite (n = 10), outro grupo experimental composto por adolescentes com uma forma não induzida de H. pylori gastrite (n = 10), e um grupo controle de adolescentes saudáveis (n = 14). Atividade HGL, além das concentrações plasmáticas de peptídeo 1 tipo glucagon, colecistoquinina e peptídeo insulinotrópico dependente de glucos, foram observadas através da análise de amostras de suco gástrico que haviam sido coletadas através de medidas endoscópicas de cada paciente.
Patientes cuja gastrite superficial foi induzida por outros patógenos que não o H. pylori apresentaram níveis mais baixos de atividade HGL comparados tanto com adolescentes saudáveis (p < .005) quanto com aqueles que foram diagnosticados com H. pylori gastrite (p < .005). As concentrações plasmáticas médias de peptídeo insulinotrópico dependente de glicose-dependente foram menores em pacientes saudáveis (p < 0,005) do que naqueles com gastrite não-H. pylori (p < .003) e naqueles com H. pylori gastritis (p < 0,01). A regulação da secreção HGL por peptídeo 1 (GLP-1) e colecistoquinina (CCK) foi, portanto, alterada em adolescentes com gastrite; em apoio a este achado, foi sugerido na literatura existente que a GLP-1 e a CCK inibem a secreção HGL. Além disso, verificou-se que o peptídeo insulinotrópico dependente da glucose-dependente é um poderoso ativador da atividade da lipase gástrica humana em todos os grupos experimentais e controle .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG