>
Conteúdo
>
- 1 Função
- 2 Mecanismo para cordãotransferência inibição actio
- 3 HIV e AIDS
- 4 Impacto da Estrutura
- 5 PFV Cristalização Intasome
- 5.1 Técnica de Cristalização
- 5.2 Estatísticas Cristalográficas e de Refinamento
- 6 Arquitetura Geral & Componentes
- 6.1 Estrutura
- 6.2 Interações Integrase e DNA
- 6.3 Site Ativo
>
>
- 7 Inibidores Integrase
- >
- 7.1 Recursos adicionais
- 8 Estruturas 3D de integrase retroviral
>
Função
Integrase retroviral é uma enzima retroviral essencial que se liga ao DNA viral e o insere em um cromossomo de célula hospedeira. O cDNA transcrito reverso do vírus da imunodeficiência humana tipo 1 (HIV-1) é inserido no genoma da célula hospedeira a fim de aumentar a aptidão patogénica e a virulência. A integridade é produzida por uma classe de retrovírus (como o HIV) e é usada pelo vírus para incorporar seu material genético no DNA da célula hospedeira. A maquinaria celular do hospedeiro produz então mRNA e depois proteína do material genético incorporado, replicando assim o vírus. Embora várias drogas inibidoras da integrase tenham sido investigadas, o mecanismo responsável pela ação inibidora da transferência de fios ainda não foi elucidado. Contudo, Hare el al (2010) determinou os constituintes estruturais da integração retroviral. Uma maior elucidação da estrutura completa da integrase retroviral, e sua aplicação para regular atividades funcionais e enzimáticas poderia potencialmente permitir aos pesquisadores retardar a progressão das doenças retrovirais. Além disso, o estudo da integração do HIV-1 poderia levar a um novo alvo promissor, e contribuir para a geração de modelos farmacóforos para a terapia antiviral.
Inibidores de HIV Integrase: Raltegravir, comercializado como Isentress é atualmente aprovado como um inibidor terapêutico da integrase do HIV. Foi aprovado em 12 de outubro de 2007. Para a fago integrase ver fago integrase.
Mecanismo de inibição de transmissão
Caption
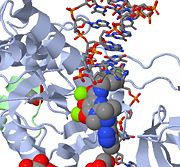
Acima está uma imagem JMOL do MK-0518 bloqueando a extremidade de 3′ do DNA viral de ligar o local ativo. Observe os átomos de oxigênio quelante metálico no MK-0518 interagindo com os cátions de magnésio encontrados no local ativo.
HIV integrase tipo 1 é um alvo relativamente novo e novo para os inibidores. Em 2007, o primeiro inibidor da integrase do HIV-1, Raltegravir, foi aprovado pela FDA para uso no HIV-1 como terapia combinada. Os inibidores de transferência de estrangulamento funcionam impedindo a integração concertada do DNA viral no cromossoma hospedeiro. Após a entrada viral na célula hospedeira, a transcriptase reversa converte o ssRNA viral em dsDNA. Neste ponto, a integrase forma um complexo com o DNA viral, criando o complexo de pré-integração (intasome). O complexo de pré-integração é então acompanhado no núcleo, onde dois nucleotídeos são excisados a partir da extremidade de 3′. Em seguida, o DNA é então covalentemente integrado ao DNA hospedeiro. Os inibidores de transferência de fios interrompem este processo, impedindo a integração do ADN viral no cromossoma hospedeiro. Os inibidores de transferência de strand-transfer funcionam encaixando os cofactores de iões metálicos encontrados no local activo da integrase retroviral. Os átomos de oxigênio quelantes metálicos encontrados nos inibidores interagem diretamente com os cofatores metálicos, enquanto o grupo halobenzil cabe na bolsa criada pelo DNA viral 3′ deslocado no local ativo.
HIV e AIDS

Em 2010, mais de 25 milhões de pessoas morreram de AIDS, e estima-se que aproximadamente 33 milhões de pessoas estão vivendo com HIV.
Até hoje, mais de 25 milhões de pessoas morreram de AIDS, e estima-se que aproximadamente 33 milhões de pessoas estão vivendo com HIV hoje. Para inibidores de integrase retroviral ver Raltegravir e Inibidor de Integrase Retroviral Farmacocinética.
Impacto da Estrutura
Estruturas tridimensionais para certas proteínas de células hospedeiras críticas para compreender o mecanismo da infecção pelo HIV e virulência emergiram de análises cristalográficas de raios X. As estruturas protease e integrase do HIV estão entre as estruturas mais bem classificadas que contribuíram para salvar muitas vidas e adicionaram à qualidade de vida de muitos indivíduos infectados pelo HIV. É implementado no desenho de medicamentos baseados em estruturas para desenvolver inibidores de protease e de integrase, e é usado como um componente significativo da terapia anti-retroviral altamente activa (HAART).
Embora os agentes anti-retrovirais existentes melhorem a qualidade de vida, bem como prolonguem a vida de muitos pacientes, não conseguem erradicar a doença. Estudos em inibidores da integrase mostram que a combinação com outros medicamentos anti-retrovirais diminui as adaptações virais e pode ter o potencial de ser usada para a terapia de salvamento de pacientes que adquiriram resistência a outros medicamentos. Para mais, por favor veja
- AIDS Antes dos Inibidores de Protease & Inibidores de Protease do HIV: A Breakthrough
- Tratamentos: Inibidores de Integrase Retroviral Referências Farmacocinéticas.
Cristalização Intasome PFV
Para imitar os fins de DNA viral do HIV-1, Hare et al (2010) utilizaram preparações intasome de protótipos solúveis e totalmente funcionais (PFV), obtidas usando integrase PFV recombinante e oligonucleotídeos de dupla cadeia.
A notável estabilidade dos complexos integrase-DNA foi determinada pela observação das reações de transferência de cordões in vitro, que foram classificadas em três modos de migração de desproteção: (1) eventos únicos concertados: plasmídeo alvo linearizado; (2) eventos múltiplos concertados: esfregaço; (3) eventos de meio local: ADN circular aberto. A caracterização adicional do intasome do PFV também exibiu substancialidade estrutural que implicou fortes interações proteína-proteína e proteína-ADN apesar da incubação prolongada sob condições de alta resistência iônica. Ensaios compreensivos de cristalização efetuaram uma configuração cristalina viável que difratou os raios X para uma resolução de 2,9 Angstroms. Uma estrutura tridimensional foi finalmente determinada. A unidade assimétrica continha um único dímero integrase com uma molécula viral de DNA estavelmente ligada, e um par de dímeros integrase consolados com simetria, que formava um tetrâmero oblongo. A interface do dímero é estabilizada por interações intermoleculares dos domínios do amino terminal e do núcleo catalítico (subunidade interna da subunidade). A forma geral do tetrâmero oblongo é única, embora com semblantes para complexos integrase HIV-1 previamente relatados.
Técnica de cristalização
Os complexos proteína-DNA foram formados usando o PFV IN de comprimento total, tipo selvagem e dsDNA sintético que modelou a extremidade viral.
O intasome foi cristalizado usando a técnica de difusão de suspensão de vapor-droping. A solução do reservatório consistiu de sulfato de amônio 1,35 M, glicerol 25% (v/v), 1,6-hexanodiol 4,8% (v/v) e ácido etanossulfônico (MES) 50mM 2-(N-morpholino) a pH 6,5. Os cristais de proteínas-DNA também foram embebidos na presença de MK0518, GS9137, Mg(II), e/ou Mn(II). A estrutura cristalina foi resolvida usando substituição molecular.
Estatísticas Cristalográficas e de Refinamento
Hare et al (2010) publicaram dados sobre sete estruturas cristalinas. Estes dados incluem o complexo PFV IN (apo form) e seis estruturas adicionais, incluindo o complexo ligado a Mg, Mn, Mg/MK0518, Mn/MK0518, Mg/GS9137, e Mn/GS9137. Todas as sete estruturas pertencem ao grupo espacial P41212. Elas foram refinadas entre 2,85 e 3,25 Å resolução.
Arquitetura geral & Componentes
Estrutura
A estrutura geral do intasome PFV montado é um modelo de tetrâmero baseado em duas estruturas de domínio com uma interface dimer-dímero. Modelos intasome anteriores descrevem uma estrutura similar, mas mais flexível, enquanto o intasome PFV mostrou ser altamente limitado. Usando a modelagem homológica, Hare et al (2010) propõem que ligadores interdomínios mais curtos podem ser um fator de flexibilidade, especificamente na integrase do HIV-1. As subunidades internas do tetrâmero estão implicadas na tetrâmerização geral e na ligação do DNA viral. Os domínios centrais catalíticos das subunidades externas podem funcionar como suportes, mas como os domínios amino- e carboxi-terminais não estão resolvidos nos mapas de densidade de elétrons, sua função permanece inconclusiva. O domínio do núcleo catalítico e o ligador do domínio carboxi-terminal adotam uma conformação estendida para a maior parte do seu comprimento, e estão localizados paralelamente ao domínio amino-terminal e ligador do domínio do núcleo catalítico da subunidade interna. Os ligadores interdomínio Os ligadores interdomínio (CCD-CTD linker e NTD-CCD linker) unem as duas metades do intasome, e a estrutura é ainda mais estabilizada por um par de domínios carboxi-terminais interagindo com ambos os domínios do núcleo catalítico interno.
Interacções de integração e ADN
Interacções proteína-DNA fortes estão localizadas dentro dos seis nucleótidos terminais. Cada domínio terminal carboxi interage com a espinha dorsal do fosfodiéster de ambas as moléculas de DNA viral. Além disso, o domínio amino-terminal de extensão e o domínio amino terminal interagem com o DNA viral no local ativo do núcleo catalítico oposto.
Site ativo
Carboxilatos do local ativo são cadeias laterais do Asp 128, Asp 185, Glu 221.
Um átomo de zinco cada um está localizado perto dos locais ativos.
- .
- .
Inibidores de integração
| Nome | Marca | Empresa | Patente | Notas |
| Raltegravir | Isentress | Merck & Co. | – | também conhecida como MK-0518. O isopropil e o metil-oxadiazole do MK-0518 estão envolvidos em interações hidrofóbicas e de empilhamento com cadeias laterais de Pro 214 e Tyr 212 para estabilizar este fármaco dentro do local ativo do PFV. Esta forma de interação entre o fármaco e a droga causa o deslocamento da extremidade do DNA viral reativo 3′ do local ativo do intasome do PFV. Após a ligação do MK-0518 ao local ativo, o grupo hidroxila 3′ reativo se afasta do local ativo do intasoma PFV por mais de 6 Angstroms. Raltegravir foi aprovado pela FDA em 12 de outubro de 2007, para uso com outros agentes anti-HIV no tratamento da infecção pelo HIV em adultos. É o primeiro inibidor da integrase aprovado pelo FDA. |
| Elvitegravir | – | Gilead Science | – | GS-9137 interage com o Pro 214 do intasome do PFV através de sua base de quinolona e grupo isopropilo. Em estágios experimentais; compartilha a estrutura central dos antibióticos de quinolona. Estudos de fase II de elvitegravir em pessoas que são tratadas experimentalmente foram concluídos. Os estudos da Fase III em pacientes com experiência de tratamento estão em andamento. Um estudo de fase II de elvitegravir em pessoas que nunca fizeram terapia anti-retroviral está em andamento. Este estudo também será avaliado um agente impulsionador no lugar de Norvir, atualmente chamado GS9350. Elvitegravir tem promessa para pacientes HIV positivos que tomaram outros medicamentos anti-HIV no passado. |
| MK-2048 | – | Merck & Co. | – | Um inibidor de integrase de segunda geração, destinado a ser usado contra a infecção pelo HIV. É superior ao primeiro inibidor de integrase disponível, raltegravir, na medida em que inibe a integrase da enzima HIV 4 vezes mais tempo. Está sendo investigado para uso como parte da profilaxia pré-exposição (PrEP). |
Veja também Inibidor da Integrase Retroviral Farmacocinética.