É importante conhecer a estrutura de Lewis de uma molécula para entender suas propriedades físicas, hibridação e forma da molécula. Hoje vamos passar pela estrutura de Lewis do I3 – ou também conhecido como íon Triodide, pois tem uma carga negativa sobre ele. Existem três moléculas de iodo nesta molécula e por isso o nome do composto é Triodide. Para entender a estrutura de Lewis da molécula, devemos conhecer os elétrons de valência da molécula de iodo.
Lewis Estrutura
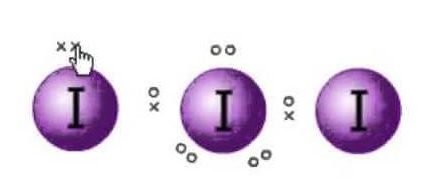
Lewis estrutura é a representação dos elétrons das moléculas. Existem pares solitários e elétrons de valência que ajudam a determinar a hibridação e a forma da molécula. Como existem moléculas de Iodo, uma molécula de Iodo estará no centro. Também, o iodo está no sétimo grupo da tabela periódica e tem sete elétrons de valência em sua órbita externa.

Temos aqui três moléculas de iodo que junto com um elétron extra que lhe dá uma carga negativa. Assim, o número total de elétrons de valência são : 7×3 + 1= 22.
Existem 22 elétrons de valência no total nesta molécula. Agora há uma regra do octeto que cada átomo segue. Segundo esta regra, cada átomo deve ter oito elétrons em sua órbita externa. Se há 8 elétrons na casca externa do átomo central, há dois outros átomos que precisam completar o seu octeto. Como todos os átomos necessitarão de oito electrões na sua concha exterior para completar o octeto, um electrão do átomo central de Iodo será levado pelos dois átomos de Iodo vizinhos. Isto significa 8-1-1=6.
As os elétrons serão tomados por ambos os átomos.
Então agora os elétrons de valência no átomo central de iodo serão seis. Estes seis elétrons formarão os pares solitários de elétrons que não se ligam. Como agora forma o par de elétrons, haverá três pares solitários, e dois pares de ligação dos elétrons, pois cada átomo de iodo tem uma ligação com o átomo central compartilhando um elétron cada no total de 3 pares solitários e 2 pares de ligação no átomo central.
Hibridação
Para conhecer a hibridação de qualquer molécula, há uma fórmula simples que pode ser usada. Esta fórmula é utilizada para descobrir o número de hibridação, que ajuda a conhecer a hibridação da molécula.
Os números da hibridação e a hibridação que determina são indicados da seguinte forma:
- 2: hibridação sp
- 3: hibridação sp2
- 4: hibridação sp3
- 5: hibridação
A fórmula para encontrar o número é,
Número de hibridação: Número de electrões de valência + monovalentes + (carga negativa) – (carga positiva)/2
Os electrões de valência dos átomos de iodo são 7, uma vez que há sete electrões na casca mais externa. O número do átomo monovalente é dois, pois os dois em cada três iodos são monovalentes. Agora quando chegamos à carga do íon I3, ele tem uma carga negativa, então o valor dessa carga negativa será 1,
Agora coloque todos os valores de acordo com a fórmula,
7+1+2/2
=10/2
=5
Assim o número de hibridação é 5, o que significa que sua hibridação é sp3d.
Uma outra forma de encontrar a hibridação de uma determinada molécula é com a ajuda de pares solitários e electrões de valência. O número de pares isolados nesta molécula é 3, e o número de átomos que partilham electrões de valência é 2,
Hence, 3+2=5 o que também determina a hibridação sp3d.
A forma de I3- Ion

A forma da molécula I3- é Linear. Existem três átomos de iodo dos quais um tem uma carga negativa extra. Devido a este elétron extra há 3 pares solitários de elétrons e 2 pares de ligação fazendo com que seja o número estéreo 5. Como há três pares solitários no átomo central de Iodeto, estes pares tentam se repelir o máximo possível. Assim, para se distanciarem a uma distância maior, os pares tomam as posições equatoriais, e os outros dois átomos de Iodo estão a 180 graus um do outro. Assim, a forma geral do íon I3 é linear.
Polaridade
Então aqui está a parte complicada sobre este íon, primeiro de tudo como uma carga sobre ele podemos chamá-lo como um íon poliatômico ao invés de chamá-lo como uma molécula. Os iões são as cargas que vemos nas moléculas. Como o I3 tem um elétron, este íon tem uma carga negativa em geral. As moléculas têm polaridade porque tem tanto as cargas que são uma carga parcialmente positiva como a carga parcialmente negativa. Há um momento dipolo nas moléculas, dependendo da separação das cargas na molécula. Se a distância entre ambas as cargas for maior, o momento dipolo também será maior.
Mas quando falamos de íon I3, é um íon carregado negativamente. Mesmo quando desenhamos, é a estrutura Lewis, não vemos nenhum momento dipolo ou as ligações polares nela, pois a carga total em si é negativa sobre o íon. Portanto, não é polar ou não-polar. Entretanto, se você tem que descrever o íon, você pode usar a frase “como uma molécula polar” porque I3- é solúvel em água.
Em observações finais, para resumir, todo este artigo, I3- é um íon poliatômico que tem 22 valências elétricas, 3 pares solitários, 2 pares de ligações, e hibridização sp3d. Ele tem forma linear e não tem polaridade.