Avaliação | Biopsicologia | Comparativo |Cognitivo |Desenvolvimento |Linguagem | Diferenças individuais |Personalidade | Filosofia | Social |
Métodos | Estatística |Clinical |Educativo | Industrial |Profissional |Psicologia Mundial |
Biológica:Genética comportamental – Psicologia evolutiva – Neuroanatomia – Neuroquímica – Neuroendocrinologia – Neurociência – Psiconeuroimunologia – Psicologia Fisiológica – Psicofarmacologia(Índice, Esboço)
>
| Cérebro: Hypothalamus | ||
|---|---|---|
|
|
||
| Localização do hipotálamo humano | ||
|
|
||
| Dienchephalon | ||
| Latina | hypothalamus | |
| Gray’s | assunto #189 812 | |
| Parte de | ||
| Componentes | ||
| Artery | ||
| Vein | ||
| BrainInfo/UW | hier-358 | |
| MeSH | A08.186.211.730.385.357 | |
O hipotálamo liga o sistema nervoso ao sistema endócrino através da hipófise (hipófise). O hipotálamo, (do grego ὑποθαλαμος = sob o tálamo) está localizado abaixo do tálamo, logo acima do tronco cerebral. Esta glândula ocupa a maior porção da região ventral do diencéfalo. Ela é encontrada em todos os cérebros de mamíferos. Em humanos, é aproximadamente do tamanho de uma amêndoa.
O hipotálamo regula certos processos metabólicos e outras atividades do Sistema Nervoso Autonômico. Ele sintetiza e secreta neuro-hormônios, muitas vezes chamados hormônios liberadores do hipotálamo, e estes por sua vez estimulam ou inibem a secreção de hormônios pituitários.
O hipotálamo controla a temperatura corporal, fome, sede, fadiga, raiva e ciclos circadianos.
- Entradas
- Estímulos olfativos
- Estímulos transmitidos pelo sangue
- Esteróides
- Inputs neurais
- Núcleos
- Saídas
- Projeções neurais
- Hormônios endócrinos
- Controle da ingestão de alimentos
- Dimorfismo sexual
- Respostas aos esteróides ovarianos
- os esteróides gonadais na vida neonatal de ratos
- Andrógenos em primatas
- Outras influências sobre o desenvolvimento hipotalâmico
- Efeitos do envelhecimento no hipotálamo
- Ver também
- Imagens adicionais
- Referências & Bibliografia
- Artigos
- Material adicional
- Papéis
Entradas
O hipotálamo é uma região muito complexa no cérebro dos humanos, e mesmo pequenos núcleos dentro do hipotálamo estão envolvidos em muitas funções diferentes. O núcleo paraventricular, por exemplo, contém neurônios oxitocina e vasopressina (também chamados de hormônio antidiurético) que se projetam para a pituitária posterior, mas também contém neurônios que regulam a secreção de ACTH e TSH (que se projetam para a pituitária anterior), reflexos gástricos, comportamento materno, pressão arterial, alimentação, respostas imunológicas e temperatura.
O hipotálamo coordena muitos ritmos circadianos hormonais e comportamentais, padrões de complexidade de saídas neuroendócrinas, mecanismos homeostáticos complexos, e muitos comportamentos importantes. O hipotálamo deve, portanto, responder a muitos sinais diferentes, alguns dos quais são gerados externamente e outros internamente. Está assim ricamente ligado a muitas partes do SNC, incluindo a formação reticular do tronco cerebral e zonas autonômicas, o forencéfalo límbico (particularmente a amígdala, septo, banda diagonal de Broca, e os bulbos olfativos, e o córtex cerebral).
O hipotálamo é responsivo a:
- Luz: duração do dia e fotoperíodo para regular ritmos circadianos e sazonais
- Estímulos olfativos, incluindo feromonas
- Esteroides, incluindo esteróides gonadais e corticosteróides
- Informações transmitidas por via oral, em particular do coração, do estômago, e o trato reprodutivo
- Insumos autonômicos
- Espiculos de sangue, incluindo leptina, ghrelin, angiotensina, insulina, hormônios pituitários, citocinas, concentrações plasmáticas de glicose e osmolaridade, etc
- Estresse
- Microorganismos invasores através do aumento da temperatura corporal, reajustando o termostato do corpo para cima.
Estímulos olfativos
Estímulos olfativos são importantes para a reprodução e função neuroendócrina em muitas espécies. Por exemplo, se um rato grávido é exposto à urina de um macho ‘estranho’ durante um período crítico após o coito, então a gravidez falha (efeito Bruce). Assim, durante o coito, uma ratazana fêmea forma uma “memória olfativa” precisa do seu parceiro que persiste durante vários dias. As pistas feromonais ajudam a sincronizar o cio em muitas espécies; nas mulheres, a menstruação sincronizada também pode surgir das pistas feromonais, embora o papel das feromonas nos humanos seja duvidado por alguns.
Estímulos transmitidos pelo sangue
Os hormônios peptídeos têm importantes influências sobre o hipotálamo, e para isso devem evitar a barreira hemato-encefálica. O hipotálamo é limitado em parte por regiões especializadas do cérebro que não possuem uma barreira hematoencefálica efetiva; o endotélio capilar nesses locais é fenestrado para permitir a passagem livre até mesmo de grandes proteínas e outras moléculas. Alguns desses locais são os locais de neurosecreção – a neuro-hipófise e a eminência mediana. No entanto, outros são locais em que o cérebro colhe amostras da composição do sangue. Dois desses locais, o órgão subfornical e o OVLT (organum vasculosum da lâmina terminalis) são os chamados órgãos circunventriculares, onde os neurônios estão em contato íntimo tanto com o sangue quanto com o LCR. Essas estruturas são densamente vascularizadas e contêm neurônios osmoreceptivos e receptores de sódio que controlam o consumo de álcool, a liberação de vasopressina, a excreção de sódio e o apetite por sódio. Eles também contêm neurônios com receptores para angiotensina, fator natriurético atrial, endotelina e relaxina, cada qual importante na regulação do equilíbrio de fluidos e eletrólitos. Neurônios no projeto OVLT e OVSF projetam para o núcleo supraótico e paraventricular, e também para áreas hipotalâmicas pré-ópticas. Os órgãos circunventriculares também podem ser o local de ação das interleucinas para provocar febre e secreção do ACTH, via efeitos sobre os neurônios paraventriculares.
Não está claro como todos os peptídeos que influenciam a atividade hipotalâmica ganham o acesso necessário. No caso da prolactina e leptina, há evidência de captação ativa no plexo coróide do sangue para o LCR. Alguns hormônios hipofisários têm uma influência negativa na secreção hipotalâmica; por exemplo, o hormônio de crescimento se alimenta do hipotálamo, mas como ele entra no cérebro não é claro. Há também evidências de ações centrais de prolactina e TSH.
Esteróides
O hipotálamo contém neurônios sensíveis a esteróides gonadais e glicocorticóides – (os hormônios esteróides da glândula adrenal, liberados em resposta ao ACTH). Também contém neurônios sensíveis ao glucose-sensitive (no núcleo arcuate e no hipotálamo ventromedial), que são importantes para o apetite. A área pré-óptica contém neurônios termossensíveis; estes são importantes para a secreção de TRH.
Inputs neurais
O hipotálamo recebe muitos inputs do tronco cerebral; notadamente do núcleo do trato solitário, do locus coeruleus, e da medula ventrolateral. A secreção de ocitocina em resposta à estimulação suculenta ou vagino-cervical é mediada por algumas dessas vias; a secreção de vasopressina em resposta a estímulos cardiovasculares decorrentes de quimiorreceptores no seio carotídeo e arco aórtico, e de receptores de volume atrial de baixa pressão, é mediada por outros. No rato, a estimulação da vagina também causa secreção de prolactina, o que resulta em pseudo-pregnação após um acasalamento estéril. No coelho, o coito elicita a ovulação reflexa. Nas ovelhas, a estimulação cervical na presença de altos níveis de estrogênio pode induzir o comportamento materno em uma ovelha virgem. Estes efeitos são todos mediados pelo hipotálamo, e a informação é levada principalmente pelas vias espinhais que se transmitem no tronco encefálico. A estimulação dos mamilos estimula a liberação de oxitocina e prolactina e suprime a liberação de LH e FSH.
Estímulos cardiovasculares são transportados pelo nervo vago, mas o vago também transmite uma variedade de informações viscerais, incluindo, por exemplo, sinais decorrentes da distensão gástrica para suprimir a alimentação. Novamente esta informação chega ao hipotálamo através de relés no tronco encefálico.
Núcleos
Os núcleos hipotalâmicos incluem o seguinte:
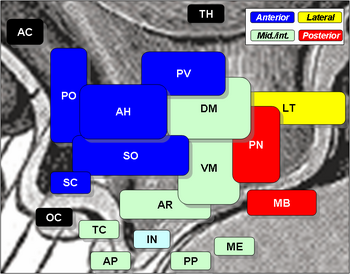
Núcleos hipotalâmicos
| Região | Área | Núcleo | Função |
| Anterior | Medial | Núcleo pré-óptico medial |
|
| Supraóptica núcleo (SO) |
|
||
| Núcleo paraventricular (PV) |
|
||
| Núcleo hipotalâmico anterior (AH) |
> |
||
| Núcleo Supraquiasmático (SC) |
|
||
| Lateral | Núcleo pré-óptico lateral | ||
| Núcleo lateral (LT) |
|
||
| Parte do núcleo supraóptico (SO) |
|
||
| Tuberal | Medial | Núcleo hipotalâmico dorsomedial (DM) |
|
| Núcleo Ventromedial (VM) |
|
||
Núcleo arqueado (RA)
|
|||
| Lateral | Núcleo lateral (LT) |
|
|
| Núcleos tuberais laterais | |||
| Posterior | Medial | Núcleos mamilares (parte de corpos mamilares) (MB) |
|
| Núcleo posterior (PN) |
> |
||
| Lateral | Núcleo lateral (LT) |
Veja também: núcleo ventrolateral pré-óptico
Saídas
As saídas do hipotálamo podem ser divididas em duas categorias: projeções neurais, e hormônios endócrinos.
Projeções neurais
Os sistemas de fibras do hipotálamo correm de duas maneiras (bidirecionais).
- Projeções para áreas caudais ao hipotálamo atravessam o feixe forencéfalo medial, o trato mamilotegmental e o fasciculus longitudinal dorsal.
- Projeções para áreas rostrais ao hipotálamo são levadas pelo trato mamilotalâmico, o fórnix e a estria terminal.
Hormônios endócrinos
O hipotálamo afeta o sistema endócrino e rege o comportamento emocional, tais como, raiva e atividade sexual. A maioria dos hormônios hipotalâmicos gerados são distribuídos para a pituitária através do sistema portal hipofisário. O hipotálamo mantém a homeostase, que inclui a regulação da pressão arterial, freqüência cardíaca e temperatura.
Os hormônios hipotalâmicos primários são:
| Nome | Outros Nomes | A abreviaturas | Localização | Função |
|---|---|---|---|---|
| Hormônio liberador de corticotropina | Fator liberador de corticotropina, Corticoliberina | CRH, CRF | neurônios neuroendócrinos parvocelulares no núcleo paraventricular | com vasopressina, estimula a hipófise anterior a secretar ACTH |
| Dopamina | Hormônio inibidor dorolactina | DA, PIH | neurónios neuroendócrinos do núcleo arqueado | inibe a secreção de prolactina da pituitária anterior |
| Hormônio liberador de gonadotropina | Hormônio liberador de hormônio luteinizante | GnRH, LHRH | neurónios neuroendócrinos nos núcleos pré-óptico medial e arcuate | estimula a hipófise anterior para secretar LH e FSH |
| Hormônio de crescimento liberador de hormônio | Fator de crescimento liberador de hormônio, somatocrinina | GHRH, GHRF, GRF | neurónios neuroendócrinos arcuate nucleus | estimula a hipófise anterior para secretar a hormona de crescimento |
| Melatonina | Núcleo supraquiasmático | |||
| Somatostatina | Hormônio do crescimento-hormônio inibidor, Fator inibidor da liberação de somatotropina | SS, GHIH, SRIF | neurónios neuroendócrinos do núcleo periventricular | inibe a secreção de hormona de crescimento da hipófise anterior |
| Hormona libertadora de hidrotropina | Fator libertador de hidrotropina, Thyroliberin, Protirelin | TRH, TRF | neurônios neuroendócrinos parvocelulares nos núcleos paraventricular e hipotalâmico anterior | estimula a hipófise anterior para secretar TSH |
Veja também: Hypocretin
Controle da ingestão de alimentos
A parte lateral extrema do núcleo ventromedial do hipotálamo é responsável pelo controle da ingestão de alimentos. A estimulação desta área causa o aumento da ingestão de alimentos. A lesão bilateral desta área causa a completa cessação da ingestão de alimentos. As partes mediais do núcleo têm um efeito de controle na parte lateral. A lesão bilateral da parte medial do núcleo ventromedial causa hiperfagia e obesidade do animal. Outras lesões da parte lateral do núcleo ventromedial no mesmo animal produzem cessação completa da ingestão alimentar.
Existem diferentes hipóteses relacionadas a esta regulação:
- Hipótese lipostática – esta hipótese sustenta que o tecido adiposo produz um sinal humoral que é proporcional à quantidade de gordura e age no hipotálamo para diminuir a ingestão alimentar e aumentar a produção de energia. Tem sido evidente que um hormônio leptina age no hipotálamo para diminuir a ingestão de alimentos e aumentar a produção de energia.
- Hipótese Gutpeptide – hormônios gastrointestinais como Grp, glucagons, CCK e outros afirmam inibir a ingestão de alimentos. Os alimentos que entram no trato gastrointestinal provocam a liberação desses hormônios que atuam no cérebro para produzir a saciedade. O cérebro contém ambos os receptores CCK-A e CCK-B.
- Hipótese glicostática – a atividade do centro de saciedade nos núcleos ventromediais é provavelmente governada pela utilização da glicose nos neurônios. Tem sido postulado que quando a utilização da glicose é baixa e consequentemente quando a diferença de glicose no sangue arteriovenoso entre eles é baixa, a atividade entre os neurônios diminui. Sob estas condições, a atividade do centro de alimentação é descontrolada e o indivíduo sente fome. O consumo alimentar é rapidamente aumentado pela administração intraventricular de 2-deoxiglicose, diminuindo assim a utilização de glicose nas células.
- Hipótese termostática – de acordo com esta hipótese, uma diminuição da temperatura corporal abaixo de um determinado set point estimula o apetite, enquanto um aumento acima do set point inibe o apetite.
Dimorfismo sexual
Núcleos hipotalâmicos siderais são sexualmente dimórficos, ou seja, existem diferenças claras na estrutura e função entre homens e mulheres.
Algumas diferenças são aparentes mesmo na neuroanatomia bruta: a mais notável é o núcleo sexual dimórfico dentro da área pré-óptica, que está presente apenas nos homens. Entretanto, a maioria das diferenças são mudanças sutis na conectividade e sensibilidade química de conjuntos particulares de neurônios.
A importância dessas mudanças pode ser reconhecida pelas diferenças funcionais entre machos e fêmeas. Por exemplo, o padrão de secreção do hormônio de crescimento é sexualmente dimórfico, e esta é uma das razões pelas quais em muitas espécies, os machos adultos são muito maiores que as fêmeas.
Respostas aos esteróides ovarianos
Outros dimorfismos funcionais marcantes estão nas respostas comportamentais aos esteróides ovarianos do adulto. Homens e mulheres respondem diferentemente aos esteróides ovarianos, em parte porque a expressão de neurônios sensíveis ao estrogênio no hipotálamo é sexualmente dimórfica, ou seja, os receptores de estrogênio são expressos em diferentes conjuntos de neurônios.
Estrogênio e progesterona podem influenciar a expressão gênica em neurônios específicos ou induzir mudanças no potencial da membrana celular e ativação da cinase, levando a diversas funções celulares não-genômicas. O estrogênio e a progesterona ligam-se aos seus receptores cognatos de hormônio nuclear, que se translocam para o núcleo celular e interagem com regiões de DNA conhecidas como elementos de resposta hormonal (EAR) ou são amarrados a outro local de ligação do fator de transcrição. O receptor de estrogénio (ER) demonstrou transaccionar outros factores de transcrição desta forma, apesar da ausência de um elemento de resposta ao estrogénio (ERE) na região promotora proximal do gene. Os receptores de ER e Progesterona (PRs) são geralmente ativadores gênicos, com aumento do mRNA e subsequente síntese protéica após exposição hormonal.
Cérebro masculino e feminino diferem na distribuição dos receptores de estrogênio, e esta diferença é uma consequência irreversível da exposição neonatal aos esteróides. Os receptores de estrogênio (e receptores de progesterona) são encontrados principalmente em neurônios no hipotálamo anterior e mediobasal, notadamente:
- a área pré-óptica (onde os neurônios LHRH estão localizados)
- o núcleo periventricular (onde os neurônios somatostatina estão localizados)
- o hipotálamo ventromedial (que é importante para o comportamento sexual).
os esteróides gonadais na vida neonatal de ratos
Na vida neonatal, os esteróides gonadais influenciam o desenvolvimento do hipotálamo neuroendócrino. Por exemplo, eles determinam a capacidade das fêmeas de exibir um ciclo reprodutivo normal, e dos machos e fêmeas de exibir comportamentos reprodutivos apropriados na vida adulta.
- Se um rato fêmea é injetado uma vez com testosterona nos primeiros dias de vida pós-natal (durante o “período crítico” da influência sexual-esteróide), o hipotálamo é irreversivelmente masculinizado; o rato adulto será incapaz de gerar uma onda de LH em resposta ao estrogênio (uma característica das fêmeas), mas será capaz de exibir comportamentos sexuais masculinos (montando uma fêmea sexualmente receptiva).
- Por contraste, um rato macho castrado logo após o nascimento será feminizado, e o adulto mostrará comportamento sexual feminino em resposta ao estrogênio (receptividade sexual, lordose}.
Andrógenos em primatas
Em primatas, a influência do desenvolvimento de andrógenos é menos clara, e as conseqüências são menos completas. O ‘Tomboyismo’ em meninas pode refletir os efeitos dos andrógenos no cérebro fetal, mas o sexo da criação durante os primeiros 2-3 anos é considerado por muitos o determinante mais importante da identidade de gênero, porque durante esta fase tanto o estrogênio quanto a testosterona terão efeitos permanentes no cérebro feminino ou masculino, influenciando tanto a heterossexualidade quanto a homossexualidade.
O paradoxo é que os efeitos masculinizantes da testosterona são mediados pelo estrogênio. Dentro do cérebro, a testosterona é aromatizada a (estradiol), que é a principal hormona activa para as influências do desenvolvimento. O testículo humano segrega altos níveis de testosterona desde cerca da 8ª semana de vida fetal até 5-6 meses após o nascimento (um surto perinatal semelhante de testosterona é observado em muitas espécies), um processo que parece estar subjacente ao fenótipo masculino. O estrogênio da circulação materna é relativamente ineficaz, em parte devido aos altos níveis circulantes de proteínas ligadas a esteróides na gravidez.
Outras influências sobre o desenvolvimento hipotalâmico
Os esteróides sexuais não são as únicas influências importantes sobre o desenvolvimento hipotalâmico; em particular, o estresse pré-puberal no início da vida determina a capacidade do hipotálamo adulto de responder a um estressor agudo. Ao contrário dos receptores de esteróides gonadais, os receptores de glicocorticóides são muito difundidos por todo o cérebro; no núcleo paraventricular, eles mediam o controle de feedback negativo da síntese e secreção de CRF, mas em outros lugares seu papel não é bem compreendido.
Efeitos do envelhecimento no hipotálamo
Estudos em ratos fêmeas mostraram que tanto o núcleo Supraótico (SON) quanto o Paraventricular (PVN) perdem aproximadamente um terço das células imunoreativas IGF-1R com envelhecimento normal. Além disso, camundongos idosos com restrição calórica (CR) perderam números mais elevados de células não imunoreativas IGF-1R, mantendo contagens semelhantes de células imunoreativas IGF-1R em comparação com camundongos idosos. Consequentemente, os ratos Old-CR mostram uma maior percentagem de células imunoreativas IGF-1R refletindo uma maior sensibilidade hipotalâmica ao IGF-1 em comparação com os ratos normalmente envelhecidos.
Ver também
- Eixo HPA
- Sistema hipofisário hipotálamo
- Sistema hipofisário hipotálamo adrenalina
- Lesões hipotálamo
- Feixe de feixes forebrais mediais
- Neuroendocrinologia
- Área pré-óptica
Imagens adicionais
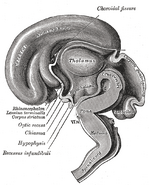
Adicionar uma foto a esta galeria
- http://www.cancer.gov/Templates/db_alpha.aspx?CdrID=46359
- http://www.sci.uidaho.edu/med532/hypothal.htm
- Diagrama de Núcleos (psicoeducação.org)
- Diagrama de Núcleos (universe-review.ca)
- Diagrama de Núcleos (utdallas.edu)
- A menos que especificado em tabela, então a ref. é: Guyton Eight Edition
- Walter F., PhD. Boron. Fisiologia Médica: A Cellular And Molecular Approaoch, Elsevier/Saunders. Página 840
- http://thalamus.wustl.edu/course/hypoANS.html
- http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/hypopit/overview.html
- Theologides A (1976). Metabolitos intermediários produtores de anorexia. Am J Clin Nutr 29 (5): 552-8.
- John Money, ‘The concept of gender identity disorder in childhood and adolescence after 39 years’, Journal of Sex and Marital Therapy 20 (1994): 163-77.
- Romeo, Russell D, Rudy Bellani, Ilia N. Karatsoreos, Nara Chhua, Mary Vernov, Cheryl D. Conrad e Bruce S. McEwen (2005). Stress History and Pubertal Development Interact to Shape Hypothalamic-Pituitary-Adrenal Axis Plasticity. Endocrinologia 147 (4): 1664-1674.
- Saeed O,Yaghmaie F,Garan SA,Gouw AM,Voelker MA,Sternberg H,Timiras PS. (2007). As células imunoreativas do receptor de fator de crescimento paraventricular do receptor de insulina 1 são mantidas seletivamente no hipotálamo paraventricular de camundongos com restrição calórica. Int J Dev Neurosci 25 (1): 23-8.
- Yaghmaie F, Saeed O, Garan SA, Voelker MA, Gouw AM, Freitag W, Sternberg H, Timiras PS (2006). A perda dependente da idade das células imunoreativas do receptor do fator de crescimento 1 do tipo insulina no hipotálamo supraóptico é reduzida em ratos com restrição calórica. Int J Dev Neurosci 24 (7): 431-6.
- F. Yaghmaie, O. Saeed, S.A. Garan, A.M. Gouw, P. Jafar, J. Kaur, S. Nijjar, P.S. Timiras, H. Sternberg, M.A. Voelker (2007). Tracking changes in hypothalamic IGF-1 sensitivity with aging and calic restriction. Gerontologia experimental 42 (1-2): 148-149.
Referências & Bibliografia
Artigos
- Árvores, E.A. e Mayer, B, (1967) Anatomical connections between medial and lateral regions of the hypothalamus concerned with food intake, Science 157: 1574-5
- Grossman, S.P. (1960) Eating or drinking elicited by direct adrenergic or cholinergic stimulation of the hypothalamus, Science 132: 301-2.
- Hetherington, A.W. and Ranson, S.W. (1942) The relation of various hypothalamic lesions to adiposity in the rat, 76: 475-99.
Material adicional
Papéis
- Google Scholar
- Mapas Cerebrais na UCDavis Hypothalamus
- Sistema endócrino e hipotálamo
- Alto…Resolução Cytoarchitectural Primate Brain Atlases
- The Hypothalamus and Pituitary at endotexts.org
- Diagrama de Núcleos (psycheducation.org)
- Diagrama de Núcleos (universe-review.ca)
- Diagrama de Núcleos (utdallas.edu)
|
v-d-e
Cérebro humano: diencéfalo (TA A14.1.08, GA 9.807) |
||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Epithalamus |
|
Surface
|
||||||||||||
| Thalamus |
|
Superfície
|
Matéria cinzenta/
nuclei |
|||||||||||
| Hypothalamus |
|
|||||||||||||
| Subthalamus |
Núcleo subtalâmico – Zona incerta |
|||||||||||||
| Sistema ventricular: Terceiro ventrículo |
Recessos: (Recesso óptico, Recesso Infundibular, Recesso Suprapineal, Recesso Pineal) Sulcus Tipotalâmico – Tela corioidea do terceiro ventrículo Órgão subfornico Aperturas: Interventricular/Monro Comiseraçãoosterior |
|||||||||||||
|
v-d-e
Anatomia humana, sistema endócrino: glândulas endócrinas |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hipotalâmica/ eixos hipofisários |
|
|
||||||||||||||
| Glândula pineal | >
Pinealócitos – Corpora arenacea |
|||||||||||||||
| Islets de pâncreas |
Célula Alfa – Célula Beta – Célula Delta – Célula PP – Célula Epsilon |
|||||||||||||||
Cérebro humano: Sistema límbico
Amígdala – Giro cingulado – Giro fornicado – Hipocampo – Hipotálamo – Corpo mamífero – Núcleo acumbente – Córtex orbitofrontal – Giro parahipocampal