- Introduction
- As bases genéticas da decomposição híbrida no arroz
- Mecanismos moleculares subjacentes à decomposição híbrida
- Divisão híbrida no cultivo convencional de arroz
- Divisão Híbrida na Reprodução Genômica Assistida
- Discussão
- Data Availability Statement
- Author Contributions
- Conflito de interesses
- Confirmações
Introduction
Breeders and researchers like have been interested in hybridization and introgression between divergent genotypes as the potential driver leading to the ecological divergence of progeny (Rieseberg et al., 2007; Arnold et al., 2012). Por outro lado, a hibridação pode por vezes envolver uma reduzida aptidão híbrida, como fraqueza e/ou esterilidade em F1 e gerações posteriores, mesmo em casos de hibridação entre membros da mesma espécie.
A viabilidade híbrida reduzida e/ou a segregação da fertilidade em F2 ou gerações posteriores são referidas como decomposição híbrida (HB), na qual os alelos recessivos estão necessariamente associados. Esta barreira reprodutiva tem sido observada há muito tempo tanto em plantas como em animais (Dobzhansky, 1970; Grant, 1971). Muitas das análises genéticas desta barreira revelaram que ela é realizada por um efeito complementar entre e/ou entre loci com alelos diferenciados, comumente chamados de incompatibilidade Bateson-Dobzhansky-Muller (BDM) (Rieseberg e Willis, 2007). O HB envolve necessariamente barreiras reprodutivas pós-enzigóticas intrínsecas, como a inviabilidade híbrida (incluindo fraqueza, necrose e clorose) e a esterilidade híbrida (no macho, fêmea ou ambos os gametas); portanto, alguns pesquisadores podem não distinguir o HB da inviabilidade e esterilidade na progênie F1. Entretanto, eu acredito que o HB é uma classificação conveniente para barreiras reprodutivas porque implica sua base genética subjacente (ou seja, o envolvimento de alelos recessivos).
Estudos recentes usando as espécies de plantas modelo Arabidopsis têm fornecido uma melhor compreensão do HB em relação aos seus mecanismos moleculares (Vaid e Laitinen, 2019). Por outro lado, embora o arroz (espécie Oryza) seja uma cultura modelo, a compreensão atual da base genética do HB permanece limitada nesta espécie, provavelmente porque o HB não é uma barreira reprodutiva nos híbridos F1, nos quais se espera uma maior produção de grãos em comparação com as linhas parentais consanguíneas, e provavelmente porque plantas inferiores que segregam em F2 e gerações posteriores podem ser facilmente selecionadas com base no fenótipo da população reprodutora. A dificuldade no mapeamento genético causada pela herança recessiva também pode estar por trás dessa limitação.
Aqui, eu esboço o HB em cruzamentos de arroz ao me referir a informações fornecidas por estudos de Arabidopsis, e discuto como o HB é tratado na criação de arroz.
As bases genéticas da decomposição híbrida no arroz
Considera-se que o arroz cultivado, O. sativa japonica e indica, forma um complexo de espécies com seu suposto progenitor (O. rufipogon) e espécies silvestres; entretanto, múltiplas barreiras reprodutivas, incluindo o HB, são observadas em cruzamentos entre eles (Oka, 1988; Vaughan et al, 2003).
Até onde sei, o Dr. Oka foi o primeiro a descrever a base genética do HB em cruzamentos inter-subespecíficos entre japonica e indica, a qual foi contabilizada por dois genes complementares (Oka, 1957). Entretanto, os genes responsáveis não foram mapeados nos cromossomos, porque os marcadores moleculares não estavam disponíveis naquela época.
Em híbridos de arroz, o HB tem sido frequentemente descrito em cruzamentos interespecíficos (O. sativa ssp. japonica × ssp. indica) e interespecíficos (O. sativa × O. nivara e O. sativa × O. glumaepatula) (Oka, 1957; Sato e Morishima, 1988; Wu et al, 1995; Li et al., 1997; Fukuoka et al., 1998, 2005; Kubo e Yoshimura, 2002, 2005; Matsubara et al., 2007a,b, 2015; Yamamoto et al., 2007; Ichitani et al., 2012; para cruzes interespecíficas; Sobrizal et al., 2001; Miura et al., 2008 para cruzes interespecíficas) (Tabela 1). A maioria desses casos de HB foi causada por incompatibilidade de dois loci BDM e alelos recessivos, sendo que 1/16 da progênie F2 que era homozigoto para alelos recessivos em ambos os loci mostraram o fenótipo HB; entretanto, 4/16 da progênie que era heterozigoto em apenas um locus mostrou o fenótipo HB, dependendo da combinação cruzada (Tabela 1 e Figura 1A). Nos híbridos cruzados, um locus já estava fixado com os alelos do pai recorrente; portanto, 1/4 da progênie BCnF2 exibia o fenótipo HB (Tabela 1 e Figura 1B).

Tabela 1. Base genética da decomposição híbrida relatada nas cruzes de arroz.
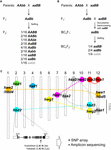
Figura 1. A base genética da decomposição híbrida (HB). (A) Representação esquemática do genótipo HB que segrega na descendência F2. Quando os genótipos parentais são AAbb e aaBB, 1/16 da descendência F2 sem alelo dominante, o que é indicado pelo carácter cinzento (ou seja, aabb), apresentam viabilidade reduzida e/ou fertilidade, embora os outros genótipos sejam normais. Em alguns cruzamentos de arroz, a progênie F2 com apenas um alelo dominante (ou seja, Aabb, aaBb) também apresentam viabilidade reduzida e/ou fertilidade. (B) Representação esquemática do genótipo HB que segrega na descendência BCnF2. Além disso, 1/4 da descendência BCnF2 mostra redução da viabilidade e/ou fertilidade. (C) Localização cromossômica dos genes subjacentes ao HB em cruzamentos de arroz. Os genes são mapeados aproximadamente com base nos resultados do mapeamento gênico em cada estudo. Um conjunto de genes complementares está ligado pela linha pontilhada. Os genes complementares com hbd1 e hwf1 não foram relatados. O exemplo do polimorfismo funcional do nucleotídeo causador do HB publicado por Yamamoto et al. (2010) é mostrado, e esta informação nos permitirá conduzir um levantamento por array SNP ou sequenciamento amplicon.
O fenótipo HB em híbridos de arroz varia de acordo com a combinação cruzada. Por exemplo, o genótipo hbd2/hbd2 hbd3/hbd3 mostra fraqueza, mas nenhuma esterilidade óbvia da semente. Contudo, o genótipo hbd4/hbd4 hbd5/hbd5 apresenta tanto fraqueza como esterilidade da semente (Matsubara et al., 2007a, 2015; Yamamoto et al., 2007; Tabela 1). Há também casos complicados nos quais o HB mostrando tanto fraqueza quanto esterilidade da semente são observados (hwe1/hwe1 hwe2/hwe2 genótipo) ou o HB mostrando apenas esterilidade da semente (hsa1/hsa1 hsa2/hsa2 hsa3/hsa3), apesar da mesma combinação de cruzamentos, ou seja, cruzamento Asominori × IR24 (Kubo e Yoshimura, 2002, 2005; Tabela 1). Como estes HBs têm bases genéticas independentes, pelo menos 5/64 da progênie F2 mostrariam o fenótipo HB neste cruzamento.
Até a data, vários conjuntos de loci responsáveis pelo HB foram mapeados para regiões genômicas particulares usando marcadores de DNA em cruzamentos entre as variedades de arroz japonica e indica (Chrs 7 e 10, Fukuoka et al, 1998; Chrs 1 e 12, Wu et al., 1995; Kubo e Yoshimura, 2002; Matsubara et al., 2015; Chrs 6 e 11, Fukuoka et al., 2005; Chrs 8, 9 e 12, Kubo e Yoshimura, 2005; Chrs 2 e 11, Matsubara et al., 2007a; Yamamoto et al., 2007, 2010; Chrs 11 e 12, Ichitani et al., 2012; Tabela 1 e Figura 1C). Os resultados desses estudos revelaram que os loci subjacentes ao HB do arroz são compartilhados em algumas cruzes, mas diferem em outras cruzes, o que sugere sua diversificação nos genomas do arroz. Por exemplo, em alguns casos, o alelo HB carregado por O. nivara, uma espécie intimamente relacionada às variedades de incica, compartilha o mesmo locus com uma variedade indica; entretanto, o alelo HB carregado por O. glumaepatula, uma espécie intimamente relacionada às variedades cultivadas, não compartilha o locus com nenhuma outra variedade (Tabela 1 e Figura 1C). Deve-se notar que os casos de HB descritos acima são causados por um conjunto de genes com efeitos maiores; entretanto, há também casos causados por um conjunto de genes com efeitos menores, por exemplo, fertilidade da semente ligeiramente reduzida, que não pode ser negligenciada no cultivo de arroz, que ainda não foram detectados.
Mecanismos moleculares subjacentes à decomposição híbrida
Resposta auto-imune: Bomblies et al. (2007) relataram primeiro que a resposta auto-imune que um gene NB-LRR de resistência à doença ou gene R está associado ao HB da Arabidopsis em cruzamentos intra-específicos, embora esta resposta auto-imune seja expressa principalmente como necrose nas plantas F1, e o HB na prole F2 pareceu estar condicionado pela temperatura. Em híbridos de Arabidopsis, várias linhas de evidência de HB causada pela resposta auto-imune foram descritas (Alcázar et al., 2009, 2010). O envolvimento dos genes NB-LRR no HB sugere que múltiplas regiões genômicas podem ser associadas com o HB da Arabidopsis; de fato, a extensa pesquisa realizada por Chae et al. (2014) apóia esta idéia.
Também em híbridos de arroz, o HB causado por uma resposta auto-imune foi relatado em uma cruz japonica × indica (Yamamoto et al., 2010). Neste caso, o HB ocorre em plantas F2 quando o gene de decomposição híbrido 2 (hbd2), que codifica a caseína quinase I e é carregada pela variedade indica, é combinado com um cluster de genes R carregados pela variedade japonica. Como esses alelos causadores provavelmente se comportam como parcialmente recessivos, os produtos gênicos podem estar envolvidos (Matsubara et al., 2007a; Yamamoto et al., 2007, 2010).
Silenciamento recíproco de genes duplicados: essa noção foi proposta teoricamente pela primeira vez como base genética para incompatibilidade de híbridos (Werth e Windham, 1991; Lynch e Force, 2000). No modelo, uma população perde função em um locus e a retém no outro, enquanto a outra população experimenta o efeito oposto. Consequentemente, 1/16 dos zigotos F2 não têm genes funcionais (Lynch and Force, 2000). O HB em híbridos de Arabidopsis descritos por Bikard et al. (2009) e Vlad et al. (2010) é um bom exemplo deste fenômeno. Neste cenário, casos envolvendo silenciamento epigenético também foram relatados (Agorio et al., 2017; Blevins et al., 2017).
Como o arroz tem experimentado duplicação tanto do genoma inteiro quanto do segmento (Wang et al., 2007; Guo et al., 2019), o silenciamento recíproco poderia ser prevalecente como causa de incompatibilidade de híbridos. Entretanto, até o momento, não há evidências de HB causado pelo silenciamento recíproco de genes duplicados no arroz.
Independente da resposta auto-imune e do silenciamento recíproco, foi identificada uma interação entre um helicóptero RNA DEAD-box 18 e outro gene (MORPHEUS MOLECULE 1 como provável candidato) que causa HB em híbridos de Arabidopsis (Plötner et al., 2017; Vaid et al., 2020). Curiosamente, o fenótipo HB reduz entre as gerações F3 e F4, implicando na regulação epigenética da expressão gênica.
Em híbridos de arroz, entre os três híbridos de esterilidade – a (hsa) loci, Kubo et al. (2016) mostraram recentemente que o locus hsa1 consiste em dois genes, e que estes genes codificam uma proteína DUF1618 e uma proteína não-caracterizada com alguma semelhança com uma proteína de ligação a nucleotídeos, respectivamente. As características moleculares dos demais genes complementares, hsa2 e hsa3, não foram relatadas.
Divisão híbrida no cultivo convencional de arroz
Durante décadas, o método de cultivo de arroz a granel foi amplamente empregado no cultivo convencional de arroz. Neste método, após o cruzamento, a população F4 ou F5 é criada por auto-fertilização a granel (e não pelo método de descendência de semente única) sem seleção artificial, mas a população das primeiras gerações é submetida à seleção natural e de viabilidade (Allard, 1960; Ikehashi e Fujimaki, 1980 para detalhes). No método de população a granel, muitos genótipos fracos e/ou estéreis podem ser eliminados da população antes do estabelecimento de uma população de geração avançada; portanto, este método pode fornecer informações limitadas sobre o HB.
Para a introgressão ou acumulação de características desejáveis do(s) doador(es) a uma variedade, os cultivadores de arroz têm frequentemente realizado retrocruzamentos ou múltiplos cruzamentos parentais, seguidos pelo método de população a granel. Empiricamente, há muito se sabe que esses métodos de cruzamento permitem a mitigação da perda de candidatos à seleção por barreiras reprodutivas, pois esses métodos frequentemente reduzem a segregação de combinações disruptivas de alelos associados ao HB em uma progênie híbrida. Entretanto, a mitigação das barreiras reprodutivas por esses métodos de cruzamento depende inevitavelmente do genótipo HB dos progenitores.
Divisão Híbrida na Reprodução Genômica Assistida
A publicação de seqüências genômicas de culturas de referência e o desenvolvimento de tecnologias de seqüenciamento de próxima geração aceleraram o progresso da reprodução molecular das culturas (Kole et al., 2015). Neste contexto, o melhoramento genômico assistido, como a seleção genômica baseada em genótipos de marcadores de DNA em todo o genoma, tem sido considerado no melhoramento vegetal (Spindel e Iwata, 2018).
No melhoramento genômico assistido de cultivos auto-polinizados, populações de geração avançada, como linhas consangüíneas recombinantes, são freqüentemente usadas como populações de referência, das quais são obtidos dados genotípicos e fenotípicos em todo o genoma. Subsequentemente, a selecção baseada apenas em genótipos marcadores é efectuada na descendência das primeiras gerações (por exemplo, F2). Neste esquema de seleção, deve-se observar que a população de referência não costuma fornecer a informação da região genômica do HB, porque a progênie fraca e/ou estéril deveria ter sido eliminada nas primeiras gerações após o cruzamento. Portanto, se tal esquema de seleção for adotado, teremos que abandonar alguns candidatos importantes para a seleção. Alternativamente, podemos selecionar candidatos indesejáveis, de modo que o HB se torne aparente em gerações posteriores.
Discussão
Embora o número limitado de estudos sobre este assunto, parece que os loci subjacentes ao HB em cruzamentos de arroz são diversificados ao invés de compartilhados (Tabela 1 e Figura 1). Como descrito acima, a informação sobre a distribuição dos alelos associados ao HB entre pais cruzados deve ser um pré-requisito para a criação de arroz, particularmente para maximizar a eficácia da criação assistida por genoma. Portanto, a detecção adicional de HB nos cruzamentos de arroz e o mapeamento dos genes responsáveis no genoma do arroz são necessários. Em híbridos de Arabidopsis, tais dados sobre os genes R e seus genes interativos foram extensivamente pesquisados (Alcázar et al., 2010, 2014; Chae et al., 2014). O relato do gene hbd2 por Yamamoto et al. (2010) em um híbrido de arroz é um bom exemplo de uma extensa pesquisa realizada usando matrizes SNP ou sequenciamento de amplicon (Figura 1C). Os genes hbd3 e hsa1 também são candidatos para este tipo de pesquisa. Eventualmente, o desenvolvimento de critérios que nos permitam prever o HB com base na informação genómica das linhas parentais servirá como uma ferramenta importante para a reprodução assistida por genoma. Mesmo que um fator causal não tenha sido identificado como um único gene, marcadores estreitamente ligados, tais como polimorfismos de nucleotídeos únicos, serão eficazes para classificar os haplótipos associados ao HB, porque o desequilíbrio de ligação do arroz cultivado foi estimado em 100-200 kb, embora o das espécies selvagens (como o O. rufipogon) pode se estender por várias dezenas de kb (Mather et al., 2007; McNally et al., 2009; Huang et al., 2010). Esta informação permitirá o desenho de uma combinação cruzada mais eficiente e eficaz.
Análise de segregantes de alta densidade seguida por sequenciamento de próxima geração pode ser útil para o mapeamento dos loci associados ao HB, bem como para o mapeamento convencional de ligação (como a análise quantitativa de locus de traços), porque os segregantes do HB freqüentemente mostram características distintas (sobre traços como altura da planta, número de perfilhos e fertilidade) dos segregantes de crescimento normal em cada população cruzada. A aquisição de dados de imagem usando uma câmera digital e carregamento de drone também pode ter um papel importante na fenotipagem no laboratório e no campo de arroz. Esses esforços fornecerão informações valiosas não apenas para os produtores de arroz, mas também para os biólogos evolutivos.
Outras vezes, se um alelo associado ao HB for identificado, a ruptura gênica através de feixe de íons ou edição do genoma pode ajudar a superar o HB, como exemplificado pela esterilidade híbrida F1 no arroz (Koide et al., 2018; Xie et al, 2019).
Data Availability Statement
Todos os conjuntos de dados apresentados neste estudo estão incluídos no artigo/material complementar.
Author Contributions
O autor confirma ser o único contribuinte deste trabalho e o aprovou para publicação.
Conflito de interesses
Os autores declaram que a pesquisa foi realizada na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Confirmações
Eu gostaria de dedicar este trabalho à memória do Dr. Darshan Brar. Ele foi um eminente criador de arroz que introduziu vigorosamente genes úteis transportados por espécies selvagens em cultivares além das barreiras reprodutivas.
Allard, R. W. (1960). Princípios de Reprodução de Plantas. Nova York, NY: John Wily and Sons, Inc.
Google Scholar
Dobzhansky, T. (1970). Genetics of the Evolutionary Process (Genética do Processo Evolucionário). Nova York, NY: Columbia University Press.
Google Scholar
Grant, V. (1971). Espessura da planta. Nova York, NY: Columbia University Press.
Google Scholar
Ikehashi, H., e Fujimaki, H. (1980). “Modified bulk population method for rice breeding”, em Proceedings of the International Rice Research Conference on Innovative approaches to rice breeding, (Los Baños, PA: International Rice Research Institute), 163-182.
Google Scholar
Oka, H.-I. (1988). Origem do Arroz Cultivado. Tóquio: JSSP.
Google Scholar