Introdução: Definindo Termos
Dados mais antigos sobre taxonomia da Cannabis foram revistos anteriormente (Russo, 2007), que serão aqui resumidos e complementados. A Cannabis é um anual dióico da família Cannabaceae que tradicionalmente inclui lúpulo, Humulus spp. Alternativamente, a Cannabis também foi atribuída a Moraceae, Urticaceae, ou mesmo nas famílias Celtidaceae com base em mapas de locais de restrição de cloroplasto (Weigreffe et al., 1998), e sequências de genes do tapete de cloroplasto K (Song et al., 2001). Mais recentemente, as Cannabáceas integraram oito gêneros: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema e Parasponia, compreendendo 170 espécies ímpares (McPartland, 2018), um achado apoiado pela análise genética de quatro loci plastídeos (Yang et al., 2013). Pesquisas atuais sobre amostras de pólen fóssil associadas às associações ecológicas da Cannabis com espécies estepárias companheiras (Poaceae, Artemisia, Chenopodiaceae), e Humulus (lúpulo) com gêneros florestais (Alnus, Salix, Populus), estabeleceram que, embora a Cannabis pareça ter se originado no Planalto Tibetano há pelo menos 19,6 milhões de anos, ela também é indígena da Europa há pelo menos um milhão de anos (McPartland et al.., 2018), e refutaram a sabedoria convencional de que este “seguidor do campo” foi lá trazido pelo homem.
A própria designação da espécie de Cannabis está repleta de grande debate. Cannabis sativa, que significa “Cannabis cultivada”, foi assim denominada por Fuchs, entre outros, em 1542 (Fuchs, 1999), uma designação 211 anos antes da sistematização dos binómios botânicos Linnaeus em sua espécie Plantarum (Linnaeus, 1753). Lamarck sugeriu posteriormente a Cannabis indica, uma planta indiana mais diminuta e intoxicante da Índia, como uma espécie separada (Lamarck, 1783). A questão permaneceu sem solução nos séculos seguintes, com duas filosofias opostas. Ernest Small tem defendido o conceito de espécie única (Small and Cronquist, 1976). Os tratamentos politépicos da Cannabis também ganharam adeptos (Schultes et al., 1974; Anderson, 1980) com critérios morfológicos que sugerem a separação da Cannabis sativa L. Cannabis indica Lam. e Cannabis ruderalis Jan., um esquema apoiado pela quimiotaxonomia sistemática. A análise de componentes principais (PCA) de 157 adesões de Cannabis de todo o mundo avaliou frequências de allozyme a 17 genes loci sugerindo uma divisão (Hillig, 2005b). Os pools de genes “Sativa” de amostras de ruderais do leste europeu foram ligados a plantas de fibras e sementes de folhetos estreitos europeus e da Ásia Central, enquanto um agrupamento “indica” abrangeu plantas de sementes e fibras do Extremo Oriente e plantas de drogas com folhetos largos da maior parte do resto do mundo, juntamente com as adesões selvagens do subcontinente indiano. Pensava-se que as amostras à beira da estrada da Ásia Central (Cannabis ruderalis) representavam um terceiro grupo. Estudos de cromatografia gasosa (GC) e eletroforese de gel de amido também sugeriram a separação de espécies de sativa e indica (Hillig e Mahlberg, 2004).
Fatores agronômicos em 69 amostras sugeriram a inclusão de cânhamo oriental e plantas de droga em Cannabis indica (Hillig, 2005a), uma divisão apoiada por polimorfismos de comprimento de fragmentos (Datwyler e Weiblen, 2006).
Mais recentemente, o PCA pareceu apontar o conteúdo terpenóide como o mais convincente marcador quimiotaxonómico que distingue as espécies sativa putativa e indica (Elzinga et al, 2015). Da mesma forma, o PCA foi sentido para separar a droga Cannabis do cânhamo (Sawler et al., 2015). Um estudo recente demonstrou a demarcação da droga Cannabis das adesões de cânhamo através da genotipagem de 13 microsatélites loci através do genoma, não apenas genes que afectam a produção de canabinóides ou fibras (Dufresnes et al., 2017). O professor Giovanni Appendino relatou a presença do isômero estereoscópico cis-Δ9-THC somente nas adesões de cânhamo (Giovanni Appendino, comunicação pessoal). No entanto, estas distinções podem muito bem passar despercebidas dada a tendência actual de cruzar o cânhamo com cultivares de drogas para evitar restrições legislativas ao conteúdo de THC.
A controvérsia das espécies de Cannabis, Cannabis sativa vs. indica vs. afghanica, tem continuado até aos dias de hoje com argumentos apaixonados avançados pelos protagonistas (Clarke e Merlin, 2013, 2016; Small, 2015; McPartland e Guy, 2017; Small, 2017). Este autor, tendo estado em todos os lados da questão em um ou outro momento, optou por fugir ao irreconciliável debate taxonômico como uma distração desnecessária (Piomelli e Russo, 2016), e enfatiza que apenas as distinções bioquímicas e farmacológicas entre as adesões de Cannabis são relevantes. Na sua recente revisão seminal, McPartland concordou: “A classificação da Cannabis como ‘Sativa’ e ‘Indica’ tornou-se um exercício de futilidade”. A reprodução cruzada e a hibridação omnipresentes tornam a sua distinção sem sentido”. (McPartland, 2018) (p. 210).
Uma controvérsia adicional de nomenclatura não-sensical pertence, em linguagem comum, às “cepas” de Cannabis, uma denominação apropriada a bactérias e vírus, mas não a plantas (Bailey e Bailey, 1976; Usher, 1996; Brickell et al., 2009), especialmente com a Cannabis, onde a variedade química, abreviada “chemovar” é a denominação mais apropriada (Lewis et al, 2018).
O genoma da Cannabis e a produção bioquímica alternativa hospedeira
2011 foi um ano marcante para a genómica da Cannabis, pois a Medical Genomics e a Nimbus Informatics emitiram um relatório online sobre a sequência genómica completa de 400 milhões de pares de bases, a que se juntou em breve um esboço do genoma e transcriptoma (van Bakel et al., 2011).
Este desenvolvimento provocou publicidade proeminente e controvérsia sobre o que poderia retratar. Enquanto que o genoma humano foi analisado cerca de 20 anos antes, as implicações para a Cannabis estavam sujeitas a grandes especulações.
A notícia catalisou uma enxurrada de novas pesquisas, mas já tinha sido alcançado um progresso considerável na genética aplicada da Cannabis. A identificação e síntese do Δ9-tetrahidrocanabinol (THC) foi realizada em Israel 1964 (Gaoni e Mechoulam, 1964), mas só muito mais tarde foi possível clonar com sucesso a sua enzima biossintética, a tetrahidrocanabinol sintetizase (THCA synthase) (Sirikantaramas et al., 2004; Figura 1). Seguiu-se a cristalização enzimática (Shoyama et al., 2005). A canabidiolic acid synthase, que catalisa o ácido canabiólico (CBDA), precursor do canabidiol (CBD), havia sido previamente identificada e produzida na forma pura (Taura et al., 1996; Figura 1). Estes desenvolvimentos estimularam descobertas adicionais, incluindo a descoberta arqueológica fitoquímica da THCA synthase em uma cache de Cannabis de 2700 anos de idade de uma tumba na Ásia Central, juntamente com dois polimorfismos de nucleotídeos únicos (SNPs) previamente não relatados na sequência genética da enzima (Russo et al., 2008).
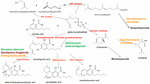
Figura 1. Caminhos biossintéticos e enzimas (vermelho) de Cannabis sativa, indicação das espécies naturais Helichrysum umbraculigerum, e espécies alternativas (em cor) que foram geneticamente modificadas para produzir produtos subsequentes .
Até 2011, as enzimas para a produção dos principais fitocanabinóides tinham sido identificadas. Da mesma forma, o cultivo seletivo avançado de Mendelian produziu variedades de Cannabis ricas em componentes únicos específicos. Assim, foram produzidas plantas com alto teor de THC e alto teor de CBC para o desenvolvimento farmacêutico (de Meijer et al., 2003; de Meijer, 2004), com cultivo análogo de linhas de canabigerol (CBG) (de Meijer e Hammond, 2005) e canabicromeno (CBC) (de Meijer et al., 2009a). A criação seletiva também se estendeu aos análogos de propil fitocanabinóides, tetrahidrocanabivarina (THCV), canabidivarina (CBDV), canabigerivarina (CBGV) e canabichromivarina (CBCV) (de Meijer, 2004). A disponibilidade de plantas com altos títulos destes “canabinóides menores” traz novas aplicações farmacêuticas interessantes (Russo, 2011; Russo e Marcu, 2017).
Acesso ao genoma Cannabis pode simplificar a produção de plantas THC-knockout através da tecnologia CRISPR (agrupamento de repetições palíndromas curtas espaçadas regularmente). Embora isto possa ser atrativo para o cultivo industrial de cânhamo, uma geração anterior de cultivo de plantas já produziu cultivares de cânhamo que facilmente cumprem as restrições internacionais que requerem 0,1% ou menos de teor de THC (Wirtshafter, 1997; McPartland et al., 2000; Small and Marcus, 2003). De facto, a Cannabis sem canabinóides e sem canabigerolic acid synthase funcional (Figura 1) também tem sido produzida convencionalmente (de Meijer et al., 2009b). Assim, ainda não está claro se a engenharia genética da Cannabis é mesmo necessária para esta planta cuja incrível plasticidade já apresenta uma diversidade bioquímica abundante. A introdução de organismos geneticamente modificados (OGM) A Cannabis suscitaria considerável controvérsia entre certos segmentos da população, e provavelmente provocaria uma enxurrada de envolvimentos legais sobre os direitos de patente e reprodução.
Um pode facilmente imaginar uma variedade de cenários adicionais de ficção científica. Nos anos 90, um embuste da Internet espalhou o rumor de que um professor apócrifo Nanofsky tinha introduzido genes para a produção de THC em laranjas (Citrus x. sinensis (L.) Osbeck). Embora isto pudesse ser tecnologicamente realizável, tal esforço não seria mais do que um acto carnavalesco de laboratório à luz da prodigiosa produção de canabinóides a partir da própria Cannabis. Um chemovar furtivo de hortelã-pimenta (Menthax piperita Lamiaceae) com fitocanabinóides ilícitos nos tricomas glandulares das suas folhas poderia ser a escolha mais lógica para tais devaneios subversivos subterrâneos e enviar rizomas e corredores ao longo de cursos de água em todo o mundo.
Reivindicações principais de produção de canabidiol do lúpulo (Humulus lupulus L. Cannabaceae) e linho (Linum usitatissimum L. Linaceae) são infundadas, mas o ácido canabigerólico e o canabigerol foram detectados no Helichrysum umbraculigerum Less da África do Sul. Asteraceae (Bohlmann e Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; Figura 1), mas sem referência à sua concentração. Esta alegação foi confirmada recentemente com quantidades de traços observados de amostras secas de peças aéreas (Mark Lewis, comunicação pessoal).
Porque a complexidade da síntese bioquímica puramente de novo dos canabinóides tem sido considerada não eficaz em termos de custo (Carvalho et al., 2017), foram sugeridos hospedeiros microbianos alternativos (Zirpel et al., 2017). Em 2004, a clonagem de cDNA de THCA synthase foi alcançada, permitindo a conversão de ácido canabigerólico (CBGA) para THC (Sirikantaramas et al., 2004), e uma produção de 8% de THCA em raízes peludas de tabaco (Nicotiana tabacum cv.Xanthi Solanaceae) foi demonstrada na alimentação de CBGA (Figura 1). A enzima também foi expressa no inseto Spodoptera frugiperda (J.E. Smith) Noctuidae (minhoca do exército de queda) através de um baculovírus recombinante. Posteriormente, este grupo de pesquisa voltou-se para as leveduras, Pichia pastoris (agora Komagataella phaffii Phaff Saccharomycetaceae) (Taura et al., 2007; Figura 1), e alcançou uma conversão de CBGA para THCA de 98% em 24 h, com rendimento de 32,6 mg/L de meio. Uma forma recombinante de THCA synthase provou ser 4,5X mais eficiente que em Cannabis e 12X que em S. frugiperda. Este processo foi posteriormente optimizado com uma melhoria de actividade de 64,5 vezes (Zirpel et al., 2018), com uma produção reportada em K. phaffii de 3,05 g/L de THCA após 8 h de incubação a 37°C. Um cálculo simples prevê que este rendimento também poderia ser alcançado a partir da extracção de apenas 15 g de 20% de THCA canábis de ervas.
A produção de terpenóides de canábis é similarmente possível em hospedeiros alternativos. Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae mutantes deficientes na enzima farnesyl diphosphate synthase acumulam geranyl pyrophosphate, que é desviado para a produção de terpenóides medicamente úteis, linalool (Oswald et al., 2007; Figura 1). Da mesma forma, outros pesquisadores têm aproveitado as capacidades biossintéticas das mitocôndrias em S. cerevisiae para aumentar a produção de farnesil difosfato de sesquiterpenoides (Farhi et al., 2011), embora não sejam comuns à Cannabis.
No momento, as sequências genómicas existentes da Cannabis não estão totalmente anotadas. Consequentemente, será necessário o conhecimento prévio aplicado e o trabalho de detective para adquirir dados práticos sobre a função genética da Cannabis. O maior potencial em tal investigação residirá no domínio da epigenética, subjacente às alterações hereditárias na expressão genética ou fenótipo da planta. A deficiência mais saliente é a falta de conhecimento sobre a regulação da produção de canabinóides. A compreensão das vias biossintéticas e da regulação das síntases terpenóides que produzem os terpenóides da Cannabis mal foi iniciada (Booth et al., 2017) e continua sendo alvo de pesquisas adicionais (Russo, 2011).
Um problema adicional na criação de Cannabis continua sendo a falta de exemplares de cupons (que são proibidos pela Administração de Drogas dos EUA sem licença Schedule I) e depósitos formais de adesões de quimiovares em repositórios de sementes e tecidos. Este último foi realizado pela GW Pharmaceuticals, e independentemente pela NaPro Research (Lewis et al., 2018) na National Collection of Industrial, Food and Marine Bacteria (NCIMB) na Escócia. Muitas empresas privadas evitaram compartilhar o germoplasma devido a restrições legais e ao medo de perda de propriedade intelectual.
Cannabis Synergy
Em 1998, os Professores Raphael Mechoulam e Shimon Ben-Shabat afirmaram que o sistema endocannabinoide demonstrou um “efeito entourage” no qual uma variedade de metabólitos “inativos” e moléculas intimamente relacionadas aumentaram acentuadamente a atividade dos canabinóides endógenos primários, anandamida e 2-arachidonoylglycerol (Ben-Shabat et al, 1998). Eles também postularam que isto ajudou a explicar como as drogas botânicas eram frequentemente mais eficazes do que seus componentes isolados (Mechoulam e Ben-Shabat, 1999). Embora a síntese de uma única molécula continue sendo o modelo dominante para o desenvolvimento farmacêutico (Bonn-Miller et al, 2018), o conceito de sinergia botânica tem sido amplamente demonstrado contemporaneamente, invocando as contribuições farmacológicas dos “canabinóides menores” e terpenóides de Cannabis para o efeito farmacológico global da planta (McPartland e Pruitt, 1999; McPartland e Mediavilla, 2001; McPartland e Russo, 2001, 2014; Russo e McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). Vários exemplos pertinentes do efeito de comitiva na Cannabis são ilustrativos:
Num ensaio aleatório controlado de extractos oromucosais à base de Cannabis em pacientes com dor intratável apesar do tratamento optimizado com opióides, um extracto predominante de THC não conseguiu demarcar-se favoravelmente do placebo, enquanto um extracto de planta inteira (nabiximols, vide infra) com THC e canabidiol (CBD) se mostrou estatisticamente melhor do que ambos (Johnson et al, 2010), sendo a única diferença saliente a presença de CDB neste último.
Em estudos animais de analgesia, a CDB pura produz uma curva dose-resposta bifásica de tal forma que doses menores reduzem a resposta à dor até que um pico seja atingido, após o que novos aumentos na dose são ineficazes. Curiosamente, a aplicação de um extrato de canábis de espectro completo com doses equivalentes de CDB elimina a resposta bifásica em favor de uma curva dose-resposta linear, de modo que o extrato botânico é analgésico em qualquer dose sem nenhum efeito teto observado (Gallily et al.., 2014).
Um estudo recente de várias linhas de células humanas do câncer de mama em cultura e tumores implantados demonstrou a superioridade de um tratamento com extrato de Cannabis ao THC puro, aparentemente atribuível no primeiro à presença de pequenas concentrações de canabigerol (CBG) e ácido tetrahidrocanabinólico (THCA) (Blasco-Benito et al.., 2018).
Os efeitos anticonvulsivos do canabidiol foram notados em animais nos anos 70 com os primeiros ensaios em humanos em 1980 (Cunha et al., 1980). Uma experiência recente em ratos com convulsões induzidas por pentilenotetrazol empregou cinco extratos diferentes de Cannabis com concentrações iguais de CDB (Berman et al., 2018). Embora todos os extratos tenham mostrado benefícios em relação aos controles não tratados, foram observadas diferenças salientes nos perfis bioquímicos dos canabinóides não-CBD, o que, por sua vez, levou a diferenças significativas no número de ratos que desenvolveram convulsões tônico-clônicas (21,5-66,7%) e nas taxas de sobrevivência (85-100%), destacando a relevância desses componentes “menores”. Este estudo destaca a necessidade de padronização no desenvolvimento farmacêutico e, embora possa ser interpretado para apoiar o modelo terapêutico de molécula única (Bonn-Miller et al., 2018), requer ênfase que os botânicos complexos possam atender aos padrões da FDA americana (Food and Drug Administration, 2015). Especificamente, duas drogas baseadas na Cannabis obtiveram aprovação regulatória, Sativex®(nabiximols, US Adopted Name) em 30 países, e Epidiolex® nos Estados Unidos.
A questão surge então: Pode uma preparação de Cannabis ou uma única molécula ser demasiado pura, reduzindo assim o potencial sinérgico? Os dados recentes apoiam isto como uma possibilidade distinta. Informações anedóticas de clínicos que utilizam extratos de Cannabis com alto teor de CBD para tratar epilepsia grave, como as síndromes de Dravet e Lennox-Gastaut, mostraram que seus pacientes demonstraram notável melhora na freqüência de convulsões (Goldstein, 2016; Russo, 2017; Sulak et al., 2017) com doses muito inferiores às relatadas em ensaios clínicos formais de Epidiolex, uma preparação de 97% de CBD pura com THC removido (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Esta observação foi recentemente submetida à meta-análise de 11 estudos com 670 pacientes no agregado (Pamplona et al., 2018). Esses resultados mostraram que 71% dos pacientes melhoraram com extratos de Cannabis predominante na CDB contra 36% na CDB purificada (p < 0,0001). A taxa de resposta a 50% de melhora na freqüência de convulsões não foi estatisticamente diferente nos dois grupos e ambos os grupos alcançaram status livre de convulsões em cerca de 10% dos pacientes. Entretanto, as doses médias diárias foram marcadamente divergentes nos grupos: 27,1 mg/kg/d para CBD purificada vs. apenas 6,1 mg/kg/d. para extratos de Cannabis ricos em CBD, uma dose apenas 22,5% daquela para CBD sozinha. Além disso, a incidência de eventos adversos leves e graves foi comprovadamente maior em pacientes com CDB purificada versus extracto de CDB elevado (p < 0,0001), resultado que os autores atribuíram à menor dose utilizada, o que foi alcançado, em sua opinião, pelas contribuições sinérgicas de outros compostos de entourage. Tais observações sustentam a hipótese de maior eficácia para extratos de Cannabis combinando múltiplos componentes anticonvulsivos, como CDB, THC, THCA, THCV, CBDV, linalol e até mesmo cariofileno (Lewis et al, 2018).
Estes estudos e outros fornecem uma base firme para a sinergia da Cannabis, e apoio ao desenvolvimento de drogas botânicas vs. a de componentes únicos (Bonn-Miller et al., 2018), ou produção através de métodos de fermentação em leveduras ou outros microrganismos. Um exemplo do poder do cultivo seletivo convencional é ilustrado (Figura 2), na forma de um quimovar de Cannabis chamado CaryodiolTM pelo seu conteúdo aumentado de cariofileno (0,83%) como agonista CB2, juntamente com uma relação THC:CBD tipo III altamente favorável de 1:39.4. Tal preparação é aplicável ao tratamento de numerosas condições clínicas, incluindo: dor, inflamação, distúrbios fibróticos, dependência, ansiedade, depressão, doenças auto-imunes, condições dermatológicas e câncer (Pacher e Mechoulam, 2011; Russo, 2011; Xi et al., 2011; Russo e Marcu, 2017; Lewis et al., 2018). Produzir tal combinação a partir de fontes microbianas pode requerer combinações de canabinóides de várias espécies de leveduras e, como resultado, representaria um produto combinado sujeito a um caminho regulatório difícil em comparação com as preparações de Cannabis a partir de extratos de uma única espécie (por exemplo, nabiximols) que foi aceita como uma formulação unitária em 30 países em todo o mundo (Food and Drug Administration, 2015).
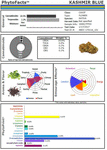
Figure 2. PhytoFactsTM retrato do conteúdo de canabinóides e terpenóides de CaryodiolTM, também conhecido como “Kashmir Blue”, um tipo III, canabidiol-, e caryophyllene-predominante chemovar. Veja (Lewis et al., 2018) para detalhes sobre PhytoFacts e metodologia de criação convencional. Copyright© 2016 BHC Group, LLC. Todos os direitos reservados. Qualquer uso não autorizado deste documento ou das imagens ou marcas acima pode violar direitos autorais, marcas registradas e outras leis aplicáveis.
Este artigo delineou brevemente as recentes tentativas tecnológicas de “reinventar a roda dos fitocanabinóides”. Os argumentos da Cogent apoiariam que isso pode ser feito, mas deveria ser feito? Os dados que apoiam a existência da sinergia da Cannabis e a espantosa plasticidade do genoma da Cannabis sugerem uma realidade que evita a necessidade de hospedeiros alternativos, ou mesmo a engenharia genética da Cannabis sativa, provando assim que, “A planta faz melhor”.”
Author Contributions
The author confirms being the sole contributor of this work and has approved it for publication.
Conflict of Interest Statement
I am Director of Research for the International Cannabis and Cannabinoids Institute. Atendemos clientes envolvidos no comércio de cannabis.
Confirmações
A autora apreciou a assistência da equipe da Biblioteca Interbibliotecária da Universidade de Montana para o fornecimento de materiais de pesquisa.
Anderson, L. C. (1980). Variação de folhas entre espécies de Cannabis a partir de um jardim controlado. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: o gigante adormecido da medicina mediterrânica à base de ervas. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., e Bailey, E. Z. (1976). Hortus Third: A Concise Dictionary of Plants Cultivated in the United States and Canada. Nova York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). Um efeito de comitiva: ésteres inativos de glicerol de ácido graxo endógeno aumentam a atividade canabinoide de 2-arachidonoyl-glicerol. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). Uma nova abordagem ESI-LC/MS para um perfil metabólico abrangente dos fitocanabinóides da Cannabis. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Avaliando o “efeito entourage”: ação antitumoral de um canabinóide puro versus uma preparação de droga botânica em modelos pré-clínicos de câncer de mama. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., e Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., e Vandrey, R. (2018). Cannabis e desenvolvimento de drogas canabinoides: avaliação de abordagens botânicas versus moleculares únicas. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., e Bohlmann, J. (2017). Sínteses terpénicas de Cannabis sativa. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). Código Internacional de Nomenclatura de Plantas Cultivadas. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., e Stehle, F. (2017). Projetando microorganismos para biossíntese heteróloga de canabinóides. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., e Merlin, M. D. (2013). Canábis: Evolução e Etnobotânica. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., e Merlin, M. D. (2016). domesticação da Cannabis, história da reprodução, diversidade genética atual e perspectivas futuras. Critérios. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Administração crônica de canabidiol a voluntários saudáveis e pacientes epilépticos. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., e Weiblen, G. D. (2006). Variação genética do cânhamo e da marijuana (Cannabis sativa L.) de acordo com polimorfismos amplificados de comprimento de fragmento. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). “The breeding of cannabis cultivars for pharmaceutical end uses”, in Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, e P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P, Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M., e Hammond, K. M. (2005). A herança do fenótipo químico em Cannabis sativa L. (II): plantas predominantes de Canabigerol. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., e Micheler, M. (2009a). A herança do fenótipo químico em Cannabis sativa L. (III): variação na proporção de canabicromeno. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., e Sutton, A. (2009b). A herança do fenótipo químico em Cannabis sativa L. (IV): plantas livres de canabinóides. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Ensaio de canabidiol para convulsões resistentes a drogas na síndrome de dravet. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol em pacientes com epilepsia resistente ao tratamento: um estudo intervencionista de marca aberta. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Ensaio de segurança randomizado e dose-ranging de canabidiol na síndrome de Dravet. Neurology 90, e1204-e1211. doi: 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J., e Fumagalli, L. (2017). Diversidade genética em larga escala da Cannabis para aplicações forenses. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R., and Raber, J. C. (2015). Cannabinoides e terpenos como marcadores quimiotaxonómicos na cannabis. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Aproveitamento dos compartimentos subcelulares de leveduras para a produção de terpenóides vegetais. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Botanical Drug Development Guidance for Industry, ed. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). The Great Herbal of Leonhart Fuchs: De Historia Stirpium Commentarii Insignes, 1542 (Notable Commentaries on the History of Plants). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., e Hanus, L. (2014). Superando a resposta em forma de sino do canabidiol usando extrato de canábis enriquecido em canabidiol. Farmacol. Farmacol. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., e Mechoulam, R. (1964). Isolamento, estrutura e síntese parcial de um constituinte ativo de haxixe. J. Am. Química. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Canábis no Tratamento da Epilepsia Pediátrica. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). Uma análise combinada de características agronómicas e frequências de alelos allozyme para 69 adesões de Cannabis. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Evidência genética para a especiação em Cannabis (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., e Mahlberg, P. G. (2004). Uma análise quimiotaxonômica da variação dos canabinóides da Cannabis (Cannabaceae). Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., and Fallon, M. T. (2010). Estudo multicêntrico, duplo-cego, randomizado, controlado por placebo, em grupo paralelo, da eficácia, segurança e tolerabilidade do extrato de THC:CBD e extrato de THC em pacientes com dor intratável relacionada ao câncer. J. Gestão dos Sintomas de Dor. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., e Smith, K. M. (2018). Fundamentos farmacológicos dos quimiovares de Cannabis. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Espécie Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., e Hegman, W. (2018). A Cannabis é indígena da Europa e o cultivo começou durante a era do cobre ou do bronze: uma síntese probabilística de estudos com pólen fóssil. Veg. His. Arqueobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). Sistematização da Cannabis a nível de família, gênero e espécie. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., e Watson, D. P. (2000). Hemopatias e Pragas: Manejo e Controle Biológico. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., e Guy, G. W. (2017). Modelos de taxonomia da cannabis, preconceitos culturais e conflitos entre nomes científicos e vernáculos. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., e Mediavilla, V. (2001). “Non-cannabinoids in cannabis”, em Cannabis and Cannabinoids, eds F. Grotenhermen e E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., e Pruitt, P. L. (1999). Efeitos secundários de fármacos que não são obtidos por medicamentos fitoterápicos comparáveis: o caso do tetrahidrocanabinol e da marijuana. Altern. Ther. Med. Saúde. 5, 57-62.
Google Scholar
McPartland, J. M., e Russo, E. B. (2001). Cannabis e extratos de canábis: maior que a soma de suas partes? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., e Russo, E. B. (2014). “Nonphytocannabinoid constituents of cannabis and herbal synergy”, in Handbook of Cannabis, ed. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., e Ben-Shabat, S. (1999). From gan-zi-gun-nu to anandamide and 2-arachidonoylglycerol: the ongoing story of cannabis. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N., and Karst, F. (2007). Monoterpenoid biossíntese em Saccharomyces cerevisiae. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., e Mechoulam, R. (2011). A sinalização lipídica através dos receptores canabinoides 2 faz parte de um sistema de proteção? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., e Coan, A. C. (2018). Potenciais benefícios clínicos dos extratos de Cannabis ricos em CDB sobre a CDB purificada na epilepsia resistente ao tratamento: meta-análise de dados observacionais. Frente. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., e Russo, E. B. (2016). O debate Cannabis sativa versus Cannabis indica: uma entrevista com Ethan Russo, MD. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). História da cannabis e suas preparações em saga, ciência e sobriquet. Quimioterapia. Biodiversidade. 4, 1614-1648. doi: 10.1002/cbdv.200790144
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2011). Taming THC: potencial sinergia de canábis e efeitos de entourage fitocanabinóides-terpenóides. Br. J. Farmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). Além da Canábis: plantas e o sistema endocannabinoide. Tendências Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Canábis e epilepsia: um tratamento antigo volta à tona. Comportamento da epilepsia. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Análises fitoquímicas e genéticas de canábis antiga da Ásia Central. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., e Marcu, J. (2017). Farmacologia da Cannabis: os suspeitos habituais e algumas pistas promissoras. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., e McPartland, J. M. (2003). Cannabis é mais do que simplesmente Delta(9)-tetrahydrocannabinol. Psicofarmacologia 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). A estrutura genética da maconha e do cânhamo. PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., and Lockwood, T. (1974). Cannabis: um exemplo de negligência taxonómica. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Cristalização do ácido Delta1-tetrahidrocanabinólico (THCA) sintetase de Cannabis sativa. Acta Crystallogr. Sect. F Estrutura. Biol. Cristalogr. Comun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). O gene que controla a psicoactividade da marijuana: clonagem molecular e expressão heteróloga da Delta1-tetrahidrocanabinólica sintetase da Cannabis sativa L. J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). Evolução e classificação da Cannabis sativa (maconha, cânhamo) em relação ao uso humano. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: Um Guia Completo. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., e Cronquist, A. (1976). Uma taxonomia prática e natural para a Cannabis. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., e Marcus, D. (2003). Níveis de Tetrahydrocannabinol em recursos de germoplasma de cânhamo (Cannabis sativa). Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., e Hong, D.-Y. (2001). Furnter evidência para a parafisia dos Celtidaceae do tapete genético de cloroplastos K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., e Goldstein, B. (2017). O estado atual da cannabis artesanal para o tratamento da epilepsia nos Estados Unidos. O comportamento da epilepsia. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., e Morimoto, S. (2007). Produção de ácido Delta(1)-tetrahidrocanabinólico pela enzima biossintética segregada da Pichia pastoris transgênica. Biochem. Biofísicos. Res. Comun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., e Shoyama, Y. (1996). Purificação e caracterização da canabidiolic-acid synthase de Cannabis sativa L. Análise bioquímica de uma nova enzima que catalisa a oxidociclização do ácido canabigerólico ao ácido canabiólico. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol em pacientes com convulsões associadas à síndrome de Lennox-Gastaut (GWPCARE4): um ensaio aleatório, duplo-cego e controlado por placebo de fase 3. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). The Wordsmith Dictionary of Botany (O Dicionário de Botânica das Palavras). Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). O esboço do genoma e transcriptoma de Cannabis sativa. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., and Guries, R. P. (1998). The Ulmaceae, uma ou duas famílias? Evidências do mapeamento do local de restrição de ADN cloroplástico. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Cannabis medicinal: o delta9-tetrahydrocannabinol é necessário para todos os seus efeitos? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). “Nutritional value of hemp seed and hemp seed oil”, em Cannabis in Medical Practice, ed. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Os receptores CB(2) do canabinóide cerebral modulam as ações da cocaína em camundongos. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z., e Yi, T.-S. (2013). Filogenética molecular e evolução de caráter de Cannabaceae. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., e Stehle, F. (2017). Leveduras de engenharia como organismos de plataforma para biossíntese de canabinóides. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Otimização da produção de ácido sintetase Delta(9)-tetrahidrocanabinólico em Komagataella phaffii via identificação de gargalo pós-tradução. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text