- Introduction
- Materiais e Métodos
- Participantes
- Ressonância Magnética
- Aquisição e Processamento de Dados
- Extracção do Atlas
- Análise estatística
- Resultados
- Patientes com SCA3 Revelaram Lesões Significativas em Regiões de Lesões Infratentoriais Típicas
- Patientes com SCA3 Lesão Revelada do Supratentorial Cerebral Lateralizado
- Discussão
- Conclusões
- Data Availability Statement
- Ethics Statement
- Author Contributions
- Funding
- Conflito de interesses
- Agradecimentos
- Material Suplementar
Introduction
Ataxia Espinocerebelar tipo 3 (SCA3) é um distúrbio neurodegenerativo hereditário causado pela expansão CAG na região codificadora do cromossoma 14q32.1 (1, 2). Clinicamente, pacientes com SCA3 apresentam síndrome cerebelar, Parkinson, marcha ataxical, disartria, dismetria, nistagmo, neuropatia periférica, manifestações piramidais e extrapiramidais (3-5). Os pacientes com SCA3 também sofriam de deficiências emocionais, tais como depressão e ansiedade (6, 7). Essas disfunções de ordem mais elevada do SCA3 sugerem o envolvimento adicional de estruturas extracerebelares em vez do padrão convencional de neurodegeneração “olivopontocerebelar” (8-12). Além disso, o distúrbio SCA3 tem sido descrito como síndrome cognitiva afetiva cerebelar (CCAS) (6, 8).
Estudos têm usado tomografia por emissão de pósitrons (PET) e tomografia computadorizada por emissão de um fotão para identificar anormalidades subclínicas no córtex cerebral (13, 14). Entretanto, esses estudos relataram a interrupção da via cerebrocerebelar não consegue explicar completamente o comprometimento cognitivo e afetivo em pacientes com SCA3. Por exemplo, déficits visuosespaciais em pacientes com SCA3 estão marcadamente associados ao lobo parietal e estão menos ligados ao cerebelo. Poucos estudos têm focado o papel das regiões supratentoriais na SCA3. A quantificação da degeneração em regiões supratentoriais pode ser crucial para avaliar a disfunção em pacientes com SCA3. Em estudos de neuroimagem, medir a atrofia cortical regional é crucial para avaliar sua associação com comprometimento cognitivo e disfunção emocional.
Diffusion tensor imaging (DTI) pode facilitar a visualização e caracterização da matéria branca (WM), e DTI é também um método eficiente para o estudo de SCA3 (15). O SCA3 tinha sido verificado como uma doença neurodegenerativa de atrofia dominante em WM (16). Estudos anteriores mostraram que pacientes com SCA3 demonstram diminuição da anisotropia fracionária (FA) nas áreas de cerebelo e tronco encefálico, mas aumento da difusividade radial (RD) no cerebelo, tronco encefálico, tálamo e lobos frontal e temporal (17). Outro estudo do DTI identificou redução generalizada da FA bilateral cerebral-frontal, -parietal, -temporal e -occipital WM; do WM cerebelar; do tálamo; e do tronco encefálico em pacientes com SCA3 (16). Além disso, aumentos médios de difusividade (MD) foram detectados em um padrão semelhante, amplamente sobreposto, em pacientes com SCA3 (16) bilateral cerebral-frontal, -parietal, -temporal e -occipital WM; WM cerebelar; o tálamo; e o tronco encefálico (16).
Neste estudo, avaliamos a atrofia em regiões relativamente focais e explicamos o envolvimento supratentorial em SCA3. Este estudo utilizou o método da dimensão fractal (DF), que tem a vantagem de produzir resultados com variação mínima (18), para quantificar as alterações morfológicas corticais e medir a atrofia cortical regional das regiões supratentoriais. No presente estudo, medimos os valores 3D-FD dos 97 segmentos da matéria cinzenta de todo o cérebro para cada participante. Comparamos ainda os resultados dessas lesões de matéria cinzenta com a análise DTI das lesões de matéria branca no SCA3 do nosso recente estudo. Prevemos que as regiões de lesões GM avaliadas neste estudo estão relacionadas às regiões de lesões WM do estudo DTI, e o resultado pode verificar a associação entre o comprometimento motor e a atrofia das regiões supratentoriais em pacientes com SCA3.
Materiais e Métodos
Participantes
Um total de 48 pacientes com SCA3 e 50 indivíduos saudáveis, de acordo com o sexo e a idade, como grupo controle, participaram deste estudo. Este estudo foi realizado de acordo com a Declaração de Helsinque e foi aprovado pelo Comitê de Revisão Institucional do Hospital Geral de Veteranos de Taipei. Todos os participantes deram seu consentimento informado por escrito antes de participar deste estudo. Todos os participantes foram recrutados do Departamento de Radiologia do Hospital Geral de Veteranos de Taipé. A SARA (escala para avaliação e classificação de ataxia) foi aplicada para avaliação clínica de ataxia de pacientes com SCA3 (19). Os sintomas do progresso da doença de Parkinson em SCA3 foram medidos usando o estadiamento Modificado de Hoehn e Yahr (20). O escore SARA, que foi uma classificação da gravidade dos sintomas de ataxia variando de 0 a 40, foi usado como referência para indicar a progressão da gravidade clínica em comparação com a degeneração cerebelar. Uma idade de início auto-relatada, a idade em que os pacientes apresentaram o primeiro sinal de qualquer sintoma de ataxia, foi adquirida de cada paciente (21). O comprimento de repetição do GAC de cada paciente com SCA3 foi determinado pela reação em cadeia da polimerase, como descrito anteriormente (22). A Tabela 1 apresenta os dados demográficos, clínicos e de imagem de RM de ambos os grupos. Os pacientes com SCA3 preenchiam os critérios de inclusão se tivessem ataxia progressiva e inexplicada e testado positivo para o genótipo SCA3. A duração da doença em pacientes com SCA3 foi de 8,89 ± 6,432 anos. Aqueles do grupo controle não apresentavam doença do sistema nervoso central e não apresentavam anormalidades neurológicas durante o período do estudo. Um neurorradiologista experiente examinou as imagens ponderadas em T1 e T2 do grupo controle para assegurar a ausência de sinais descobertos de outra doença neurológica ou anormalidades inesperadas.
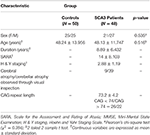
Tabela 1. Dados demográficos, clínicos e de imagens de RM do grupo controle e do grupo de pacientes.
Ressonância Magnética
Aquisição e Processamento de Dados
As imagens do cérebro humano de RM axial cobrindo todo o cérebro e cerebelo foram adquiridas usando um scanner 1.5-T Vision Siemens (Erlangen, Alemanha). Os participantes foram escaneados com uma bobina de cabeça circularmente polarizada para obter imagens ponderadas em T1 (TR = 14,4 ms; TE = 5,5 ms; tamanho da matriz: 256 × 256; fatias axiais de 1,5 mm; FOV = 256 × 256 mm2; tamanho do voxel, 1,0 × 1,0 × 1,5 mm3, número de fatia = 128). As imagens ponderadas em T1 adquiridas de cada participante foram reformatadas em uma imagem axial e convertidas para um formato de análise pelo software MRIcro (Chris Rorden, Universidade de Nottingham, Reino Unido; www.sph.sc.edu/comd/rorden/mricro.html). A Figura 1 ilustra o fluxograma de processamento de dados e análise estatística. Para melhorar a precisão da extração de tecido cerebral, uma função de arrancamento automático do crânio foi aplicada aos volumes de imagem usando a ferramenta de extração do cérebro no software de MRIcro (Figura 1B). Os processos subseqüentes foram realizados usando o DiffeoMap (Li, X.; Jiang, H.; e Mori, S.; Johns Hopkins University, www.MriStudio.org). Neste procedimento, uma transformação afim de 12 parâmetros (23) foi utilizada para normalizar cada imagem ponderada em T1 para o modelo JHU_MNI_SS_T_ss T1.
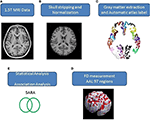
Figura 1. (A-E) Procedimento do processo de imagem e análise estatística.
Extracção do Atlas
Os processos de dados de imagem foram realizados utilizando a caixa de ferramentas SPM8 (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/) e a caixa de ferramentas IBASPM (Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), ambas executadas utilizando o software MATLAB 2010 (Mathworks, Natick, MA, USA).
O procedimento envolve três passos após a normalização: (1) segmentação da imagem normalizada em matéria cinzenta, matéria branca e fluido espinhal cerebral no espaço nativo, (2) parcelamento da matéria cinzenta em 116 regiões com base na marcação anatômica do atlas anatômico do Instituto Neurológico de Montreal (MNI) (24), e (3) transformação das imagens de matéria cinzenta no espaço MNI e alinhamento anatômico de cada voxel de matéria cinzenta para as 116 estruturas anatômicas automáticas de marcação usando o IBASPM (24), cérebro esquerdo: 45 regiões, cérebro direito: 45 regiões, cerebelo: 26 regiões; (Figura 1C). As 26 regiões do cerebelo foram fundidas em sete regiões de acordo com suas estruturas anatômicas, e os volumes das 97 marcadas (45 para cada hemisfério cerebral e sete para o cerebelo, Tabela Suplementar 1) estruturas cerebrais foram extraídas para cada pessoa (Figura 1C).
O método FD foi originalmente proposto por Mandelbrot para a quantificação da complexidade relacionada à forma dos objetos em um único valor numérico (25). O método FD é utilizado para a medição topológica da complexidade; um valor FD mais alto representa uma maior complexidade topológica do tecido em estudo (18, 26). Muitos neurologistas demonstraram que o valor de FD pode servir como uma medida quantitativa para descrever com precisão a complexidade morfológica da dobra cerebral (18, 26, 27). Como a análise de FD é baseada em uma escala logarítmica, mesmo um pequeno aumento no valor de FD pode corresponder a um aumento considerável na complexidade (18). Este estudo adotou o método de contagem de caixa 3D para medir os valores de FD 3D dos 97 segmentos de matéria cinzenta de todo o cérebro para cada participante (Figura 1D). Um estudo relacionado detalha o algoritmo para o método de contagem de caixas (18).
Análise estatística
As diferenças relacionadas ao sexo e idade entre os grupos foram medidas usando o teste qui-quadrado de Pearson (χ2 = 0,384, p = 0,535) e o teste bidirecional de 2 amostras t (p = 0,516), separadamente. A regressão linear foi aplicada para remover os efeitos da idade e gênero. Adotamos o teste t de 2 amostras para determinar se existia uma diferença significativa entre os grupos controle e paciente em relação aos valores de 3D-FD de cada região cortical. A significância dos resultados foi baseada na taxa de falsa descoberta (corrigida por FDR p = 0,05) (28). A magnitude da associação entre o valor de FD 3D de regiões cerebrais individuais e características clínicas, tais como duração da doença e SARA, foi determinada através da medida r de Pearson (Figura 1E). Estas análises foram realizadas utilizando a Caixa de Ferramentas de Estatística no MATLAB 2010.
Resultados
Patientes com SCA3 Revelaram Lesões Significativas em Regiões de Lesões Infratentoriais Típicas
Neuro-ressonância magnética para pacientes com SCA3 (Tabela 1). A Figura 2 ilustra a comparação dos valores de 3D-FD em cada lóbulo entre o grupo saudável e o grupo com SCA3. Globalmente, pacientes com SCA3 apresentaram redução significativa dos valores de 3D-FD em cada lóbulo, e o cerebelo foi associado à redução mais substancial do valor de 3D-FD (Figura 2). Os valores de 3D-FD do córtex cerebelar da SCA3 apresentaram correlação significativa com seus escores SARA (r = -0,3346; p = 0,023). Além disso, parcelamos o córtex cerebral e o córtex cerebelar em 97 regiões e quantificamos a atrofia em cada região parcelada. Os pacientes com SCA3 apresentaram lesões infratentoriais típicas, incluindo núcleos pontíferos, córtex cerebelar e azeitonas inferiores. Os detalhes da diminuição significativa dos valores de 3D-FD das regiões atrofiadas entre o grupo sadio e o grupo SCA3 estão resumidos na Tabela 2.
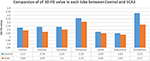
Figura 2. Comparação dos valores de 3D-FD em cada lóbulo entre o grupo saudável e o grupo SCA3. O valor de 3D-FD em cada lóbulo do SCA3 mostrou significativamente menor no grupo controle. O p-valor da diferença significativa de cerebelo, lobo frontal, parietal e occipital é menor que 0,01, e para outros lobos é menor que 0,05.
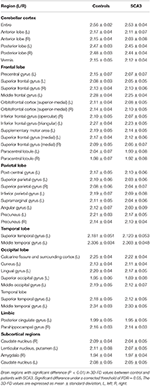
Tábua 2. Regiões atrofiadas significativas em pacientes com SCA3 (p < 0,05).
Patientes com SCA3 Lesão Revelada do Supratentorial Cerebral Lateralizado
Baside as lesões infratentoriais, lesões em regiões supratentoriais também foram observadas em todos os pacientes com SCA3. Elas mostraram lesões disseminadas em 39 regiões parceladas do cérebro (p < 0,05), incluindo lobo frontal, parietal, occipital e temporal. Revelaram atrofia lateralizada, e predominantemente no hemisfério esquerdo (direita/esquerda: 12/27). Especialmente nos lobos occipital e temporal, os pacientes com SCA3 revelaram significativa diminuição dos valores de 3D-FD apenas no hemisfério esquerdo. As regiões atrofiadas significativas nas regiões frontais foram o córtex pré-motor (giro pré-central esquerdo, giro frontal superior bilateral e giro frontal médio esquerdo), córtex motor suplementar (área motora suplementar esquerda) e córtex motor primário (giro pré-central esquerdo) (Figura 3).
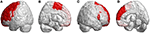
Figura 3. Regiões dentro do lobo frontal indicando valores inferiores de 3D-FD em pacientes com SCA3 em comparação com os controles. (A) Vista da esquerda para a esquerda, (B) vista da esquerda para a direita, (C) vista da direita para a direita e (D) vista da direita para a direita. Os pacientes com SCA3 diminuíram significativamente os valores de 3D-FD em regiões frontais, incluindo o córtex pré-motor (giro pré-central esquerdo, giro frontal superior bilateral e giro frontal médio esquerdo), córtex motor suplementar (área motora suplementar esquerda), e córtex motor primário (giro pré-central esquerdo). Outras regiões atrofiadas foram observadas no giro frontal inferior esquerdo (opercular), giro frontal inferior esquerdo (triangular), córtex orbitofrontal bilateral (superior-1 medial), giro frontal superior bilateral (medial) e lóbulo paracentral bilateral em pacientes com ACS3. Todas as regiões dos valores 3D-FD significativamente diminuídos são ilustradas em vermelho.
Outras regiões atrofiadas estavam no giro frontal inferior esquerdo (opercular), giro frontal inferior esquerdo (triangular), córtex orbitofrontal bilateral (superior-medial), giro frontal superior bilateral (medial) e lóbulo paracentral bilateral. No lobo parietal, foram detectados valores diminuídos de FD no giro pós-central esquerdo, giro supramarginal esquerdo, giro angular esquerdo, giro parietal superior bilateral e pré-cuneus bilaterais de pacientes com SCA3 (Figura 4).
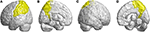
Figure 4. Regiões dentro do lobo parietal indicando uma diminuição no valor de 3D-FD em pacientes com SCA3 em comparação com os controles. (A) Vista da esquerda para cima, (B) vista da esquerda para baixo, (C) vista da direita para cima, e (D) vista da direita para baixo. Em comparação com os controles, os pacientes com SCA3 apresentaram valores significativamente mais baixos de 3D-FD no giro pós-central esquerdo, giro supramarginal esquerdo, giro angular esquerdo, giro parietal superior bilateral e pré-cuneal bilateral do lobo parietal. Todas as regiões de valores significativamente diminuídos de 3D-FD são ilustradas em amarelo.
No lobo occipital, pacientes com SCA3 revelaram valores significativamente menores de FD na fissura calcarina e no córtex circundante, cuneus, giro lingual e giro occipital superior e médio no hemisfério esquerdo (Figura 5A, cor azul). No lobo temporal, as regiões com valores de FD diminuídos estavam no giro temporal esquerdo-superior e médio-esquerdo dos pacientes com SCA3 (Figura 5A, cor roxa). Os valores de 3D-FD no giro cingulado superior esquerdo da região límbica também foram significativamente reduzidos em pacientes com SCA3 (Figuras 5B,D, cor verde). Regiões de atrofia significativa foram observadas nos gânglios basais, incluindo o núcleo caudado bilateral e o putamen esquerdo, em pacientes com SCA3 (Figuras 5B,D, coloração azul aqua). No lobo occipital superior direito, não foram observadas regiões atrofiadas significativas em pacientes com SCA3 (Figura 5C).
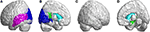
Figura 5. Regiões dentro do lobo occipital, lobo temporal e subcortical indicando valores significativamente menores de 3D-FD em pacientes com SCA3 em comparação com os controles. (A) Vista da esquerda para cima, (B) vista da esquerda para baixo, (C) vista da direita para cima, e (D) vista da direita para baixo. As regiões azuis mostram valores significativamente menores de 3D-FD no lobo occipital, incluindo a fissura calcarina e o córtex circundante, cuneus e giro lingual e o giro superior e médio occipital no hemisfério esquerdo. Regiões roxas denotam valores inferiores de 3D-FD no giro temporal superior esquerdo e no giro temporal médio-esquerdo. As regiões azul-água representam valores inferiores de 3D-FD em regiões subcorticais, incluindo o caudato bilateral e o putamen esquerdo. As regiões verdes representam valores 3D-FD significativamente mais baixos no giro cingulado esquerda-posterior e no giro parahipocampal do sistema límbico.
Na Figura 6, encontramos muitas regiões atrofiadas cerebelares incluindo cerebelo, cerebelar-talamocortical, e gânglios basais-glia-talamocortical que implicaram que pacientes com SCA3 revelaram danos cerebelar-talamocortical e gânglios basais-talamocortical nessas vias.

Figure 6. O SCA3 está envolvido tanto nas vias cerebelar-talamocorticais como nas vias basais dos gânglios-talamocorticais. (A) Vista da esquerda para a esquerda, (B) vista da esquerda para a direita, (C) vista da direita para a direita e (D) vista da direita para a direita. No laço cerebelar-talamocortical, pacientes com SCA3 exibem valores significativamente mais baixos de 3D-FD no córtex cerebelar, pré-motor e motor suplementar. A diminuição dos valores de 3D-FD no córtex cerebelar e em outras regiões cerebrais motoras em pacientes com SCA3 fornece uma explicação para a presença de sintomas clínicos. No laço basal gânglios-talamocortical, os pacientes com SCA3 apresentam valores significativamente menores de 3D-FD no córtex frontal, córtex motor primário, putamen e caudato. Estes resultados revelam alterações morfológicas no gânglio-talamocortical basal em pacientes com SCA3.
Discussão
Clinicamente, pacientes com SCA3 exibem síndrome cerebelar e parkinsonismo (3-5). As regiões atrofiadas do córtex infratentorial e supratentorial listadas na Tabela 2, e mostraram uma ampla gama de áreas sobrepostas como em duas regiões funcionais, a saber, córtex cerebelar (CB) (29) e córtex basal (BG) (30). O córtex relacionado ao CB inclui o cerebelo, pré-frontal, córtex sensorimotor, córtex pré-frontal e lóbulo temporal, e o córtex relacionado ao BG inclui o córtex motor primário, a área motora suplementar, o córtex pré-motor e os gânglios basais. Nossos resultados revelaram, de forma consistente com estudos convencionais anteriores de neuroimagem, que o cerebelo é a região mais afetada e atrofiada em pacientes com SCA3 (4, 31, 32). Além disso, o valor de 3D-FD no córtex cerebelar de pacientes com SCA3 teve uma correlação significativamente negativa com os escores de SARA (r = -0,3346; p = 0,023) como Rezende et al. já haviam relatado (33).
Nas regiões infratentorais, os pacientes com SCA3 tiveram uma diminuição significativa dos valores de 3D-FD em putamen e caudato. Estudos neuropatológicos mostraram perda neuronal no putamen e caudato, o que pode levar à atrofia dos gânglios basais em associação com o Parkinson (34). As características Parkinsonianas são o fenótipo prevalente da mutação SCA3 e são geralmente acompanhadas por sintomas de gânglios basais (35-37). Em estudos de necropsia, o envolvimento dos gânglios basais é comum em pacientes com SCA3. A imagem funcional usando estudos de PET também demonstrou declínio funcional precoce do caudato e do putamen em pacientes com SCA3. Além disso, os pacientes com SCA3 apresentaram um volume significativamente menor de gânglios basais (35). Entretanto, estudos relacionados têm focado apenas os gânglios basais e regiões infratentoriais. Na Figura 6, verificamos que a SCA3 pode ter não apenas as lesões dos gânglios basais, mas também as lesões das vias cerebelar-talamocorticais e dos gânglios basais-talamocorticais.
Patientes com SCA3 exibem valores significativamente diminuídos de 3D-FD do córtex pré-motor e do córtex motor suplementar em sua alça cerebelar-talamocortical. O córtex pré-motor e a área do córtex motor suplementar estão associados ao controle do movimento, como a força muscular e a direção de alcance. Os danos nessas regiões podem induzir ataxia da marcha, postura e membro, além da decomposição do movimento (38, 39). A redução dos valores de 3D-FD do córtex cerebelar e de outras regiões cerebrais relacionadas ao cérebro em pacientes com SCA3 pode explicar a presença de sintomas clínicos. Além disso, nos gânglios basais-rolha talamocórtica, os pacientes com SCA3 exibem valores reduzidos de DFC 3D significativamente nos córtex frontal e motor primário. O córtex motor primário é também um destino importante para a saída dos gânglios basais (40). Perturbações dos gânglios basais – loopalamocortical também podem contribuir para a disfunção motora de Parkinson (41). Os resultados deste estudo enfatizam as alterações morfológicas do laço basal gânglios-talamocortical em pacientes com SCA3, que estudos anteriores de neuroimagem falharam em abordar.
Recentemente, utilizamos a imagem de difusão tensora (DTI) para medir a difusão molecular da água da alteração da matéria branca (WM) no SCA3 (15). Encontramos lesões disseminadas de matéria branca no SCA3 nas lesões cérebro-frontal bilateral, -parietal, -temporal e -occipital WM; cerebelar WM; tálamo e tronco encefálico. De forma idêntica, neste estudo observamos que o SCA3 mostrou quase nas mesmas regiões parceladas dessas lesões WM que revelaram lesões GM. Esses achados atuais confirmam o envolvimento de regiões supratentoriais em pacientes com SCA3. Braga et al. relataram achados semelhantes, demonstrando que o SCA3 causa CCAS através do comprometimento das funções executivas, fluência verbal, raciocínio abstrato e memória de trabalho (8). Em estudos neuropatológicos, foi revelado que a CCAS resulta da interrupção do circuito cerebelar, que está associada aos córtices pré-frontal, parietal superior, temporal superior e límbico (42, 43). Estudos confirmaram o papel do cerebelo na função cognitiva, porém as funções cognitiva, afetiva e visuoespacial estão diretamente associadas à degeneração cortical. As áreas significativamente atrofiadas das regiões supratentoriais em pacientes com SCA3 foram mais extensas do que as regiões associadas ao CCAS. A atrofia do córtex supratentorial pode ser o fator primário associado com a disfunção das regiões relacionadas à ataxia e ao Parkinson. Estes achados sugerem que o SCA3 não deve mais ser considerado uma doença limitada ao cerebelo e suas conexões; ao contrário, deve ser considerado uma patologia que afeta todo o cérebro.
No entanto, este estudo ainda tinha certas limitações. As principais limitações deste estudo são a falta de avaliações cognitivas e parâmetros clínicos específicos para avaliar o CCAS na SCA. Outras investigações são justificadas quanto à correlação entre os resultados presentes e os dados clínicos, como os dados de RM funcionais. Isso pode ajudar a fornecer um método mais preciso para avaliar a associação entre o cognitivo com envolvimento motor e a atrofia regional em pacientes com SCA3.
Conclusões
Neste estudo, utilizamos o método 3D-FD para quantificar as variações morfológicas regionais em pacientes com SCA3 e avaliar a associação entre atrofia supratentorial e envolvimento motor em pacientes com SCA3. Nossos resultados encontraram degeneração significativa do córtex cerebral em regiões específicas, talvez relacionadas ao cerebelar ou aos gânglios basais. Nossos achados podem estar correlacionados aos sintomas comuns da SCA3, como ataxia, Parkinson, disartria e dismetria. O SCA3 não deve mais ser considerado uma doença limitada ao cerebelo e suas conexões; ao contrário, deve ser considerado uma patologia que afeta todo o cérebro.
Data Availability Statement
Todos os conjuntos de dados gerados para este estudo estão incluídos no artigo/Material Suplementar.
Ethics Statement
Os estudos envolvendo participantes humanos foram revisados e aprovados pelo Institutional Review Board of Taipei Veterans General Hospital. Os pacientes/participantes deram seu consentimento livre e esclarecido por escrito para participar deste estudo.
Author Contributions
P-SW e Y-TW organizaram o projeto de pesquisa, revisaram e criticaram o manuscrito. T-YW escreveu o manuscrito. H-MW acessou os dados da pesquisa. A B-WS organizou a pesquisa e realizou a coleta de dados. C-WJ realizou a análise estatística, escreveu e revisou o manuscrito.
Funding
Este estudo foi financiado pelo Ministério da Ciência e Tecnologia, Taiwan (MOST108-2634-F-010-002); National Health Research Institutes, Taiwan (NHRI-EX106-10526EI); National Yang-Ming University e Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Conflito de interesses
Os autores declaram que a pesquisa foi realizada na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Agradecimentos
Os autores agradecem a todos os indivíduos que participaram deste estudo e ao Wallace Academic Editing pela edição deste manuscrito.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em:
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: características neurológicas, patogénese e modelos animais. Cerebelo. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Avanços clínicos e moleculares em ataxias cerebelares autossomais dominantes: do genótipo ao fenótipo e à fisiopatologia. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Ataxias cerebelares autossomais dominantes: características clínicas, genética e patogênese. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Disfunção cognitiva progressiva em ataxia espinocerebelar tipo 3. Desordem de movimento. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Síndrome cognitiva afetiva cerebelar na doença machado joseph: características clínicas centrais. Cerebelo. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease. Desordem de movimento. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Disfunção cognitiva em ataxia espinocerebelar tipo 3: topografias e padrões variáveis. Disordem de movimento. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Dano neuronal disseminado e disfunção cognitiva em ataxia espinocerebelar tipo 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Resposta a: disfunção cognitiva em ataxia espinocerebelar tipo 3: topografias e padrões variáveis. Disordem de movimento. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Base anatômica das interações cognitivo-emocionais no córtex pré-frontal do primata. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease: a longitudinal neuroimaging study. J Neuroimagem. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Tomografia por emissão de pósitrons em portadores assintomáticos de genes da doença Machado-Joseph. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamine transporter positron emission tomography in spinocerebellar ataxias type 1, 2, 3, and 6. Arco Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffusion tensor magnetic ressonance imaging for differentiating multiple system atrophy cerebellar type and spinocerebellar ataxia type 3. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. Os danos da matéria branca estão relacionados com a gravidade da ataxia no SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. Uma avaliação multimodal dos danos de matéria branca microestrutural em ataxia espinocerebelar tipo 3. Desordem de movimento. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Análise dimensional fractal para quantificar a mudança morfológica cerebelar da atrofia de múltiplos sistemas do tipo cerebelar (MSA-C). NeuroImagem. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Escala para a avaliação e classificação de ataxia. Desenvolvimento de uma nova escala clínica. Neurologia. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonismo: início, progressão e mortalidade. Neurologia. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Achados neurológicos na doença Machado-Joseph: relação com a duração da doença, subtipos, e (CAG)n. Arco Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Análise de frequência de ataxias cerebelares autossomais dominantes em pacientes de Taiwan e caracterização clínica e molecular de ataxia espinocerebelar tipo 6. Arco Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Registro automatizado de imagens: I. Métodos gerais e validação intrasubject, intramodalitym. J Informática Auxiliar Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Rotulagem anatômica automatizada das ativações em SPM usando uma parcela anatômica macroscópica do cérebro mono-sujeito da ressonância magnética MNI. NeuroImagem. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fractals: Forma, Oportunidade e Dimensão. São Francisco, CA: Freeman (1977). p. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Dimensão fractal e alterações da matéria branca em esclerose múltipla. NeuroImagem. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Dimensão fractal da superfície cortical cerebral na esquizofrenia e distúrbio obsessivo-compulsivo. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Controlando a taxa de falsas descobertas: uma abordagem prática e poderosa para testes múltiplos. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Investigação anatômica de projeções para a base pontiaguda de corticais de associação parietal posterior em macaco rhesus. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Amplificação Seletiva Usando um Modelo de Contratação dos Gânglios Basais. Pont A Mousson: NeuroComp (2006). p. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomal dominant cerebellar ataxia tipo I clinical features and MRI in families with SCA1, SCA2 and SCA3. Cérebro. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Ressonância magnética em ataxias espinocerebelares. Cerebelo. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimarães RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Envolvimento do córtex cerebral na doença Machado-Joseph. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. O fenótipo parkinsoniano de ataxia espinocerebelar tipo 3 em uma família taiwanesa. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomal dominante cerebelar ataxia tipo I. volumetria baseada em RM de estruturas de fossa posterior e gânglios basais em ataxia espinocerebelar tipos 1, 2 e 3. Cérebro. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Variabilidade intrafamiliar do fenótipo Parkinson em SCAs: casos novos devido às expansões de SCA2 e SCA3. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Fenótipo Parkinsoniano na doença Machado-Joseph (MJD/SCA3): um relato de dois casos. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Princípios da Ciência Neural. Nova York, NY: McGraw-Hill (1991). p. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Doenças do Sistema Nervoso: Neurobiologia Clínica. Philadelphia, PA: W.B. Saunders (1992). p. 319-341.
40. Hoover JE, Strick PL. Múltiplos canais de saída nos gânglios basais. Ciência. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Análise quantitativa da perda dopaminérgica em relação aos territórios funcionais em macacos tratados com MPTP. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Ataxia espinocerebelar tipo 3 (SCA3): a neurodegeneração talâmica ocorre independentemente das inclusões intranucleares intranucleares imunopositivas de ataxina-3. Pathol Cerebral. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Afeição consistente do sistema somatosensorial central em ataxia espinocerebelar tipo 2 e tipo 3 e seu significado para sintomas clínicos e terapia reabilitativa. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar