- Introdução
- Materiais e Métodos
- Equipamento e Sistemas de Controle
- O Sistema TPD
- Preparação da amostra
- Procedimento experimental
- Evacuação
- Análise de gases residuais
- Refrigeração
- Adsorção
- Dessorção
- Moléculas adsorvidas
- Resultados e Discussão
- Dessorção/Decomposição de Celulose Impressão digital
- TPD-Spectra
- n-Decane Desorption
- Metanol deuterado Dessorção
- Conclusões
- Autor Contribuições
- Conflict of Interest Statement
- Acknowledgments
- Material Suplementar
Introdução
A discussão dos benefícios vs. custo ambiental dos materiais de embalagem é constante. Nesta era de consciência ambiental sempre crescente, os clientes muitas vezes recompensam “ficando verdes” e o papel mantém um lugar seguro na vanguarda da questão.
No entanto, para ser usado como material de embalagem para alimentos, o papel tem que preencher uma série de requisitos. Por um lado, moléculas de aroma precisam ficar dentro do alimento e, por outro, a embalagem é colocada para proteger o alimento de influências ambientais como oxigênio ou moléculas orgânicas que podem desencadear o amadurecimento ou produzir sabores podres. Sendo o papel um material poroso, uma característica chave é o transporte das moléculas através da estrutura porosa para ganhar percepção e controle sobre as questões acima mencionadas. Uma das questões a ser respondida neste contexto é a extensão a que as moléculas adsorvem nas paredes dos poros. Isto torna os estudos de adsorção de moléculas em superfícies celulósicas ainda mais essenciais.
A investigação em literatura revela um número substancial de estudos sobre materiais celulósicos no estado húmido para remover poluentes da água (ver por exemplo, Voisin et al., 2017). Também, a adsorção de polieletrólitos em polpas foi intensamente investigada (ver, por exemplo, Li et al., 2003; Neumann et al., 2018). A adsorção de moléculas menores tem atraído menos atenção como foi provado em uma revisão recente (Lombardo e Thielemans, 2019). A adsorção de compostos aromáticos na celulose tem sido estudada por Perez et al. (2004). A adsorção de benzofenona foi estudada por Mazeau e Vergelati (2002) e a adsorção vermelha do Congo por Mazeau e Wyszomirski (2012). A adsorção de naftalina e pireno foi investigada por Tozuka et al. (1998, 2002). A adsorção de uréia foi investigada por Chen et al. (2017), para mencionar apenas alguns exemplos. No entanto, estes artigos não são relevantes para o campo das embalagens de alimentos. Portanto, estamos investigando especificamente a adsorção de pequenas moléculas da fase gasosa em superfícies celulósicas. Dentro deste contexto, a sorção dinâmica de vapor tem sido estudada extensivamente (ver, por exemplo, Xie et al., 2011). Normalmente tais estudos ocorrem em condições de equilíbrio. Quando a adsorção de pequenas moléculas ocorre em embalagens de papel, é improvável que as condições de equilíbrio se apliquem. Nós estamos propondo investigar a adsorção de pequenas moléculas sob condições de alto vácuo, longe do equilíbrio. Infelizmente, tais medidas são impossíveis usando amostras de papel, já que o papel não pode ser aquecido diretamente em uma câmara de vácuo. É por isso que devemos empregar um sistema modelo no nosso caso películas finas de celulose. Apesar de tais películas finas de celulose serem produzidas a partir da celulose II ao invés da celulose I, que é encontrada no papel, foi demonstrado que essas películas são um sistema modelo de substituição útil para papel (Rohm et al., 2014). As películas finas de celulose também já foram usadas anteriormente como substratos para adsorção de água (ver, por exemplo, Niinivaara et al., 2015, 2016; Hakalahti et al., 2017) e adsorção de açúcar (Hoja et al., 2014).
Neste estudo apresentamos os primeiros estudos de adsorção a alto vácuo e espectroscopia de dessorção programada por temperatura de n-decana e metanol deuterado em filmes finos de celulose.
Materiais e Métodos
Equipamento e Sistemas de Controle
– Bomba de palhetas rotativas:
Bomba molecular Turbo TRIVAC D 25 B
– Bomba molecular Turbo & Sistema de controle:
Vácuo tipo Oerlikon Leybold, Turbovac tipo TMP151 & Turbo.Drive TD20 classic
– Espectrómetro de massa Quadrupole & software de controlo:
Balzers Prisma tipo QME 200 (CF DN40) & Quadstar 32-Bit
– Fonte de alimentação:
– Sistema de controle de temperatura
PID (Proporcional-Integral-Derivativo) controlador no Laboratório Nacional de Instrumentos 7.0
– Bayard-Alpert gauge & sistema de controle:
>
Leybold AG IE 414 (CF DN40) & IONIVAC IM 520
– Válvula de ângulo manual
Balzers EVA 025 H (KF DN25)
– Válvula de entrada de gás
Pfeiffer Válvula doseadora de gás a vácuo EVN 116 (KF DN16)
– Conector de metal para vidro condenado:
GMA-KF16-KGD-152-TD13 (KF DN16).
O Sistema TPD
A câmara de vácuo principal é uma passagem de seis vias em aço inoxidável. O sistema de bombeamento consiste de uma bomba turbo molecular, ligada ao lado inferior da câmara principal (ver Figura 1), seguida por uma bomba de palhetas rotativa não mostrada na Figura 1. O espectrômetro de massa quadripolar e o medidor Bayard-Alpert são montados à esquerda e à direita da câmara. A válvula de entrada de gás é fixada no lado posterior e ligada a um recipiente de vidro contendo as moléculas orgânicas líquidas (ver Figura 1 vista traseira).
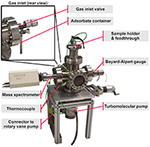
Figura 1. TPD-System, visão geral.
A parte superior da passagem de seis vias é estendida por um adaptador para uma tampa de flange CF DN63, que é fixada por uma corrente de braçadeira CF rápida, proporcionando uma troca de amostras mais rápida. A tampa de flange oferece duas passagens eléctricas e uma passagem de termopar, bem como um orifício no corpo de cobre do dedo de arrefecimento. O dedo de resfriamento, uma peça cilíndrica oca de cobre, é montado no lado interno desta tampa de flange, estendendo-se até o centro da câmara, fundindo-se em uma peça final achatada, mais tarde referida como o “suporte da amostra” (Figura 2). Duas bancadas de suporte de amostras são fixadas a esta plataforma isoladas por espaçadores de óxido de alumínio, que proporcionam isolamento eléctrico e condução de calor.

Figure 2. Suporte de amostra do Sistema TPD, vista superior e vista lateral.
O substrato de amostra em si é uma placa de aço inoxidável de 1 × 1 cm com dois fios de fita para aquecimento por resistência e um termopar tipo K, soldado por pontos na sua parte de trás. O substrato é montado fixando os fios de aquecimento nas bancadas de suporte de amostras, que são ligadas à passagem eléctrica por cabos de cobre.
Na secção do meio, o dedo de arrefecimento também segura dois mini-conectores de termopar de óxido de alumínio, que são encaixados uns nos outros. Enquanto o mini conector superior está permanentemente ligado à alimentação do termopar através da tampa de flange, o conector inferior funciona como uma placa de fixação para os fios do termopar provenientes da parte de trás da amostra (ver Figura 2).
A fim de aumentar o fluxo de gás para a superfície da amostra, um tubo de entrada de gás, que é ligado à válvula de entrada de gás (ver Figura 3), aponta para a superfície da amostra num ângulo de cerca de 35° e termina a uma distância de cerca de 3 cm da superfície da amostra. O espectrômetro de massa é posicionado exatamente oposto à superfície da amostra à mesma distância.

Figura 3. Câmara de vácuo dentro da geometria.
Preparação da amostra
A amostra é preparada com o mesmo procedimento padrão proposto por Kontturi et al. (2003) e Rohm et al. (2014), sendo o substrato revestido por uma fina película de celulose. A celulose em questão é trimethylsilyl cellulose (TMSC) com um grau de substituição de cerca de 2,8 (Thüringisches Institut für Textil-und Kunstoff-Forschung e.V. (TITK), Alemanha) e dissolvida em tolueno com uma concentração de cerca de 1 mg/ml. A solução resultante é fundida sobre a superfície metálica polida da amostra e seca ao ar. Posteriormente, uma gota de 10% de HCl é colocada num prato de petri e a amostra é colocada ao lado da gota de HCl. A placa, incluindo a configuração da amostra é então coberta com folha de alumínio e deixada para reagir durante 15 min.
De acordo com Konturri e Djak este procedimento resulta numa película de celulose totalmente regenerada com uma espessura de cerca de 50 nm (Kontturi et al., 2003; Djak et al., 2011). As medidas FTIR das películas não encontraram nenhuma vibração induzida pelo trimetilsililil nas películas de celulose pura. A massa 73, entretanto, foi encontrada na dessorção térmica que poderia corresponder ao fragmento de trimetilsililil. A quantidade de TMSC residual fica assim abaixo do limite de detecção de FTIR (~1 × 1013 moléculas) e acima do limite de detecção da espectroscopia de massa. A espessura do filme de várias outras amostras também foi medida pelo AFM. Posteriormente estas amostras de AFM não foram mais usadas para experimentos de dessorção para evitar a influência dos arranhões causados pelas medidas de espessura de AFM no comportamento de dessorção.
Os filmes são completamente amorfos; por isso não esperamos ver uma estrutura porosa neles. Durante as investigações de AFM desses filmes (Ganser et al., 2014, 2016; Rohm et al., 2014) não foi encontrada nenhuma indicação de poros. Isto indica que a densidade deve ser próxima à da celulose regenerada. Entretanto, a porosidade e densidade dos filmes não foram medidas dentro deste estudo.
Procedimento experimental
Evacuação
A amostra é montada nas bancadas de retenção de amostras e o termopar é conectado (ver acima). O suporte de amostras é inserido na câmara de vácuo e a monitorização da temperatura é iniciada. A tampa de flange é fixada pela corrente de fixação rápida CF e a câmara de vácuo é evacuada para a pressão de base de cerca de 5 × 10-9 mbar. Devido aos filamentos do espectrômetro de massa e do medidor Bayard-Alpert, a temperatura da amostra dentro da câmara de vácuo se eleva a 55°C enquanto a evacuação é realizada.
Análise de gases residuais
Uma análise de gases residuais é realizada registrando um espectro de massa de 1 a 100 (tal espectro de massa é mostrado nas informações de apoio (SI Figura 1) para avaliação das condições iniciais e da qualidade do vácuo.
Refrigeração
N2(l) nitrogênio líquido é agora preenchido no dedo de resfriamento repetidamente. Uma vez atingida a temperatura de base predefinida da amostra (-80°C), ela é mantida por meio de um PID (Proporcional-Integral-Derivado) moderado, controlado, aquecimento por resistência e resfriamento posterior de N2(l) conforme necessário.
Adsorção
A válvula de entrada de gás é agora aberta cuidadosamente. Devido à pressão do vapor à temperatura ambiente das moléculas orgânicas dentro do recipiente de adsorção, o vapor é dosado para a câmara de vácuo. A amostra é mantida a -80°C durante a adsorção. A válvula é ajustada até o influxo das moléculas orgânicas gasosas e o bombeamento da bomba molecular turbo a uma pressão constante de 5 × 10-6 mbar. Esta pressão é então mantida durante um tempo de adsorção especificado de 6 minutos. Após este tempo, a válvula de entrada de gás é fechada rapidamente e a pressão da câmara retorna à pressão de base.
Dessorção
Leva cerca de 1 min para atingir a pressão de base e o processo de dessorção térmica é iniciado a partir de -80°C. O controlador PID aquece a amostra com uma taxa de aquecimento de 1°C/s até o limite superior de temperatura de 600°C. Durante a dessorção, os sinais de intensidade das massas predefinidas são continuamente registrados em relação ao tempo pelo espectrômetro de massa. Ao mesmo tempo, a temperatura da amostra é registrada em função do tempo. Cada intensidade de massa é então replotada como uma função da temperatura. Isto representa uma configuração bastante típica para medições TPD (ver, por exemplo, Hohenegger et al., 1998).
Desde que apenas um número limitado de intensidades de massa pode ser registado numa linha, cada massa representa um fragmento característico de uma molécula participante: massa 57 para n-decano, massa 34 para metanol deuterado (D3COD), massa 44 para CO2, e massa 18 para H2O. Enquanto as duas primeiras massas são características das espécies adsorvidas, as duas últimas massas são características da dessorção de celulose.
Moléculas adsorvidas
Moléculas aromáticas geralmente são moléculas orgânicas com uma pressão de vapor bastante alta. Pode-se encontrar moléculas de aroma tanto polares como não polares. Para ter uma primeira idéia sobre o comportamento de adsorção de tais moléculas em uma película fina de celulose, usamos n-decano como molécula não polar e metanol deuterado (D3COD) como molécula polar. Ambas as moléculas foram obtidas em grau p.a. de Sigma Aldrich (metanol deuterado ≥99%, pureza isotópica ≥99.8 atom % D, n-decano ≥99.5 %) e foram limpas in situ através de vários ciclos de congelamento e descongelamento. A massa molecular do n-decano é de 142 amu e a pressão de vapor a 30°C é de 3,17 hPa, o que se mostrou suficiente para a adsorção. Como o espectrômetro de massa quadrupolar usado tem uma massa máxima de 100 amu tivemos que olhar para a massa 57 para o n-decano. No final, este também foi o pico mais alto no espectro de massa n-decano. A massa 57 também é de intensidade bastante baixa no espectro de massa da película de celulose de dessorção. O espectro de massa do n-decano pode ser encontrado na informação de suporte (SI Figura 2). O espectro de massa de n-decano permaneceu inalterado ao longo do tempo e não mostra nenhuma evidência de contaminação com hidrocarbonetos inferiores. No entanto, vestígios de contaminação por nonano e octano não podem ser completamente descartados.
A massa molecular do metanol deuterado é de 36 amu. O pico mais alto no espectro de massa do metanol deuterado é de 34 amu. Em nossas medições TPD usamos essa massa como indicador, pois ela não interfere com o espectro de massa da película de celulose desorbinante nem com o n-decano. O espectro de massa do metanol deuterado durante a exposição também pode ser encontrado na informação de suporte (SI Figura 3). A pressão de vapor do metanol deuterado a 20°C é de 129 hPa.
Resultados e Discussão
As moléculas expostas não adsorvem apenas na película de celulose, porque a adsorção é realizada através da fase gasosa. Portanto, uma série de experimentos cegos foi conduzida para garantir que os efeitos encontrados só se originassem das películas de celulose. No regime cego, foram testados os filmes de substrato limpo com e sem adsorção de n-decano e metanol deuterado. Estes três experimentos mostram claramente picos de dessorção diferentes dos aqui apresentados. Sem adsorção prévia de gás nas películas de celulose encontram-se (ver Figura 4) vários fragmentos de dessorção na mesma faixa de temperatura mostrada pelos espectros TPD abaixo.
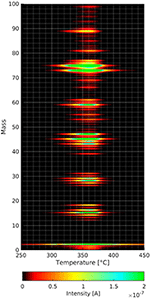
Figura 4. Espectros de massa em função da temperatura de decomposição e dessorção da película de celulose. As intensidades das diferentes massas estão ligadas ao código de cor.
Dessorção/Decomposição de Celulose Impressão digital
Figure 4 mostra o resultado de uma experiência TPD com uma película de celulose sem adsorção prévia de gás. No gráfico tridimensional pode-se ver que a intensidade máxima dos fragmentos de dessorção de celulose ocorre a cerca de 360°C. Esta é uma temperatura mais baixa do que as dos outros espectros de TPD mostrados posteriormente. A taxa de aquecimento no experimento acima mencionado é de apenas 0,1°C/s em oposição a 1°C/s em todos os outros experimentos. A menor taxa de aquecimento tornou-se necessária, pois a aquisição de um espectro de massa completo de 0 a 100 amu leva muito mais tempo do que as 4 massas individuais nas outras experiências mostradas mais tarde.
A figura 4 mostra que tanto a massa 18 como a massa 44 desorb durante a decomposição e dessorção da celulose. Os picos mais intensos de dessorção estão nas massas 73 e 75 amu. Enquanto o pico na massa 73 se encaixa no grupo dos trimetilsilílicos, não se pode explicar a massa 75 usando este grupo, pois o isótopo Si com massa 30 tem apenas uma ocorrência de cerca de 3%. Dentro deste contexto, a massa 75 poderia também derivar da fragmentação de espécies maiores que não conseguimos detectar devido à limitação de massa (massa 100) do espectrómetro de massa utilizado. Pode-se ver vários grupos de massas com uma distância de cerca de 10 amu, o que é uma característica comum dos espectros de massa das moléculas orgânicas. No entanto, é preciso considerar cuidadosamente quais as massas a serem rastreadas ao fazer experimentos de dessorção térmica a partir de filmes de celulose. Isto ajuda a distinguir as espécies adsorvidas da película de celulose em decomposição/dessorção. Escolhemos a massa 57 para o n-decano, pois este pico é o menor dos picos de celulose que poderia ser usado para o n-decano. Foi utilizado metanol deuterizado, pois seu pico de massa mais alto, de 34 amu, não é detectado no espectro de dessorção da película de celulose.
Também observamos em experimentos preliminares que o aquecimento a 150°C levou a uma mudança marcante nas películas finas de celulose mostrada por uma mudança significativa no início dos espectros de TPD após medições repetidas na mesma película (ver SI Figura 4). Neste trabalho apresentamos apenas os dados obtidos com uma película de celulose fina virgem. A dessorção das películas de celulose é completada a cerca de 600°C. Com o tempo encontramos um acúmulo de um resíduo de carbono no substrato, que foi retirado por polimento da superfície antes da formação da película.
TPD-Spectra
A interpretação dos espectros de TPD na Ciência de Superfície segue o princípio do equilíbrio microscópico. Uma espécie adsorvente seguirá assim o mesmo caminho durante a adsorção e a dessorção. Como conclusão inversa pode-se aprender algo sobre o processo de adsorção a partir de experimentos de dessorção (Somorjai, 1981). Foi demonstrado que a forma do pico de dessorção de um experimento TPD tem uma forma característica para a dessorção tanto de um multi-camadas para dessorção molecular quanto para adsorção dissociativa (Somorjai, 1981). Redhead propôs um método simplificado para calcular a energia de adsorção a partir da temperatura no pico máximo de um espectro de dessorção térmica (Redhead, 1962). Neste trabalho relatamos as energias de adsorção para as espécies adsorvidas calculadas de acordo com a fórmula da Redhead. Em qualquer caso, deve-se ter em mente que este método foi originalmente destinado à adsorção de moléculas simples como CO ou H2. Sob quais circunstâncias o método Ruiva também se aplica a moléculas orgânicas ainda não foi investigado. No final, os valores fornecem pelo menos uma idéia sobre a energia de adsorção. Diferentes energias de adsorção são normalmente ligadas a diferentes locais de adsorção na superfície. Esta conexão é usada ao longo deste trabalho.
n-Decane Desorption
The asymmetric peak shape with the steep trailing edge of the desorption peak as shown by Figura 5 is a clear sign that the n-decane desorbs from a multilayer that was adsorbed at -80°C. A dessorção de multicamadas entre cerca de -70 e -52°C com uma energia de adsorção de cerca de 60 kJ/mol. Este valor situa-se entre o calor de vaporização de 56 kJ/mol a -15°C (Carruth e Kobayashi, 1973) e 77 kJ/mol obtidos pela extrapolação dos dados de Majer e Scoboda (1985) para -70°C. Isto sugere que este pico de dessorção provém de um pico de dessorção de várias camadas na superfície. Dentro da mesma faixa de temperatura também pode ser observada alguma dessorção de CO2, que muito provavelmente deriva da adsorção do gás residual durante o resfriamento e durante a adsorção de n-decano. Um olhar mais atento para a mesma faixa de temperatura também mostra um pico de dessorção de água (ver Figura 6).
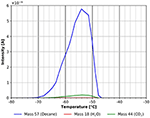
Figura 5. Dessorção de n-decano (massa 57, azul), dióxido de carbono (massa 44, verde) e água (massa 18, vermelho) entre -80 e -30°C.
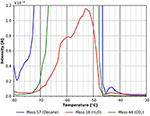
Figura 6. Zoom no espectro TPD mostrado na Figura 5. n-decano (massa 57, azul), dióxido de carbono (massa 44, verde), e água (massa 18, vermelho).
O pico de dessorção de água visto na faixa de temperatura entre -80 e cerca de -52°C muito provavelmente é devido à adsorção de água do gás residual durante o resfriamento e exposição ao gás. Pode também originar-se parcialmente da água residual na película de celulose. Para minimizar este último efeito, as experiências aqui mostradas só foram iniciadas quando foi alcançada uma pressão de fundo de cerca de 5 ×10-9 mbar. A influência da pressão de fundo antes da adsorção é mostrada nas informações de apoio (SI Figura 5). A Figura 6 também mostra outra característica de dessorção de n-decano e água com um máximo de cerca de -43°C. Embora este pico seja pequeno, note que todos os valores são derivados diretamente dos dados brutos sem qualquer suavização. Por esta razão, todos os picos discutidos neste trabalho mostram uma boa relação sinal/ruído e todas as características discutidas foram reproduzidas experimentalmente várias vezes.
Esta característica é mostrada com mais detalhes na Figura 7. O pico de dessorção a cerca de -43°C sugere claramente uma espécie de n-decano mais fortemente ligada. Usando a fórmula Redhead isto corresponde a uma energia de ligação de cerca de 70 kJ/mol. Um pequeno pico de CO2 e água é claramente visível ainda na Figura 7, indicando que estas espécies encontram locais de adsorção semelhantes na superfície da celulose.
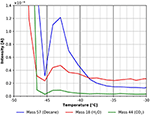
Figura 7. Zoom no espectro TPD mostrado na Figura 6. n-decano (massa 57, azul), dióxido de carbono (massa 44, verde), e água (massa 18, vermelho).
Ir para temperaturas mais altas encontra-se uma característica de dessorção pequena e ampla de n-decano entre cerca de -40 e +14°C (ver Figura 8) correspondente a uma energia de adsorção de cerca de 160 kJ/mol. Esta característica não está presente no traço de dessorção de CO2, e não é claramente visível no traço de dessorção de água. A razão para a maior dispersão nos dados da Figura 8 poderia ter sido causada por uma taxa de aquecimento que não era perfeitamente linear nesta faixa de temperatura.
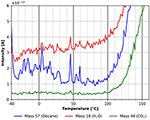
Figure 8. Desorção de n-decano (massa 57, azul), dióxido de carbono (massa 44, verde) e água (massa 18, vermelho) na faixa de temperatura entre -40 e +160°C.
Figure 8 também mostra que as três espécies começam a desorbatar em diferentes temperaturas de início de cerca de 80°C para água, 95°C para n-decano, e 100°C para CO2. Este é também o início da dessorção/degradação da película de celulose, como pode ser visto na Figura 8. Outra forte indicação de que o filme de celulose sofre alterações significativas durante o aquecimento pode ser vista na diferença entre o início da dessorção após repetidos ciclos de adsorção e dessorção sem preparar um novo filme mostrado nas informações de suporte (SI Figura 4).
O maior pico de dessorção na Figura 9 é o pico de CO2 seguido pelo pico de água. Surpreendentemente, há uma significativa dessorção de n-decano visível ainda. Este pico também pode ter origem em parte na decomposição/dessorção da película de celulose. Infelizmente, estas duas possibilidades não podem ser distinguidas uma da outra neste momento. Como mencionado acima, um fragmento em massa 57 pode ser visto na Figura 4. Provavelmente existe um quarto local de adsorção para n-decano com uma energia de ligação de cerca de 180 kJ/mol. A degradação da celulose também ocorre aproximadamente na mesma faixa de temperatura. Estes resultados mostram que moléculas não-polares facilmente adsorvem em superfícies de celulose à temperatura ambiente e acima.
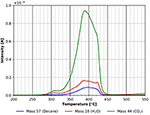
Figure 9. Dessorção de n-decano (massa 57, azul), dióxido de carbono (massa 44, verde) e água (massa 18, vermelho) na faixa de temperatura entre 200 e 550°C.
Uma comparação das Figuras 9 e 10 mostra que a dessorção final de todas as espécies é influenciada pelas moléculas adsorvidas. No caso da adsorção de n-decana, três picos de dessorção diferentes para as três espécies investigadas podem ser vistos na Figura 9. Para o metanol deuterado, apenas um pico é observado na mesma região de temperatura (Figura 10). Isto sugere que as espécies adsorvidas têm influência na decomposição e dessorção da celulose.
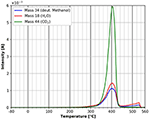
Figura 10. Dessorção de metanol deuterado (massa 34, azul), dióxido de carbono (massa 44, verde) e água (massa 18, vermelho) na faixa de temperatura entre -80 e 560°C.
Metanol deuterado Dessorção
Figure 10 mostra o espectro TPD do metanol deuterado em toda a faixa de temperatura. Evidentemente, os picos de temperatura baixos estão ausentes neste caso. Este é um forte indicador de que o metanol deuterado polar está mais fortemente ligado durante a adsorção do que o n-decano. No entanto, a energia de adsorção de acordo com a equação da Redhead também é de cerca de 180 kJ/mol. Claramente deve-se ter em mente que o pico de dessorção de massa 57 no caso do n-decano está sobreposto à massa 57 da dessorção/decomposição da celulose, o que não é o caso da dessorção de metanol deuterado. Toda a massa 57 de dessorção ocorre a temperaturas mais baixas e, portanto, faltam completamente energias de adsorção mais baixas no caso do metanol deuterado. Além disso, parece haver uma influência marcada da principal molécula adsorvida na adsorção de água e CO2 do gás residual. A influência do metanol deuterado na própria película de celulose pode ser vista no pico principal a 400°C. Em contraste com o caso do n-decano, não existem ombros no pico de degradação/dessorção após a adsorção do metanol deuterado. Após a adsorção do metanol deuterado, falta o pequeno pico que ocorre a cerca de 310°C após a adsorção do n-decano, bem como os ombros no pico de dessorção principal. Também podemos detectar uma pequena dessorção adicional das três espécies a cerca de 550°C, que não foi observada após a adsorção de n-decano. Infelizmente, a esta temperatura não se pode descartar completamente um artefato do suporte da amostra de cobre.
Os resultados apresentados nas Figuras 9, 10 mostram que a adsorção de moléculas polares tem uma forte influência nos filmes finos de celulose, pois os espectros de dessorção são significativamente diferentes.
Figure 11 mostra com mais detalhes o ponto de partida dos espectros TPD após a adsorção do metanol deuterado. A dessorção de água começa em torno de -60°C. As flutuações da dessorção de água nesta faixa de temperatura novamente é muito provável devido a pequenas flutuações na taxa de aquecimento linear. Curiosamente, a dessorção de metanol deuterado começa primeiro a uma temperatura de cerca de +40°C. Esta diferença nos pontos de partida da dessorção entre a água e o metanol deuterado pode ser atribuída a diferentes locais de adsorção. Aparentemente, o metanol está mais fortemente ligado à película de celulose do que à água. A dessorção de CO2 começa em cerca de +60°C, marcando o início da decomposição e dessorção da celulose.
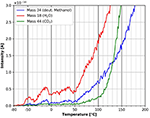
Figure 11. Zoom na dessorção de metanol deuterado (massa 34, azul), dióxido de carbono (massa 44, verde) e água (massa 18, vermelho) na faixa de temperatura entre -80 e 200°C.
Conclusões
Com este estudo foi estudada a adsorção e dessorção de moléculas orgânicas em filmes finos de celulose utilizando a dessorção programada para temperatura. Foi possível mostrar que a co-adsorção de água e CO2 do gás residual também é influenciada pelas moléculas adsorvidas. Todas as espécies têm uma influência marcante na decomposição/dessorção dos filmes de celulose. Dos resultados aqui apresentados, torna-se claro que tanto as moléculas não polares como as polares adsorvem prontamente numa superfície de celulose, com a molécula polar mostrando uma maior energia de ligação.
Metanol deuterado mostra um pico de dessorção a cerca de 400°C e na mesma faixa de temperatura ocorre a dessorção/decomposição da celulose. Como a espécie adsorvida desorb na mesma faixa da película de celulose, a energia de adsorção pode realmente ser maior do que os 180 kJ/mol obtidos da equação de Redhead.
No futuro, planejamos investigar moléculas diferentes, bem como a possível influência da espessura da película de celulose na adsorção e dessorção de moléculas orgânicas.
Autor Contribuições
EH planejou e construiu a câmara de vácuo e fez experimentos. VH realizou as experiências iniciais. JA realizou experimentos iniciais. RS teve a idéia da pesquisa, da configuração da câmara de vácuo, e supervisionou os estudantes.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Acknowledgments
Este trabalho tem sido apoiado pela Sociedade Cristã de Doppler, Áustria. O apoio financeiro do Ministério Federal Austríaco para Assuntos Digitais e Econômicos e da Fundação Nacional para Pesquisa, Tecnologia e Desenvolvimento, Áustria, é agradecido.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fmats.2019.00178/full#supplementary-material
Carruth, G. F., e Kobayashi, R. (1973). Pressão de vapor de parafinas normais etano através de n-decano dos seus pontos triplos até cerca de 10 mm de mercúrio. J Chem Eng Data. 18, 115-126. doi: 10.1021/je60057a009
CrossRef Full Text | Google Scholar
Chen, P., Nishiyama, Y., Wohlert, J., Lu, A., Mazeau, K., e Ismail, A. E. (2017). A entropia translacional e a energia de dispersão conduzem conjuntamente a adsorção de uréia à celulose. J. Phys. Chem. B 121, 2244-2251. doi: 10.1021/acs.jpcb.6b11914
PubMed Abstract | CrossRef Full Text | Google Scholar
Djak, M., Gilli, E., Kontturi, E., e Schennach, R. (2011). Dependência da espessura dos espectros infravermelhos de absorção de reflexão de filmes de polímeros finos suportados. Macromolecules 44, 1775-1778. doi: 10.1021/ma102905v
CrossRef Full Text | Google Scholar
Ganser, C., Hirn, U., Rohm, S., Schennach, R., e Teichert, C. (2014). AFM nanoindentação de fibras de celulose e filmes finos de celulose com umidade relativa variável. Holzforschung 68, 53-60. doi: 10.1515/hf-2013-0014
CrossRef Full Text | Google Scholar
Ganser, C., Niegelhell, K., Czibula, C., Chemelli, A., Teichert, C., Schennach, R., et al. (2016). Efeitos topográficos em experimentos de mapeamento de força de AFM em filmes finos de celulose xilan-decorada. Holzforschung 70, 1115-1123. doi: 10.1515/hf-2016-0023
CrossRef Full Text | Google Scholar
Hakalahti, M., Faustini, M., Boissiere, C., Kontturi, E., e Tammelin, T. (2017). Mecanismos interfaciais de sorção de vapor de água em filmes de nanofibril de celulose como revelado por modelos quantitativos. Biomacromolecules 18, 2951-2958. doi: 10.1021/acs.biomac.7b00890
PubMed Abstract | CrossRef Full Text | Google Scholar
Hohenegger, M., Bechtold, E., e Schennach, R. (1998). Coadsorção de oxigênio e cloro em Pt(111). Surf. Sci. 412/413, 184-191.
Google Scholar
Hoja, J., Maurer, R. J., e Sax, A. F. (2014). Adsorção de glicose, celobiose e cellotetraose em superfícies de modelos de celulose. J Phys. Chemistry B 118, 9017-9027. doi: 10.1021/jp5025685
PubMed Abstract | CrossRef Full Text | Google Scholar
Kontturi, E., Thüne, P. C., e Niemantsverdriet, J. W. (2003). Novo método para a preparação de superfícies de modelos de celulose por spin coating. Polímero 44, 3621-3625. doi: 10.1016/S0032-3861(03)00283-0
CrossRef Full Text | Google Scholar
Li, H., Du, Y., e Xu, Y. (2003). Adsorção e complexação de aditivos chitosan húmidos em sistemas de fabrico de papel. J Appl Polymer Sci. 91, 2642-2648. doi: 10.1002/app.13444
CrossRef Full Text | Google Scholar
Lombardo, S., e Thielemans, W. (2019). Termodinâmica da adsorção em superfícies nanocelulósicas. Celulose 26, 249-279. doi: 10.1007/s10570-018-02239-2
CrossRef Full Text | Google Scholar
Majer, V., e Scoboda, V. (1985). Enthalpies of vaporization of organic compounds: a critical review and data compilation. Blackwell Sci. Publicações. 1985:300.
Mazeau, K., e Vergelati, C. (2002). Atomistic Modeling of the Adsorption of benzophenone on cellulosic surfaces. Langmuir 18, 1919-1927. doi: 10.1021/la010792q
CrossRef Full Text | Google Scholar
Mazeau, K., e Wyszomirski, M. (2012). Modelação da adsorção vermelha do Congo sobre a superfície hidrofóbica da celulose utilizando a dinâmica molecular. Celulose 19, 1495-1506. doi: 10.1007/s10570-012-9757-6
CrossRef Full Text | Google Scholar
Neumann, R. D., Berg, J. M., e Claesson, P. M. (2018). Medição direta das forças de superfície em sistemas de fabricação de papel e de revestimento de papel. Res. de Papel de Celulose Nórdica. J. 8, 96-104. doi: 10.3183/npprj-1993-08-01-p096-104
CrossRef Full Text
Niinivaara, E., Faustini, M., Tammelin, T., e Kontturi, E. (2015). Absorção de vapor de água de filmes ultramateriais de nanocristais biologicamente derivados: avaliação quantitativa com microbalança de cristal de quartzo e elipsometria espectroscópica. Langmuir 31, 12170-12176. doi: 10.1021/acs.langmuir.5b01763
PubMed Abstract | CrossRef Full Text | Google Scholar
Niinivaara, E., Faustini, M., Tammelin, T., e Kontturi, E. (2016). Mimetizar a resposta da parede celular vegetal à umidade usando sistemas bidimensionais: o papel crítico dos polissacáridos amorfos e cristalinos. Langmuir 32, 2032-2040. doi: 10.1021/acs.langmuir.5b04264
PubMed Abstract | CrossRef Full Text | Google Scholar
Perez, D. D. S., Ruggiero, R., Morais, L. C., Machado, A. E. H., e Mazeau, K. (2004). Estudos teóricos e experimentais sobre a adsorção de compostos aromáticos na celulose. Langmuir 20, 3151-3158. doi: 10.1021/la0357817
CrossRef Full Text | Google Scholar
Redhead, P. A. (1962). Dessorção térmica de gases. Vácuo 12, 203-211, doi: 10.1016/0042-207X(62)90978-8
CrossRef Texto Completo | Google Scholar
Rohm, S., Hirn, U., Ganser, C., Teichert, C., and Schennach, R. (2014). Películas finas de celulose como sistema modelo para ligações de fibra de papel. Cellulose 21, 237-249. doi: 10.1007/s10570-013-0098-x
CrossRef Full Text | Google Scholar
Somorjai, G. A. (1981). A Química em Duas Dimensões: Superfícies. Ithaca, NY: Cornell University Press.
Tozuka, Y., Tashiro, E., Yonemochi, E., Oguchi, T., e Yamamoto, K. (2002). Estudo da fluorescência em estado sólido da adsorção de naftaleno em material poroso. J. Colloid Interface Sci. 248, 239-243. doi: 10.1006/jcis.2001.8142
PubMed Abstract | CrossRef Full Text | Google Scholar
Tozuka, Y., Yonemochi, E., Oguchi, T., e Yamamamoto, K. (1998). Estudos fluorométricos de adsorção de pireno em celulose cristalina porosa. J Colloid Interface Sci. 205, 510-515.
PubMed Abstract | Google Scholar
Voisin, H., Bergström, L., Liu, P., e Mathew, A. P. (2017). Materiais à base de nanocelulose para purificação de água. Nanomateriais 7:57. doi: 10.3390/nano7030057
PubMed Abstract | CrossRef Full Text | Google Scholar
Xie, Y., Hill, C. A. S., Jalaludin, Z., e Sun, D. (2011). O comportamento de sorção de vapor de água de três celuloses: análise usando cinética exponencial paralela e interpretação usando o modelo viscoelástico Kelvin-Voigt. Celulose 18, 517-530. doi: 10.1007/s10570-011-9512-4
CrossRef Full Text | Google Scholar