- Introduction
- Materiais e Métodos
- Indução da ICH
- Western Blotting
- Immunohistochemistry
- Enzyme Linked Immunosorbent Assay
- Genetic Knockdown of Galectin-3
- Análise Estatística
- Resultados
- Padrão de Expressão Temporal de Galectina-1 e Galectina-3 após ICH
- Localização celular de Galectina-1 e Galectina-3 Após ICH
- Galectina-1 e Galectina-3 Regulação mediada da resposta inflamatória
- Discussão
- Conclusão
- Declaração Ética
- Contribuições dos autores
- Funding
- Conflict of Interest Statement
- Material Suplementar
- A abreviaturas
Introduction
A hemorragia intracerebral é um subtipo de acidente vascular cerebral fatal (Qureshi et al, 2001a) que é responsável por uma taxa de mortalidade hospitalar e uma taxa de incapacidade de 40 e 80%, respectivamente (van Asch et al., 2010). A ICH é responsável por 10-15% de todos os AVC, e a incidência mundial de ICH é de 2 milhões de casos por ano (van Asch et al., 2010) com aproximadamente 120.000 casos por ano nos Estados Unidos (Ribo e Grotta, 2006; Broderick et al., 2007; Aguilar e Freeman, 2010). No entanto, espera-se que a incidência tenha duplicado até 2050 (Qureshi et al., 2001b) devido ao envelhecimento e ao uso de anticoagulantes em larga escala (Wang, 2010). Notavelmente, não há tratamento eficaz para a HIC e a fisiopatologia da doença é mal definida.
Neuroinflamação caracterizada pela ativação de microglia, as células neuroimunes do SNC, é um contribuinte chave para a lesão cerebral secundária induzida pela HIC e perda da função neurológica (Wang e Dore, 2007; Carmichael et al., 2008; Wang, 2010). A introdução de componentes sanguíneos, incluindo trombina, Hb e metabolitos Hb como o hemin no cérebro cria a base para respostas neuroinflamatórias após a ICH (Wang e Dore, 2007; Carmichael et al., 2008; Robinson et al., 2009; Wang, 2010; Cai et al., 2011; Dang et al., 2011; Babu et al., 2012; Lin et al., 2012; Weng et al., 2015; Min et al., 2017). Notavelmente, a ativação pró-inflamatória da microglia após a HIC correlaciona-se com lesão da barreira hematoencefálica, inchaço/edema cerebral, expansão do hematoma, deterioração neurológica e má recuperação funcional (Platt et al., 1998; Hickenbottom et al., 1999; Leira et al., 2004; Zhao et al., 2007). Além disso, a resposta inflamatória após a HIC também regula o recrutamento cerebral de monócitos/macrófagos derivados do sangue que são conhecidos por regularem o dano cerebral induzido pela HIC e, portanto, a recuperação funcional (Tessier et al., 1997; Shiratori et al., 2010; Starossom et al., 2012).
Galectinas são uma família de proteínas de ligação aos carboidratos conservados evolutivamente (Barondes et al., 1994a,b; Kasai e Hirabayashi, 1996) envolvidos na ativação, diferenciação, proliferação, migração e apoptose celular (Perillo et al., 1995; Yang et al., 1996; Perillo et al., 1998; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002). Entre os vários membros da família Galectin, as evidências emergentes implicam papéis-chave da Galectina-1 e Galectina-3 nas respostas neuroimunes em várias condições neuropatológicas (Jeon et al., 2010; Starossom et al., 2012; Parikh et al., 2015). Contudo, existe uma lacuna crítica de conhecimento na compreensão da sua expressão e função celular após a ICH. O objetivo do manuscrito atual é elucidar a modulação induzida por hemorragia e a expressão celular da expressão da Galectina-1 e Galectina-3 no cérebro em um modelo pré-clínico da ICH.
Materiais e Métodos
Indução da ICH
Explosão de hemorragia intracerebral foi induzida em camundongo CD-1 macho adulto (8-12 semanas; n = 43), como relatado anteriormente (Sukumari-Ramesh et al., 2012a,b, 2016; Bonsack et al., 2016; Sukumari-Ramesh e Alleyne, 2016; Ahmad et al., 2017; Chen-Roetling et al., 2017). Em resumo, o rato foi anestesiado (cetamina e xilazina) e foi feita uma pequena incisão para expor o crânio. Usando uma broca de alta velocidade, foi feito um furo de rebarbas (0,5 mm) no crânio aproximadamente 2,2 mm lateral a bregma. Em seguida, o mouse foi colocado sobre uma estrutura de cabeça estereotáxica e uma seringa Hamilton 26-G foi usada para injetar 0,04U de colagenase tipo IV bacteriana (Sigma, St. Louis, MO, Estados Unidos) em 0,5 μL Buffer Salino Fosfato (pH 7,4; PBS) no striatum esquerdo (3,0 mm) sob orientação estereotáxica. Após a remoção da agulha, foi utilizada cera óssea para selar o orifício da rebarba. Os ratos foram mantidos a 37 ± 0,5°C usando um pequeno controlador de temperatura animal durante todo o procedimento. O padrão temporal do hematoma após ICH é fornecido (Figura Suplementar S1).
Western Blotting
Ratos foram anestesiados e transardialmente perfurados com PBS. O tecido cerebral Ipsilateral (tanto hematológico quanto peri-hematológico) foi coletado em tampão RIPA contendo inibidores de protease e fosfatase e submetido à sonicação. As amostras foram então centrifugadas a 14.000 rpm durante 5 min a 4°C para coletar o sobrenadante. Usando um kit de ensaio de proteína BCA (Pierce, Rockford, IL, Estados Unidos) as concentrações de proteína foram estimadas, e 30-50 microgramas de amostras foram executados em um gel de 4-20% de dodecil sulfato de sódio-poliacrilamida e transferidos para uma membrana de difluoreto de polivinilideno (PVDF). Os bloqueios foram incubados com o respectivo anticorpo primário, de um dia para o outro a 4°C. Seguiu-se uma incubação de 2-h com o respectivo anticorpo secundário marcado com Alexa Fluor. Os blots foram lidos usando um sistema de imagem quase infravermelha Li-Cor Odyssey e a quantificação foi feita usando o software Quantity One (Bio-Rad, Foster City, CA, Estados Unidos).
Immunohistochemistry
Ratos foram anestesiados e transardialmente perfurados com PBS. Os cérebros foram coletados e colocados em paraformaldeído a 4% durante a noite a 4°C, e depois congelados. Os cérebros foram então cortados em cortes coronais de 25 mm usando um criostato e montados em lâminas de vidro. As secções foram incubadas durante 2 h em 10% de soro normal de burro à temperatura ambiente. Isto foi seguido por uma incubação nocturna com o respectivo anticorpo primário a 4°C. Após a lavagem, os cortes foram incubados com o correspondente anticorpo secundário com o respectivo agente antiespumante Alexa à temperatura ambiente, durante 1 h. A imunofluorescência foi determinada usando um microscópio laser Zeiss LSM510 Meta confocal e a co-localização celular foi determinada, como descrito anteriormente (Laird et al., 2010). Foram analisadas três secções não consecutivas por animal e um mínimo de 3 campos aleatórios ao redor do hematoma.
Enzyme Linked Immunosorbent Assay
RAW 264,7, uma linha de células de macrófagos murinos, foram cromadas numa placa de 24 poços e permitidas a incubação durante 48 h em DMEM (Dulbecco’s Modified Eagle Medium) contendo 5% Soro Bovino Fetal, 5% Soro de Crescimento Bovino e 1% Penicilina/Streptomicina. As células foram então incubadas com Galectina-1 recombinante de rato (6,25 ou 12,5 μg/ml; R&D Systems, Minneapolis, MN, Estados Unidos) durante 1 h e foi seguido por um tratamento de 18 h com LPS (100 ng/ml) ou hemin (30 μg/ml). O sobrenadante foi coletado e utilizado para a detecção de IL-6, por ELISA, conforme instruções do fabricante (Biolegend, San Diego, CA, Estados Unidos). Resumidamente, uma placa de 96 poços foi revestida durante a noite a 4°C com um anticorpo de captura específico. Após um bloqueio de 1 h, o sobrenadante de cultura celular foi adicionado aos poços e incubado durante 2 h à temperatura ambiente. Quaisquer materiais não ligados foram removidos por lavagem e uma solução de anticorpos de detecção foi adicionada aos poços e deixada incubar durante 1 h à temperatura ambiente. Após lavagem adicional, 100 μl de solução de Avidin- Horse Radish Peroxidase (HRP) foi adicionada a cada poço durante 30 min à temperatura ambiente. A solução de substrato foi adicionada aos poços após lavagem para o desenvolvimento da cor. Foi utilizada uma solução de paragem, e a placa foi lida a 450 nm utilizando um leitor de placas de microtitulação (Bio-Tek, Epoch).
Genetic Knockdown of Galectin-3
RAW 264.7 células foram transfectadas com siRNA de controle (ON-TARGET mais Pool não-alvo; GE Dharmacon) ou Galectin-3 siRNA (ON-TARGET mais Mouse Lgals3 siRNA; GE Dharmacon) usando o Reagente de Transferência HiPerFect (QIAGEN) de acordo com as instruções do fabricante. O knockdown de Galectin-3 foi verificado 48h após a transfecção por western blotting como descrito anteriormente.
Análise Estatística
Os dados foram analisados usando teste t ou análise de variância unidirecional seguida pelo teste post-hoc Student-Newman-Keuls e foram expressos como média ± Erro Padrão (SE). Um p-valor de < 0,05 foi considerado significativo.
Resultados
Padrão de Expressão Temporal de Galectina-1 e Galectina-3 após ICH
Para avaliar se a lesão hemorrágica resulta em modulação da expressão de Galectina-1 e Galectina-3 no cérebro, a ICH ou Sham foi induzida em camundongos usando o método de injeção de colagenase. Dado o papel emergente da Galectina-1 e da Galectina-3 nas respostas neuroimunes, as seções ipsilaterais do cérebro de camundongos xamânicos ou ICH foram submetidas a avaliação empregando tanto a análise de western blotting quanto a imuno-histoquímica em vários pontos de tempo, desde o primeiro dia até o sétimo dia após a cirurgia, um período de tempo pós-injúria, que exibiu notável indução tanto de ativação pró- como anti-inflamatória de microglia/macrófagos, bem como astrocitos após a ICH (Sukumari-Ramesh et al, 2012b, 2016; Bonsack et al., 2016).
Notadamente, cortes cerebrais de áreas cerebrais falsas ou contralaterais da ICH exibiram expressão muito marginal ou indetectável de Galectina-1 e Galectina-3, enquanto a expressão aumentada de Galectina-1 e Galectina-3 foi observada no terceiro dia, quinto dia e sétimo dia após a ICH (Figuras 1, 2). Nesta linha, o número de células imunopositivas de Galectina-1 aumentou significativamente em aproximadamente 4, 6 e 4 vezes nos dias 3, 5 e 7 pós -ICH, respectivamente, em comparação com a farsa (Figura 1B). Esta observação foi posteriormente validada através da análise de western blotting, que revelou uma notável e significativa indução de Galectina-1 a partir do terceiro dia ICH pós -ICH, em comparação com a farsa (Figuras 1C,D). Além disso, a indução de Galectina-3 (Figura 2) espelhou a expressão de Galectina-1 após a ICH e as células imunopositivas de Galectina-3 foram aproximadamente 15, 28 e 24 vezes maiores no dia 3, dia 5 e dia 7 após a ICH (Figura 2B) em comparação com a farsa e o western blotting seguido pela análise densitométrica confirmou o aumento da expressão de Galectina-3 após a ICH (Figuras 2C,D).
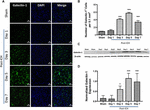
Figura 1. Aumento da expressão da Galectina-1 após a ICH. (A) Imagens confocais representando o padrão de expressão temporal da Galectina-1 após a ICH (barra de escala = 20 μm; n = 3-5 por grupo). (B) Número médio de células positivas de Galectina-1 por 0,1 mm2 no striatum ipsilateral. (C) O aumento da expressão de Galectina-1 foi confirmado pela mancha ocidental de tecido cerebral do estriato ipsilateral. (D) Análise densitométrica (n = 3-5 por grupo) dos dados do western blotting. ∗p < 0,05, ∗∗∗p < 0,001 vs. sham.
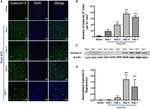
Figure 2. Expressão aumentada de Galectin-3 após ICH. (A) Padrão de expressão temporal da Galectina-3 na área perihematomal após a ICH. As imagens confocais representativas mostram um notável aumento na expressão da Galectina-3 após a ICH em comparação à Sham (barra de escala = 20 μm; n = 3-5 por grupo). (B) O número médio de células positivas de Galectina-3 por 0,1 mm2 no striatum ipsilateral. (C) A expressão temporal da Galectina-3 foi ainda mais confirmada usando o western blotting. (D) Análise densitométrica (n = 3-5 por grupo) dos dados de western blotting. ∗∗p < 0,01, ∗∗∗p < 0,001 vs. sham.
Localização celular de Galectina-1 e Galectina-3 Após ICH
Para determinar a localização celular de Galectina-1 e Galectina-3 após ICH, os cortes cerebrais foram submetidos a imunossintéticos de duplo rótulo. A expressão da Galectina-1 foi observada principalmente nos astrocitos GFAP-positivos (Figura 3A) e a contagem de células estereotáxicas revelou que 85% das células positivas de Galectina-1 co-expressas de GFAP após a ICH. Além disso, a expressão da Galectina-1 também foi observada na Iba1- microglia/macrófagos positivos após ICH (Figura 3B), mas apenas 12% das células positivas de Galectina-1 co-expressas de Iba1.
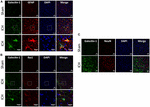
Figure 3. A expressão da Galectina-1 é observada principalmente nas células gliais após a ICH. As seções cerebrais foram duplamente imunizadas para (A) Galectin-1 e GFAP, (B) Galectin-1 e Iba1, (o painel mais baixo representa as imagens de alta ampliação) e (C) Galectin-1 e NeuN (barra de escala = 20 μm; n = 3 por grupo). A expressão da Galectina-1 foi observada principalmente em células positivas GFAP e em um subconjunto de células positivas Iba1. As células NeuN positivas não expressaram Galectina-1 (n = 3 por grupo).
Em contraste, a expressão da Galectina-3 foi em sua maioria confinada às células Iba1-positivas (Figura 4A) e a expressão da Galectina-3 esteve ausente nas células GFAP-positivas (Figura 5A) indicando a expressão celular diferencial da Galectina-1 e da Galectina-3 após a ICH. Além disso, a expressão da Galectina-3 foi observada em células pró-inflamatórias, marcador microglial M1 ou macrofágico, células CD16/32-positivas (Figura 4B) implicando um novo papel da Galectina-3 nas respostas neuroinflamatórias após a ICH. Notadamente, 88 e 92% das células positivas de Galectina-3 coexpressavam células Iba1 e CD16/32-positivas, respectivamente. De notar que a Galectina-3 expressando microglia ou macrófagos exibiu fenótipo fagocitário (Figuras 4A,B) implicando o seu papel inexplorado na fagocitose mediada por microglia ou macrófagos após a ICH. Além disso, células NeuN-positivas não expressaram Galectina-1 ou Galectina-3 (Figuras 3C, 5B).
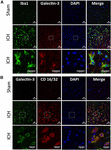
Figura 4. Expressão da Galectina-3 em microglia/macrófagos após ICH. Os cortes cerebrais foram imunizados para (A) Galectin-3 e Iba1, e (B) Galectin-3 e CD 16/32. Tanto Iba1 (um marcador de microglia/macrófagos) quanto CD16/32 (um marcador de microglia ou macrófagos proinflamatórios M1) – células positivas, co expressado Galectin-3 (n = 3 por grupo).
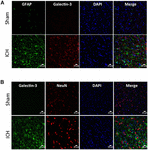
Figure 5. Localização celular da Galectina-3 após a ICH. Seções cerebrais foram duplamente imunizadas com (A) Galectin-3 e GFAP, e (B) Galectin-3 e NeuN. A expressão da Galectina-3 estava ausente nas células GFAP-positivas ou NeuN-positivas. Barra de escala = 20 μm; n = 3 por grupo.
Galectina-1 e Galectina-3 Regulação mediada da resposta inflamatória
Para estabelecer o possível papel funcional da Galectina-1 e Galectina-3 após a ICH, realizámos estudos in vitro. A Galectina-1 recombinante (6,25 e 12,5 μg/ml) atenuou significativamente a liberação induzida por LPS de uma citocina pró-inflamatória, a Interleucina -6 (IL-6) das células RAW 264,7, conforme estimado pelo ELISA em comparação aos controles (Figura 6), implicando um papel regulador negativo da Galectina-1 na inflamação.

Figura 6. Galectina-1 recombinante e resposta inflamatória. Antes da estimulação LPS (100 ng/ml), as células Raw 264,7 foram tratadas com Galectina-1 recombinante, e a liberação de IL-6 foi medida usando ELISA, como detalhado nos métodos. A Galectina-1 recombinante reduziu significativamente a liberação de IL-6 induzida por LPS a partir de 246,7 células RAW (n = 4 por grupo). ∗∗∗p < 0,001 vs. LPS.
Para testar o papel funcional da Galectina-3, realizamos a derrubada genética mediada por siRNA da Galectina-3 em RAW 264.7 células e examinou a resposta inflamatória. O silenciamento genético com siRNA reduziu significativamente a expressão de Galectina-3 em 264,7 células RAW em 52,95% como evidenciado pela mancha ocidental (Figuras 7A,B). Notavelmente, o knockdown genético de Galectin-3 com siRNA medicado não modulou a liberação de IL-6 induzida por LPS (Figura 7C) enquanto que o knockdown genético de Galectin-3 aumentou significativamente o hemin (um metabolito de hemoglobina que se acumula em alta concentração nos hematomas intracranianos) -induziu a liberação de IL-6 (Figura 7D) implicando um papel inexplorado de Galectin-3 na modulação da resposta inflamatória após ICH.
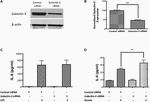
Figura 7. Galectina-3 e resposta inflamatória (A) 246,7 células RAW foram tratadas com siRNA controle ou siRNA de Galectina-3 como detalhado nos métodos e o knockdown genético de Galectina-3 foi verificado usando (A) western blotting seguido por (B) análise densitométrica. ∗∗∗p < 0,001 vs. siRNA de controle. (C) O knockdown de Galectin-3 não modulou a liberação induzida por LPS de IL-6 (D) enquanto que a liberação significativamente não-regulada de IL-6 a partir de células RAW 246,7 em comparação ao controle (n = 3 por grupo). ∗∗p < 0,01 vs. hemin.
Discussão
Galectinas são uma família de proteínas de ligação endógena de carboidratos que desempenham papéis críticos tanto em condições fisiológicas como patológicas, interagindo com receptores glicosilados na superfície celular e modulando as vias de sinalização intracelular (Perillo et al, 1995, 1998; Yang et al., 1996; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002; Laaf et al., 2019). As galectinas apresentam uma semelhança significativa de sequência no seu domínio de reconhecimento de carboidratos (CRD) com uma afinidade acrescida com β-galactosídeos e são originalmente definidas pela sua capacidade de reconhecer o dissacarídeo N-acetillactosamina (Barondes et al., 1994a,b; Kasai e Hirabayashi, 1996). Entretanto, estudos recentes demonstram diferenças substanciais em suas propriedades de ligação aos carboidratos (Hirabayashi et al., 2002; Leffler et al., 2002; Carlsson et al., 2007).
Galectina-1, o membro mais ubíquamente expresso da família da galectina (Stillman et al., 2006) tem sido implicado na regulação da imunidade inata e adaptativa e está presente tanto em locais intracelulares quanto extracelulares (Verschuere et al., 2014). As funções extracelulares da Galectina-1 dependem em grande parte das propriedades de ligação dos carboidratos, enquanto as funções intracelulares envolvem principalmente interações independentes dos carboidratos (Verschuere et al., 2014). Consistente com o papel da Galectina-1 na resposta imune na periferia, a Galectina-1 é conhecida por suprimir a ativação de macrófagos (Barrionuevo et al., 2007), promove a apoptose seletiva de células T (Toscano et al., 2007), induz a secreção de citocinas anti-inflamatórias, IL-10 (van der Leij et al., 2004; Cedeno-Laurent et al., 2012), e atenua a produção de óxido nítrico (NO) por macrófagos (Correa et al., 2003).
Galectina-1 é amplamente expressa nos tecidos nervosos em estágios embrionários, mas torna-se restrita principalmente aos tecidos periféricos após a maturação (Horie e Kadoya, 2002). Consistentemente, o striatum cerebral não lesionado exibe expressão marginal de Galectina-1. No entanto, após uma lesão cerebral hemorrágica foi observada uma expressão muito notável de Galectina-1 em astrocídeos GFAP-positivos. Nessa linha, a Galectina-1 está implicada na diferenciação dos astrócitos e posterior liberação de BDNF (fator neurotrófico derivado do cérebro) após uma lesão cerebral que implica em um papel da Galectina-1 na neuroproteção (Sasaki et al., 2004; Qu et al., 2010). Além disso, a Galectina-1 é um dos principais reguladores da neurogênese de adultos através de sua capacidade de ligação de carboidratos e promove a recuperação funcional após acidente vascular cerebral (Ishibashi et al., 2007). A administração de Galectina-1 reduziu a apoptose dos neurônios, diminuiu o volume de infarto cerebral e melhorou a função neurológica induzida pela isquemia cerebral (Qu et al., 2011). Além disso, neurônios nativos e recombinantes da galectina-1 protegeram os neurônios cerebelares de camundongos e ratos dos efeitos neurotóxicos do glutamato (Lekishvili et al., 2006). De notar que a galectina-1 desactiva a microglia inflamatória e protege da neurodegeneração induzida pela inflamação (Starossom et al., 2012). Além disso, nossos estudos demonstraram que a Galectina-1 recombinante atenua a liberação de uma citocina pró-inflamatória, IL-6 de macrófagos murinos estimulados por LPS, RAW 264,7 em comparação aos controles que implicam um papel regulador negativo da Galectina-1 na inflamação.
Galectina-1 é um dos ligantes endógenos da CD45 (Walzel et al., 1999), que regula a ativação de microglia/macrófagos. Além disso, a interação da Galectina-1 com a CD45 leva à retenção desta glicoproteína na membrana plasmática e ao aumento de sua atividade fosfática. Estudos recentes demonstraram que a CD45 regula negativamente a ativação proinflamatória da microglia M1, mas promove o fenótipo antiinflamatório M2 através da modulação da proteína cinase mitogênica ativada p38 (p38MAPK), ligação do elemento de resposta cAMP (CREB) e fator nuclear kappa-light-chain-enhancer das células B ativadas (NF-kB) sinalizando vias (Starossom et al., 2012). Este efeito envolveu a ligação de Galectina-1 ao núcleo 2 O-glycans em CD45 sugerindo que a expressão de moieties de glicanos em microglial/macrófagos ativados é necessária para a ligação e função da Galectina-1 (Starossom et al., 2012). Além disso, sugere-se que a Galectina-1 suprimiu a neuroinflamação induzida por metanfetaminas nas células endoteliais microvasculares do cérebro humano (Parikh et al., 2015) e a Galectina-1 esteja envolvida no crescimento neurite e na conectividade sináptica. No total, os dados sugerem que a indução de Galectina-1 em astrocitos reativos após a HIC pode ser um mecanismo de comunicação intercelular facilitando a regulação da neuroproteção mediada por astrocitos após a HIC, o que justifica investigação adicional.
Galectina-3 é uma proteína do tipo quimérico 25-35 kDa com funções fortemente dependentes da localização (Thomas e Pasquini, 2018). A expressão da Galectina-3 foi encontrada no núcleo, e citoplasma (Liu et al., 2002). Além disso, macrófagos e microglia ativada podem liberar Galectina-3 no espaço extracelular levando à remodelação da matriz extracelular e alteração da resposta inflamatória, respectivamente (Li et al., 2008; Jeon et al., 2010). Ao invés da clássica via endoplasmática de retículo/Golgi de secreção, a Galectina-3 segue uma via alternativa de secreção e exportação (Mehul e Hughes, 1997) e ao ser liberada, a Galectina-3 interage com vários receptores extracelulares. No entanto, a Galectina-3 está intimamente ligada à cascata inflamatória das reacções; o papel funcional preciso da Galectina-3 na neuroinflamação é muito controverso. No entanto, é relatado que a galectina-3 liberada pela microglia atuou como um ligante endógeno TLR-4 (Toll Like Receptor-4) (Burguillos et al., 2015). Além disso, a deleção genética da Galectina-3 reduziu a perda neuronal e a administração do anticorpo Galectina-3 exerceu efeitos neuroprotetores em um modelo pré-clínico de lesão cerebral traumática (Yip et al., 2017), implicando em conjunto um papel prejudicial da Galectina-3 após uma lesão cerebral. Em contraste, a deleção dirigida da Galectina-3 exacerbou o dano cerebral isquêmico e a neurodegeneração após a isquemia cerebral (Lalancette-Hebert et al., 2012) sugerindo um papel neuroprotetor da Gelectina-3 após o dano cerebral. Além disso, a Galectina-3 contribui para a angiogênese e neurogênese implicando seu possível papel no reparo cerebral pós-isquêmico (Yan et al., 2009). A Galectina-3 também promoveu a diferenciação oligodendroglia, contribuindo para a recuperação funcional após desmielinização (Pasquini et al., 2011). Estes papéis funcionais conflitantes da Galectina-3 após a neuropatologia podem ser devidos à expressão diferencial subcelular da Galectina-3 ou devido à diferença na fisiopatologia dos distúrbios cerebrais que justifique uma investigação mais aprofundada.
Consistente com outras condições neuropatológicas, observamos uma expressão elevada de Galectina-3 após a ICH e a expressão foi predominantemente observada nas células Iba1 positivas, as células inflamatórias do SNC. As células Iba1 positivas após a ICH podem ser microglia ou macrófagos infiltrantes, que desempenham papéis na resposta imune inata. Estudos recentes demonstram que as microglia e os macrófagos podem ter papéis diferenciais após a patologia cerebral (Gao et al., 2017). Nesta linha, estudos com cultura microglial primária documentam um papel pró-inflamatório da Galectina-3 (Burguillos et al., 2015), enquanto estudos com macrófagos demonstram um papel anti-inflamatório (MacKinnon et al., 2008), o que justifica uma investigação mais aprofundada. Além disso, a derrubada genética de Galectina-3 em células RAW 246,7 aumentou a liberação induzida por hemenina de IL-6, uma citocina pró-inflamatória que implica um papel da Galectina-3 nas respostas inflamatórias após a ICH. Além disso, a Galectina-3 expressando microglia ou macrófagos exibiu fenótipo fagocitário implicando seu papel inexplorado na fagocitose microglial ou mediada por macrófagos, que desempenha um papel fundamental na resolução do hematoma e subsequente recuperação cerebral após a HIC. Consistentemente, relatórios recentes sugerem que macrófagos que se acumulam no SNC durante a infecção parasitária expressam abundantemente Galectina-3 (Quenum Zangbede et al., 2018) e células microglia fagocitosas ativadas via Galectina-3 (Nomura et al., 2017). Além disso, níveis elevados de Galectina-3 plasmático foram fortemente associados à inflamação, gravidade e maus resultados em pacientes com ICH aguda (Yan et al., 2016). Portanto, mais estudos são necessários elucidando os papéis funcionais da Galectina-3 após a ICH.
Conclusão
Galectina-1 e Galectina-3 exibiram uma expressão muito profunda e aumentada do 3º ao 7º dia após a ICH, na região cerebral perihematômica, em comparação com Sham. Além disso, a expressão da Galectina-1 foi observada principalmente nos astrocíticos GFAP positivos, enquanto a expressão da Galectina-3 foi observada principalmente nas células Iba1 e CD16/32 positivas, as células inflamatórias do SNC. Além disso, estudos genéticos revelaram um papel regulador negativo tanto da Galectina-1 quanto da Galectina-3 na liberação de uma citocina pró-inflamatória, a IL-6, dependendo do estímulo. No total, os dados sugerem que a Galectina-1 e a Galectina-3 poderiam ser direcionadas na modulação das respostas gliais e, portanto, do dano cerebral após a ICH, o que justifica uma investigação mais profunda.
Declaração Ética
Estudos anímicos foram revisados e aprovados pelo Comitê de Uso Animal para Pesquisa e Educação da Universidade Augusta, em conformidade com as diretrizes do NIH e USDA.
Contribuições dos autores
FB realizou os estudos imunohistoquímicos, de cultura de células e western blotting e participou da análise dos dados. SS-R concebeu e desenhou os experimentos, conduziu as cirurgias em animais, estudos genéticos e análise de dados, e redigiu o manuscrito. Ambos os autores leram e aprovaram o manuscrito final.
Funding
Este trabalho foi apoiado por subsídios dos Institutos Nacionais de Saúde (R01NS107853) e da Associação Americana do Coração (14SDG18730034) à SS-R.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
FIGURA S1 | O padrão temporal do hematoma após a HIC.
A abreviaturas
CD16/32, Cluster of Differentiation 16/32; CD45: Cluster of Differentiation 45; CNS, sistema nervoso central; ELISA, ensaio imunossorbente enzimático; GFAP, proteína glial fibrilária ácida; Hb, hemoglobina; Iba1, molécula adaptadora de ligação de cálcio ionizada 1; ICH, hemorragia intracerebral; LPS, lipopolissacarídeo; NeuN, núcleos neuronais; PBS, tampão fosfato salino; RIPA, radioimunoprecipitação.
Aguilar, M. I.., e Freeman, W. D. (2010). Hemorragia intracerebral espontânea. Semin. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D., e Dore, S. (2017). Eficácia do laropiprante na minimização da lesão cerebral após hemorragia intracerebral experimental. Rep. Sci. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., e Adamson, C. (2012). Thrombin e hemin como fatores centrais nos mecanismos de lesão cerebral secundária induzida por hemorragia intracerebral e como potenciais alvos de intervenção. Neurocirurgia. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galectinas: uma família de lectinas animais beta-galactosídicas de ligação. Cell 76, 597-598. doi: 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., e Leffler, H. (1994b). Galectins. Estrutura e função de uma grande família de lectins animais. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). Uma nova função para a galectina-1 no cruzamento da imunidade inata e adaptativa: a galectina-1 regula a fisiologia monócito/macrófago através de um caminho nãoapoptótico dependente da ERK. J. Imunol. 178, 436-445. doi: 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr., e Sukumari-Ramesh, S. (2016). Expressão aumentada da TSPO após hemorragia intracerebral: um papel na inflamação? J. Neuroinflamam. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American heart association/american stroke association stroke stroke council, high blood pressure research council, and the quality of care and outcomes in research interdisciplinary working group. Circulação 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). A galectina-3 com microglia-secreta actua como um receptor 4 ligando e contribui para a activação microglial. Cell Rep. 10, 1626-1638. doi: 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). As microglia ativadas são menos vulneráveis à toxicidade por hemin devido à inibição da ativação de JNK e p38 MAPK dependente de óxido nítrico. J. Imunol. 187, 1314-1321. doi: 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). Affinity of galectin-8 and its carbohydrate recognition domains for ligands in solution and at the cell surface. Glycobiology 17, 663-676. doi: 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). Genomic profiles of damage and protection in human intracerebral hemorrhage. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi: 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K., e Dimitroff, C. J. (2012). Galectina-1 desencadeia uma assinatura imunoregulatória nas células Th funcionalmente definidas pela expressão IL-10. J. Immunol. 188, 3127-3137. doi: 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M., and Regan, R. F. (2017). Astrocyte heme oxygenase-1 reduz a mortalidade e melhora o resultado após hemorragia intracerebral induzida por colagenase-induzida. Neurobiol. Dis. 102, 140-146. doi: 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A., e Rabinovich, G. A. (2003). Efeitos opostos da galectina-1 nas vias metabólicas alternativas da L-arginina em macrófagos residentes, inflamatórios e ativados. Glycobiology 13, 119-128. doi: 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R., and Bishop, G. M. (2011). Absorção, metabolismo e toxicidade do hemin em neurônios cultivados. Neuroquímica. Int. 58, 804-811. doi: 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., et al. (2017). Funções opostas da TNFR2 microglial e macrofágica na patogênese da encefalomielite auto-imune experimental. Cell Rep. 18, 198-212. doi: 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R., and Watt, D. J. (2002). O efeito da galectina-1 na diferenciação de fibroblastos e miooblastos in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A., e Aronowski, J. (1999). Fator nuclear-kappaB e morte celular após hemorragia intracerebral experimental em ratos. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). Oligossacarídeo especificidade das galectinas: uma busca por cromatografia de afinidade frontal. Biochim. Biófilos. Acta 1572, 232-254. doi: 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H., and Kadoya, T. (2002). Galectina-1 desempenha papéis essenciais nos tecidos nervosos de mamíferos adultos. Papéis da galectina-1 oxidada. Glycoconjugate J. 19, 479-489. doi: 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., et al. (2007). Galectina-1 regula a neurogênese na zona subventricular e promove a recuperação funcional após acidente vascular cerebral. Exp. Neurol. 207, 302-313. doi: 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., and Park, E. J. (2010). Galectina-3 exerce ações reguladoras do tipo citocina através do caminho JAK-STAT. J. Immunol. 185, 7037-7046. doi: 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., and Hirabayashi, J. (1996). Galectins: uma família de lectins animais que decifra glicócodes. J. Biochem. 119, 1-8. doi: 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., and Kren, V. (2019). Interações galectina-carboidrato em biomedicina e biotecnologia. Tendências Biotecnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R., e Dhandapani, K. M. (2010). Curcumin atenua o edema cerebral após traumatismo craniano em ratos: um possível papel da aquaporina-4? J. Neuroquímica. 113, 637-648. doi: 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., et al. (2012). Galectina-3 é necessária para ativação e proliferação de microglia residente em resposta a lesão isquêmica. J. Neuroci. 32, 10383-10395. doi: 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., e Poirier, F. (2002). Introdução às galectinas. Glycoconjugate J. 19, 433-440. doi: 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Deterioração neurológica precoce na hemorragia intracerebral: preditores e fatores associados. Neurologia 63, 461-467. doi: 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., e Brown, D. R. (2006). A galectina-1 do rato inibe a toxicidade do glutamato modificando a expressão do receptor NR1 NMDA. Eur. J. Neurosci. 24, 3017-3025. doi: 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., et al. (2008). Galectina-3 é um regulador negativo da inflamação lipopolissacarida-mediada. J. Immunol. 181, 2781-2789. doi: 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). Heme ativa a lesão inflamatória mediada por TLR4 via MyD88/TRIF em hemorragia intracerebral. J. Neuroinflamam. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., e Wang, J. L. (2002). Funções intracelulares das galectinas. Biochim. Biófilos. Acta 1572, 263-273. doi: 10.1016/s0304-4165(02)00313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H., et al. (2008). Regulação da ativação alternativa de macrófagos por galectina-3. J. Immunol. 180, 2650-2658. doi: 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., e Hughes, R. C. (1997). Alvejamento da membrana plasmática, desabrochamento vesicular e liberação de galectina 3 do citoplasma de células de mamíferos durante a secreção. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., e Lee, S. J. (2017). A molécula de Heme funciona como um agonista endógeno do astrocito TLR2 para contribuir para o dano cerebral secundário após a hemorragia intracerebral. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., and de Bono, D. P. (1999). A Galectina 1 modula a fixação, propagação e migração de células musculares lisas vasculares cultivadas através de interacções com receptores celulares e componentes de matriz extracelular. J. Vasc. Res. 36, 47-58. doi: 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C., e Brown, G. C. (2017). Microglia desialylate ativada e células fagocitose via neuraminidase. Galectina-3, e Mer Tyrosine Kinase. J. Immunol. 198, 4792-4801. doi: 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., et al. (2015). Galectina-1 suprime a neuroinflamação induzida por metanfetaminas nas células microvasculares endoteliais do cérebro humano: papel neuroprotetor na manutenção da integridade da barreira cerebral do sangue. Brain Res. 1624, 175-187. doi: 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., et al. (2011). Galectin-3 conduz a diferenciação oligodendrocyte para controlar a integridade e a função da mielina. Morte celular. Dif. 18, 1746-1756. doi: 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., e Baum, L. G. (1998). Galectinas: moduladores versáteis da adesão celular, da proliferação celular e da morte celular. J. Mol. Med. (Berl.) 76, 402-412. doi: 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J., e Baum, L. G. (1995). Apoptose de células T mediadas por galectina-1. Nature 378, 736-739. doi: 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., e Gordon, S. (1998). Reconhecendo a morte: a fagocitose das células apoptóticas. Trends Cell Biol. 8, 365-372. doi: 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). Galectina-1 atenua as lesões associadas à astrogliose e melhora a recuperação de ratos após isquemia cerebral focal. J. Neurochem. 116, 217-226. doi: 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. P., Tang, Y. X., Zhang, Q., Tian, D. S., et al. (2010). Galectina-1 melhora a produção astrocítica de BDNF e melhora o resultado funcional em ratos após a isquemia. Neurochem. Res. 35, 1716-1724. doi: 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J., and Mishra, B. B. (2018). A galectina-3 em macrófagos M2 desempenha um papel protetor na resolução da neuropatologia em infecção parasitária cerebral regulando a rotação de neutrófilos. J. Neurosci. 38, 6737-6750. doi: 10.1523/jneurosci.3575-17.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Ling, G. S., Khan, J., Suri, M. F., Miskolczi, L., Guterman, L. R., et al. (2001a). Análise quantitativa de células lesadas, necróticas e apoptóticas em um novo modelo experimental de hemorragia intracerebral. Critérios. Care Med. 29, 152-157. doi: 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H., and Hanley, D. F. (2001b). Hemorragia intracerebral espontânea. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M., e Grotta, J. C. (2006). Últimos avanços na hemorragia intracerebral. Moeda. Neurol. Neurosci. Rep. 6, 17-22. doi: 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R., and Bishop, G. M. (2009). Toxicidade hemínica: uma fonte evitável de dano cerebral após acidente vascular cerebral hemorrágico. Redox Rep. 14, 228-235. doi: 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K., and Endo, T. (2004). Galectina-1 induz a diferenciação astrocitária, que leva à produção de fator neurotrófico derivado do cérebro. Glycobiology 14, 357-363. doi: 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M., e Inoue, K. (2010). A ativação do receptor P2X7 induz a produção de CXCL2 em microglia através das vias NFAT e PKC/MAPK. J. Neurochem. 114, 810-819. doi: 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., et al. (2012). A Galectina-1 desativa a microglia classicamente ativada e protege da neurodegeneração induzida pela inflamação. Immunity 37,249-263. doi: 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). Galectina-3 e galectina-1 ligam receptores de glicoproteína de superfície celular distintos para induzir a morte das células T. J. Immunol. 176, 778-789. doi: 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., and Alleyne, C. H. Jr. (2016). A administração de terc-butil-hidroquinona atenua a lesão neurológica aguda após hemorragia intracerebral em ratos. J. Mol. Neurosci. MN 58, 525-531. doi: 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., e Dhandapani, K. M. (2012a). Expressão astrocítica específica da sobrevivência após hemorragia intracerebral em ratos: um possível papel na gliose reativa? J. Neurotrauma 29, 2798-2804. doi: 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., e Dhandapani, K. M. (2012b). Astrogliose: um alvo de intervenção na hemorragia intracerebral? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi: 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., e Dhandapani, K. M. (2016). O ácido hidroxâmico suberoylanilida (SAHA) inibidor da deacetilase histonal confere neuroproteção aguda após hemorragia intracerebral em ratos. Transl. Stroke Res. 7, 141-148. doi: 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S., e McColl, S. R. (1997). Chemokine networks in vivo: involvement of C-X-C and C-C chemokines in neutrophil extravasation in vivo in response to TNF-alpha. J. Imunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., e Pasquini, L. A. (2018). Galectin-3-mediated glial crosstalk drives oligodendrocyte differentiation and (Re)myelination. Frente. Célula. Neurosci. 12:297. doi: 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., et al. (2007). A glicosilação diferencial das células efetoras TH1, TH2 e TH-17 regula seletivamente a suscetibilidade à morte celular. Nat. Immunol. 8, 825-834. doi: 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A., and Klijn, C. J. (2010). Incidência, fatalidade e resultado funcional da hemorragia intracerebral ao longo do tempo, de acordo com a idade, sexo e origem étnica: uma revisão sistemática e uma meta-análise. Lancet Neurol. 9, 167-176. doi: 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). Dimeric galectina-1 induz a produção de IL-10 em linfócitos T: uma ferramenta importante na regulação da resposta imunológica. J. Pathol. 204, 511-518. doi: 10.1002/caminho.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., et al. (2014). A galectina-1 derivada da glioma regula a imunidade antitumoral inata e adaptativa. Int. J. Cancer 134, 873-884. doi: 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). Galectin-1 modula especificamente os sinais de TCR para melhorar a apoptose de TCR, mas inibe a produção e proliferação de IL-2. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., e Brock, J. (1999). Galectina-1, um ligante natural para a proteína tipo receptor da tirosina fosfatase CD45. Immunol. Lett. 67, 193-202. doi: 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Pesquisa pré-clínica e clínica sobre inflamação após hemorragia intracerebral. Prog. Neurobiol. 92, 463-477. doi: 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., and Dore, S. (2007). Inflamação após hemorragia intracerebral. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Wu, X. F., Liu, R., Tian, Y., et al. (2015). N-metil-D-aspartic acid receptor 1 (NMDAR1) agrava o dano inflamatório secundário induzido pela via hemin-NLRP3 após hemorragia intracerebral. Queixo. J. Traumatol. 18, 254-258. doi: 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y., e Kirino, T. (2000). A expressão do mRNA da galectina-1 correlaciona-se com o potencial maligno dos gliomas humanos e a expressão da galectina-1 antisense inibe o crescimento de 9 células de glioma. J. Neurosci. Res. 59, 722-730. doi: 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q., e Dai, W. M. (2016). Papel da galectina-3 no plasma como um biomarcador preditivo do resultado após hemorragia intracerebral aguda. J. Neurol. Sci. 368, 121-127. doi: 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R., e Dempsey, R. J. (2009). Galectina-3 medeia a remodelação do tecido pós-isquêmico. Brain Res. 1288, 116-124. doi: 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., e Liu, F. T. (1996). Expressão da galectina-3 modula o crescimento das células T e a apoptose. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi: 10.1073/pnas.93.13.6737
PubMed Abstract | CrossRef Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). A galectina-3 libertada em resposta a traumatismos cerebrais actua como um alarme, orquestrando a resposta imunitária do cérebro e promovendo a neurodegeneração. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C., e Aronowski, J. (2007). Distintos padrões de alterações induzidas por hemorragia intracerebral na subunidade NF-kappaB, expressão iNOS, e COX-2. J. Neuroquímica. 101, 652-663. doi: 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar